1. Hematologija / O.A. Rukavitsin, A.D. Pavlov, E.F. Morshakova [i drugi] / ur. O.A. Rukavitsin. - St. Petersburg: LLC "DP", 2007. - 912 str.
2. Kardiologija. Hematologija / ur. NA. Buna, N.R. Fakultet i drugi - M .: Reed Elsiver LLC, 2009. - 288 str.
3. Vizualna hematologija / Prijevod s engleskog. Pod uredništvom prof. U I. Eršov. - 2. izd. - M.: GEOTAR-Media, 2008. - 116 str.: ilustr.
4. Papayan A.V., Zhukova L.Yu. Anemija u djece: vodič za liječnike. - Sankt Peterburg: PETER. - 2001. - 384 str.
5. Patofiziologija: udžbenik: u 2 sveska / ur. V.V. Novitsky, E.D. Goldberg, O.I. Urazova. - 4. izd. - GEOTAR-Media, 2010. - V.2. - 848 str.: ilustr.
6. Patofiziologija: udžbenik, u 3 sveska: [A.I. Volozhin i drugi]; izd. A.I. Volozhina, G.V. Narudžba. - M .: Izdavački centar "Akademija", 2006.- V.2 - 256 str.: ilustr.
8. Vodič za hematologiju /Ed. A. I. Vorobieva - M.: Nyudiamed, 2007. - 1275 str.
9. Shiffman F.J. Patofiziologija krvi. - M.: Izdavačka kuća BINOM, 2009. - 448 str.
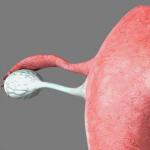
Hemolitička anemija je skupina bolesti karakteriziranih patološki intenzivnim uništavanjem crvenih krvnih stanica, povećanim stvaranjem produkata njihovog raspada, kao i reaktivnim povećanjem eritropoeze. Trenutno se sve hemolitičke anemije obično dijele u dvije glavne skupine: nasljedne i stečene.
Nasljedne hemolitičke anemije, ovisno o etiologiji i patogenezi, dijele se na:
I. Membranopatija eritrocita:
a) "ovisni o proteinima": mikrosferocitoza; ovalocitoza; stomatocitoza; piropoikilocitoza; bolest "Rh-nula";
b) "ovisne o lipidima": akantocitoza.
II. Enzimopatije eritrocita zbog nedostatka:
a) enzimi pentozofosfatnog ciklusa;
b) enzimi glikolize;
c) glutation;
d) enzimi uključeni u korištenje ATP-a;
e) enzimi koji sudjeluju u sintezi porfirina.
III. Hemoglobinopatije:
a) povezan s kršenjem primarne strukture globinskih lanaca;
b) talasemija.
Stečene hemolitičke anemije:
I. Imunohemolitičke anemije:
a) autoimuni;
b) heteroimun;
c) izoimune;
d) transimuni.
II. Stečene membranopatije:
a) paroksizmalni noćna hemoglobinurija(bolest Marchiafava - Micheli);
b) anemija spur stanica.
III. anemija povezana s mehanička oštećenja eritrociti:
a) marširajuća hemoglobinurija;
b) koje nastaju protetikom krvnih žila ili srčanih zalistaka;
c) Moshkovicheva bolest (mikroangiopatska hemolitička anemija).
IV. Toksična hemolitička anemija različitih etiologija.
Mehanizmi razvoja i hematološke karakteristike kongenitalnih hemolitička anemija
Gornja klasifikacija hemolitičke anemije uvjerljivo ukazuje da su najvažniji etiopatogenetski čimbenici u razvoju hemolize eritrocita poremećaji strukture i funkcije membrana eritrocita, njihov metabolizam, intenzitet glikolitičkih reakcija, pentozofosfatna oksidacija glukoze, kao i kvalitativni te kvantitativne promjene u strukturi hemoglobina.
I. Značajke pojedinačni oblici membranopatije eritrocita
Kao što je već spomenuto, patologija može biti povezana s promjenom strukture proteina ili s promjenom strukture lipida membrane eritrocita.
Najčešće proteinski ovisne membranopatije uključuju sljedeće hemolitičke anemije: mikrosferocitozu (Minkowski-Choffardova bolest), ovalocitozu, stomatocitozu, rjeđe oblike - piropoikilocitozu, Rh-nultu bolest. Membranopatije ovisne o lipidima pojavljuju se u malom postotku ostalih membranopatija. Primjer takve hemolitičke anemije je akantocitoza.
Mikrosferocitna hemolitička anemija (Minkowski-Choffardova bolest). Bolest se nasljeđuje autosomno dominantno. Poremećaji mikrosferocitoze temelje se na smanjenom sadržaju proteina spektrina sličnog aktomiozinu u membrani eritrocita, promjeni njegove strukture i kršenju veze s mikrofilamentima aktina i lipidima unutarnje površine membrane eritrocita.
Istodobno dolazi do smanjenja količine kolesterola i fosfolipida, kao i do promjene njihovog odnosa u membrani eritrocita.
Ovi poremećaji čine citoplazmatsku membranu visoko propusnom za natrijeve ione. Kompenzacijsko povećanje aktivnosti Na, K-ATPaze ne osigurava dovoljno uklanjanje natrijevih iona iz stanice. Potonji dovodi do hiperhidratacije eritrocita i pridonosi promjeni njihovog oblika. Eritrociti postaju sferociti, gube svoja plastična svojstva i prolazeći kroz sinuse i intersinusne prostore slezene ozlijeđuju se, gube dio svoje membrane i pretvaraju se u mikrosferocite.
Životni vijek mikrosferocita je oko 10 puta kraći od životnog vijeka mikrosferocita normalni eritrociti, mehanička otpornost je 4-8 puta niža, a osmotska otpornost mikrosferocita je također narušena.
Unatoč kongenitalnoj prirodi mikrosferocitne hemolitičke anemije, njezine prve manifestacije obično se opažaju kod starije djece, adolescenata i odraslih, rijetko kod dojenčadi i starijih osoba.
Bolesnici s mikrosferocitnom anemijom razvijaju žuticu koža i sluznice, povećanje slezene, u 50% bolesnika povećava se jetra, postoji sklonost stvaranju kamenaca u žučni mjehur. U nekih bolesnika mogu se javiti kongenitalne anomalije kostura i unutarnjih organa: lubanja toranj, gotičko nepce, bradi- ili polidaktilija, strabizam, malformacije srca i krvnih žila (tzv. hemolitička konstitucija).
Krvna slika. Anemija različite težine. Smanjen broj crvenih krvnih stanica u perifernoj krvi. Sadržaj hemoglobina tijekom hemolitičke krize smanjuje se na 40-50 g / l, u međukriznom razdoblju je približno 90-110 g / l. Indeks boja može biti normalan ili blago smanjen.
Broj mikrosferocita u perifernoj krvi je različit – od malog postotka do značajnog porasta ukupnog broja eritrocita. Sadržaj retikulocita je stalno povećan i kreće se od 2-5% u međukriznom razdoblju do 20% ili više (50-60%) nakon hemolitičke krize. Tijekom krize mogu se otkriti pojedinačni eritrokariociti u perifernoj krvi.
Broj leukocita u međukriznom razdoblju bio je unutar normalnog raspona, au pozadini hemolitičke krize - leukocitoza s neutrofilnim pomakom formule ulijevo. Broj trombocita je obično normalan.
U punktatu koštane srži utvrđena je izražena hiperplazija eritroblastične klice s povećanim brojem mitoza i znakovima ubrzanog sazrijevanja.
Kod mikrosferocitne anemije, kao i kod drugih hemolitičkih anemija, dolazi do povećanja razine bilirubina u krvnom serumu, uglavnom zbog nekonjugirane frakcije.
Ovalocitna hemolitička anemija (nasljedna eliptocitoza). Ovalociti su filogenetski stariji oblik eritrocita. U krvi zdravi ljudi određuju se u malom postotku - od 8 do 10. U bolesnika s nasljednom eliptocitozom njihov broj može doseći 25-75%.
Bolest se nasljeđuje autosomno dominantno. Patogeneza je posljedica defekta membrane eritrocita, u kojem nedostaje nekoliko frakcija. membranski proteini uključujući spektrin. To je popraćeno smanjenjem osmotske otpornosti ovalocita, povećanjem autohemolize i skraćivanjem životnog vijeka ovalocita.
Uništavanje ovalocita događa se u slezeni, pa većina bolesnika ima povećanje.
Krvna slika. Anemija različite težine, često normokromna. Prisutnost ovalocita u perifernoj krvi više od 10-15%, umjerena retikulocitoza. U serumu krvi, povećanje neizravnog bilirubina. Ovalocitoza se često kombinira s drugim oblicima hemolitičke anemije, poput anemije srpastih stanica, talasemije.
nasljedna stomatocitoza. Tip nasljeđivanja je autosomno dominantan. Ovo je rijetka patologija. Dijagnoza se temelji na otkrivanju osebujne vrste crvenih krvnih zrnaca u krvnom razmazu: neobojeno područje u središtu crvenih krvnih zrnaca okruženo je obojenim područjima spojenim sa strane, što podsjeća na otvorena usta (grčka stoma) . Promjena oblika eritrocita povezana je s genetskim defektima u strukturi membranskih proteina, što dovodi do povećane propusnosti membrane za Na+ i K+ ione (pasivno prodiranje natrija u stanicu povećava se oko 50 puta i oslobađanje kalija iz eritrocita povećava se za 5 puta). Kod većine nositelja anomalije bolest se klinički ne manifestira.
Krvna slika. Bolesnici razvijaju anemiju, često normokromnu. Tijekom hemolitičke krize, nagli pad hemoglobina, visoka retikulocitoza. U serumu krvi povećava se razina neizravnog bilirubina.
Osmotska rezistencija i životni vijek defektnih eritrocita su smanjeni.
Dijagnostička vrijednost je određivanje povećanog broja natrijevih iona u promijenjenim eritrocitima i smanjenje kalijevih iona.
Akantocitna hemolitička anemija. Bolest spada u lipidno ovisne membranopatije, nasljeđuje se autosomno recesivno i manifestira se u ranoj djetinjstvo. Uz ovu patologiju, u krvi pacijenata nalaze se osebujni eritrociti - akantociti (grčki akanta - trn, trn). na površini takvih eritrocita nalazi se od 5 do 10 dugih šiljastih izraslina.
Smatra se da u membranama akantocita dolazi do poremećaja fosfolipidne frakcije - porasta razine sfingomijelina i sniženja fosfatidilkolina. Ove promjene dovode do stvaranja neispravnih eritrocita.
Istodobno, u krvnom serumu takvih bolesnika smanjena je količina kolesterola, fosfolipida, triglicerida, nema β-proteina. Bolest se naziva i nasljedna abetalipoproteinemija.
Krvna slika. Anemija, često normokromne prirode, retikulocitoza, prisutnost eritrocita s karakterističnim šiljastim izraslinama.
U krvnom serumu povećan je sadržaj neizravnog bilirubina.
II. Nasljedna hemolitička anemija povezana s oslabljenom aktivnošću enzima eritrocita
Hemolitička anemija povezana s nedostatkom enzima pentozofosfatnog ciklusa. Insuficijencija glukoza-6-fosfat dehidrogenaze eritrocita nasljeđuje se spolno vezano (X-kromosomski tip). Prema tome kliničke manifestacije bolesti se promatraju uglavnom kod muškaraca koji su naslijedili ovu patologiju od majke s njezinim X kromosomom, a kod homozigotnih žena - na abnormalnom kromosomu. U heterozigotnih žena kliničke manifestacije ovisit će o omjeru normalnih eritrocita i eritrocita s nedostatkom glukoza-6-fosfat dehidrogenaze.
Trenutno je opisano više od 250 varijanti nedostatka glukoza-6-fosfat dehidrogenaze, od kojih su 23 varijante otkrivene u SSSR-u.
Ključna uloga G-6-PDH je njegovo sudjelovanje u obnovi NADP i NADPH2, koji osiguravaju regeneraciju glutationa u eritrocitima. Reducirani glutation štiti crvena krvna zrnca od propadanja u kontaktu s oksidansima. U osoba s nedostatkom glukoza-6-fosfat dehidrogenaze, oksidansi egzogenog i endogenog podrijetla aktiviraju lipidnu peroksidaciju membrane eritrocita, povećavaju propusnost membrane eritrocita, remete ionsku ravnotežu u stanicama i smanjuju osmotsku otpornost eritrocita. Dolazi do akutne intravaskularne hemolize.
Poznato ih je više od 40 razne vrste ljekovite tvari, koji su oksidansi i izazivaju hemolizu eritrocita. Tu spadaju lijekovi protiv malarije, mnogi sulfanilamidni lijekovi i antibiotici, lijekovi protiv tuberkuloze, nitroglicerin, analgetici, antipiretici, vitamini C i K itd.
Hemoliza može biti izazvana endogenim intoksikacijama, kao što je dijabetička acidoza, acidoza u zatajenja bubrega. Hemoliza se javlja kod toksikoze trudnica.
Krvna slika. Hemolitička kriza izazvana medicinski proizvod, popraćeno razvojem normokromne anemije, retikulocitoze, neutrofilne leukocitoze, a ponekad i razvojem leukemoidne reakcije. Reaktivna eritroblastoza zabilježena je u koštanoj srži.
U novorođenčadi s izraženim nedostatkom aktivnosti glukoza-6-fosfat dehidrogenaze hemolitičke krize se javljaju odmah nakon rođenja. Ovo je hemolitička bolest novorođenčadi, koja nije povezana s imunološkim sukobom. Bolest protiče s teškim neurološkim simptomima. Patogeneza ovih kriza nije dobro razjašnjena, sugerira se da je hemoliza izazvana unosom od strane trudnica ili dojilja. lijekovi s hemolitičkim djelovanjem.
Nasljedna hemolitička anemija zbog nedostatka aktivnosti eritrocitne piruvat kinaze. Kongenitalna hemolitička anemija javlja se u osoba homozigotnih za autosomno recesivni gen. Heterozigotni nosioci su praktički zdravi. Enzim piruvat kinaza jedan je od enzima koji okružuju glikolizu, osiguravajući stvaranje ATP-a. U bolesnika s nedostatkom piruvat kinaze smanjuje se količina ATP-a u eritrocitima i nakupljaju se produkti glikolize prethodnih stadija - fosfofenolpiruvat, 3-fosfoglicerat, 2,3-difosfoglicerat, a smanjuje se sadržaj piruvata i laktata.
Kao rezultat smanjenja razine ATP-a, poremećeni su svi energetski ovisni procesi, a prije svega rad Na +, K + -ATPaze membrane eritrocita. Smanjenje aktivnosti Na+, K+-ATP-aze dovodi do gubitka iona kalija u stanici, smanjenja sadržaja monovalentnih iona i dehidracije eritrocita.
Dehidracija crvenih krvnih stanica otežava oksigenaciju hemoglobina i oslobađanje kisika iz hemoglobina u tkivima. Povećanje 2,3-difosfoglicerata u eritrocitima djelomično nadoknađuje ovaj nedostatak, budući da se afinitet hemoglobina za kisik smanjuje kada on stupa u interakciju s 2,3-difosfogliceratom, pa je stoga dostava kisika u tkiva olakšana.
Kliničke manifestacije bolesti su heterogene i mogu se manifestirati kao hemolitičke i aplastične krize, au nekih bolesnika - u obliku blagih teška anemija ili čak asimptomatski.
Krvna slika. Umjerena anemija, često normokromna. Ponekad se otkrije makrocitoza; osmotska otpornost eritrocita je smanjena ili nepromijenjena, tijekom krize povećava se sadržaj neizravnog bilirubina u plazmi. Broj retikulocita u perifernoj krvi tijekom krize naglo se povećava, u nekih bolesnika u krvi se pojavljuju eritrokariociti.
III. Hemoglobinopatije
Ovo je skupina hemolitičkih anemija povezanih s kršenjem strukture ili sinteze hemoglobina.
Postoje hemoglobinopatije uzrokovane abnormalnošću primarne strukture hemoglobina, kvalitativne (anemija srpastih stanica) i uzrokovane kršenjem sinteze lanaca hemoglobina ili kvantitativne (talasemija).
Anemija srpastih stanica. Bolest je prvi opisao Herrick 1910. Godine 1956. Itano i Ingram otkrili su da je bolest posljedica mutacija gena, uslijed čega dolazi do supstitucije aminokiselina u položaju VI β-polipeptidnog lanca hemoglobina glutaminske kiseline neutralnim valinom i počinje se sintetizirati abnormalni hemoglobin S, što je praćeno razvojem izražene poikilocitoze i pojavom srpasti oblici eritrocita.
Razlog za pojavu crvenih krvnih stanica u obliku polumjeseca je taj što hemoglobin S u deoksigeniranom stanju ima 100 puta manju topljivost od hemoglobina A, a također visoka sposobnost do polimerizacije. Zbog toga se unutar eritrocita stvaraju izduženi kristali koji eritrocitu daju oblik polumjeseca. Takvi eritrociti postaju kruti, gube svoja plastična svojstva i lako se hemoliziraju.
Kod homozigotnog nositeljstva govore o anemiji srpastih stanica, a kod heterozigotnog o anomaliji srpastih stanica. Bolest je česta u zemljama "malarijskog pojasa" svijeta (zemlje Mediterana, Bliskog i Srednjeg istoka, Sjev. zapadna Afrika, Indija, Gruzija, Azerbajdžan itd.). Prisutnost hemoglobina S kod heterozigotnih nositelja osigurava im zaštitu od tropske malarije. Kod stanovnika ovih zemalja hemoglobin S se javlja do 40% u populaciji.
Homozigotni oblik bolesti karakterizira umjerena normokromna anemija, sadržaj ukupnog hemoglobina je 60-80 g / l. Broj retikulocita je povećan - 10% ili više. Prosječni životni vijek crvenih krvnih stanica je oko 17 dana. karakteristična značajka je prisutnost u obojenom razmazu eritrocita u obliku srpa, eritrocita s bazofilnom punkcijom.
Hemoliza eritrocita pridonosi razvoju trombotičkih komplikacija. Može doći do višestruke tromboze žila slezene, pluća, zglobova, jetre, moždanih ovojnica, praćeno razvojem srčanog udara u tim tkivima. Ovisno o lokalizaciji tromboze u anemiji srpastih stanica, razlikuje se nekoliko sindroma - torakalni, mišićno-koštani, abdominalni, cerebralni, itd. Pogoršanje anemije može biti povezano s hipoplastičnom krizom, koja se najčešće javlja kod djece u pozadini infekcije. Istodobno se primjećuje inhibicija hematopoeze koštane srži i nestaju retikulociti u perifernoj krvi, smanjuje se broj eritrocita, neutrofila i trombocita.
Hemolitička kriza može biti potaknuta u bolesnika s anemijom srpastih stanica zarazne bolesti, stres, hipoksija. U tim razdobljima naglo se smanjuje broj crvenih krvnih zrnaca, pada razina hemoglobina, pojavljuje se crni urin, ikterično bojenje kože i sluznice, povećava se neizravni bilirubin u krvi.
Uz aplastične i hemolitičke krize kod anemije srpastih stanica uočavaju se sekvestracijske krize u kojima se značajan dio eritrocita taloži u unutarnji organi osobito u slezeni. Kada se eritrociti talože u unutarnjim organima, mogu se uništiti na mjestima taloženja, iako u nekim slučajevima eritrociti ne budu uništeni tijekom taloženja.
Heterozigotni oblik hemoglobinopatije S (anomalija srpastih stanica) kod većine bolesnika je asimptomatski, budući da je sadržaj patološkog hemoglobina u eritrocitima nizak. Mali postotak heterozigotnih nositelja abnormalnog hemoglobina tijekom hipoksičnih stanja (upala pluća, penjanje na visinu) može imati iscjedak tamna mokraća i razne trombotičke komplikacije.
talasemija. Ovo je skupina bolesti s nasljednim kršenjem sinteze jednog od globinskih lanaca, hemolizom, hipokromijom i neučinkovitom eritrocitopoezom.
Talasemija je česta u zemljama Sredozemlja, središnje Azije, Zakavkazja itd. Značajnu ulogu u širenju imaju ekološki i etnički čimbenici, krvno-srodnički brakovi te učestalost malarije na određenom području.
Bolest su prvi opisali američki pedijatri Cooley i Lee 1925. godine (vjerojatno homozigotni oblik α-talasemije).
Etiološki čimbenik talasemije su mutacije regulatornih gena, sinteza abnormalno nestabilne ili nefunkcionalne messenger RNA, što dovodi do poremećaja u stvaranju α-, β-, γ- i δ-lanaca hemoglobina. Moguće je da se razvoj talasemije temelji na teškim mutacijama strukturnih gena kao što su delecije, koje također mogu biti popraćene smanjenjem sinteze odgovarajućih globinskih polipeptidnih lanaca. Ovisno o kršenju sinteze određenih polipeptidnih lanaca hemoglobina, izolirani su α-, β-, δ- i βδ-talasemija, međutim, svaki oblik temelji se na nedostatku glavne frakcije hemoglobina - HbA.
Normalno, sinteza različitih polipeptidnih lanaca hemoglobina je uravnotežena. U patologiji, u slučaju nedostatka u sintezi jednog od globinskih lanaca, dolazi do prekomjerne proizvodnje drugih polipeptidnih lanaca, što dovodi do stvaranja prekomjernih koncentracija nestabilnih abnormalnih hemoglobina različitih vrsta. Potonji imaju sposobnost taloženja i ispadanja u eritrocitu u obliku "inkluzijskih tijela", dajući im oblik meta.
Klasifikacija talasemije:
1. Talasemija uzrokovana kršenjem sinteze globinskog α-lanca (α-talasemija i bolesti uzrokovane sintezom hemoglobina H i Barts).
2. Talasemija uzrokovana poremećenom sintezom β- i δ-globinskih lanaca (β-talasemija i β-, δ-talasemija).
3. Nasljedna postojanost fetalnog hemoglobina, tj. genetski uvjetovano povećanje hemoglobina F u odraslih.
4. Mješovita skupina - dvostruka heterozigotna stanja za gen za talasemiju i gen za jednu od "kvalitetnih" hemoglobinapatija.
α-talasemija. Gen odgovoran za sintezu α-lanca kodiran je s dva para gena koji se nalaze na 11. kromosomu. Jedan od parova je manifestan, drugi je sekundaran. U slučaju razvoja α-talasemije dolazi do delecije gena. U homozigotnoj disfunkciji sva 4 gena, globinski α-lanac je potpuno odsutan. Sintetizira se Barts hemoglobin koji se sastoji od četiri γ-lanca koji ne mogu prenositi kisik.
Nositelji homozigotne α-talasemije nisu održivi - fetus umire in utero sa simptomima vodene bolesti.
Jedan od oblika α-talasemije je hemoglobinopatija H. S ovom patologijom primjećuje se brisanje tri gena koji kodiraju sintezu α-lanaca hemoglobina. Zbog nedostatka α-lanca sintetizira se abnormalni hemoglobin H koji se sastoji od 4 β-lanca. Bolest je karakterizirana smanjenjem broja eritrocita, hemoglobina (70-80 g / l), izraženom hipokromijom eritrocita, njihovim ciljanjem i bazofilnom punkcijom. Broj retikulocita je umjereno povećan.
Delecija jednog ili dva gena koji kodiraju α-lanac uzrokuje blagi nedostatak hemoglobina A, a očituje se blagom hipokromnom anemijom, prisutnošću eritrocita s bazofilnom punkcijom i eritrocita ciljnog tipa, te blagim porastom razine retikulocita. Kao i kod drugih oblika hemolitičke anemije, kod heterozigotne α-talasemije primjećuju se ikterično bojenje kože i sluznice, povećanje neizravnog bilirubina u krvi.
β-talasemija. Javlja se češće od α-talasemije, a može biti u homozigotnom i heterozigotnom obliku. Gen koji kodira sintezu β-lanca nalazi se na 16. kromosomu. U blizini su geni odgovorni za sintezu γ- i δ-lanca globina. U patogenezi β-talasemije, osim delecije gena, dolazi do poremećaja spajanja, što dovodi do smanjenja stabilnosti mRNA.
Homozigotna β-talasemija (Cooleyeva bolest). Najčešće se bolest otkriva kod djece u dobi od 2 do 8 godina. Postoji ikterično bojenje kože i sluznice, povećanje slezene, deformacije lubanje i kostura, zastoj u rastu. U teškom obliku homozigotne β-talasemije ovi se simptomi javljaju već u prvoj godini djetetova života. Prognoza je nepovoljna.
Od strane krvi postoje znakovi teške hipokromne anemije (CP oko 0,5), pad hemoglobina na 20-50 g / l, broj eritrocita u perifernoj krvi je 1-2 milijuna po
Heterozigotna β-talasemija. Karakterizira je benigniji tijek, znakovi bolesti javljaju se u kasnijoj dobi i manje su izraženi. Anemija je umjerena.Sadržaj eritrocita je oko 3 milijuna u 1 mikronu, hemoglobin je 70-100 g / l. Sadržaj retikulocina je 2-5% u perifernoj krvi. Često se detektira anizo- i poikilocitoza, ciljanje eritrocita, tipični su bazofilni punktirani eritrociti. Sadržaj željeza u serumu je obično normalan, rjeđe - blago povećan. U nekih bolesnika neizravni bilirubin u serumu može biti blago povećan.
Za razliku od homozigotnog oblika, kod heterozigotne β-talasemije se ne opažaju deformacije kostura i nema zastoja u rastu.
Dijagnoza β-talasemije (homo- i heterozigotni oblici) potvrđuje se povećanjem sadržaja fetalnog hemoglobina (HbF) i HbA2 u eritrocitima.
Bibliografska poveznica
Chesnokova N.P., Morrison V.V., Nevvazhay T.A. PREDAVANJE 5. HEMOLITIČKA ANEMIJA, KLASIFIKACIJA. MEHANIZMI RAZVOJA I HEMATOLOŠKE KARAKTERISTIKE KONGENITALNE I NASLJEDNE HEMOLITIČKE ANEMIJE // International Journal of Applied and fundamentalna istraživanja. - 2015. - br. 6-1. - Str. 162-167;URL: https://applied-research.ru/ru/article/view?id=6867 (datum pristupa: 18.07.2019.). Predstavljamo vam časopise koje izdaje izdavačka kuća "Academy of Natural History"
PATOFIZIOLOGIJA KRVNOG SUSTAVA. DIZERITROPOETSKA ANEMIJA.
MINISTARSTVO OBRAZOVANJA REPUBLIKE KIRGIZKIRGISKO-RUSKO SLAVENSKO SVEUČILIŠTE
ZAVOD ZA NORMALNU I PATOLOŠKU FIZIOLOGIJU KRSU
Medicinski fakultet
specijalnost "medicina"
PATOFIZIOLOGIJA
KRVNI SUSTAVI.
DIZERITROPOETSKI
ANEMIJA.
Predavanje su pripremili: kandidat medicinskih znanosti, izvanredni profesor Odjela NPP Pak I.V.
Plan predavanja
Etiologija i patogeneza anemije uzrokovane nedostatkom željeza.Glavne kliničke manifestacije.
Etiopatogeneza B-12 i anemije uzrokovane nedostatkom folata.
Patofiziološko utemeljenje glavn
klinički sindromi i hematološke promjene.
Aplastična anemija, etiologija i patogeneza.
Osnovni principi i metode terapije
dizeritropoetska anemija.
Diferencijalna dijagnoza anemije.
Dizeritropoetske anemije Dizeritropoetske anemije N.B.!
Normalna eritropoeza
moguće ako tijelo ima
dovoljno
aminokiseline, željezo,
vitamini B1, B2, B6, B12, C,
folna kiselina,
elementi u tragovima Co, Cu itd.
tvari.
Dizeritropoetske anemije Održavanje eritropoeze
Posebno za učinkovitu eritropoezu
važne su sljedeće tvari:
Vitamin B12
Folna kiselina
Važan za sintezu
stanična DNA
Željezo
Dio hemoglobina
Dizeritropoetske anemije
Klasifikacija
Dizeritropoetske anemije Dizeritropoetske anemije Etiopatogenezanedostatak željeza
anemija
Dizeritropoetske anemije Epidemiologija
Podaci WHO-a, 2004.:
Anemija
2.000.000.000
IDA
1.800.000.000
(90% slučajeva anemije je zbog nedostatka željeza)
nedostatak željeza
3.580.000.000
Anemija uzrokovana nedostatkom željeza je prvi u
popis 38 najčešćih bolesti prema
podaci SZO-a. Povijesni podaci
AI podaci
povijesni
epidemiologija IDA
IDA
epidemiologija
Stoljećima, kloroza ili "blijedo".
bolestan" smatran je znakom neuzvraćene ljubavi i pripisivan
na mladenačke bolesti.
Godine 1832. Pierr Blaud otkrio je učinkovitost sulfata
željezo kod kloroze. Od tada se počinje pripisivati kloroza
bolesti krvi.
IDA čini 80-90% svih anemija.
Prevalencija: 0,2% muškaraca, 2,6% žena.
Rusija:
IDA u 9-13% žena
Ukrajina:
IDA u 20% populacije
Srednja Azija: IDA u 50-60% žena.
Dizeritropoetske anemije
metabolizam željeza
žlijezdaMetabolizam
prehrambeno željezo
10-20 mg/dan
10 %
Gubitak izmeta
10-20 %
urin, epitel
1-2 mg/dan
depo
100-400 mg
usisavanje
u gastrointestinalnom traktu 1-2 mg / dan
75 %
ostalo
procesima
Plazma
transferin 4 mg
eritroblasti
Sinteza Hb
5-15 %
makrofagi
crvene krvne stanice
uništenje 1/120 dana
Dizeritropoetske anemije
RASPODJELA ŽELJEZA U TIJELU
DISTRIBUCIJA ŽELJEZAŽELJEZNI IN
U
DISTRIBUCIJA
ORGANIZAM
ORGANIZAM
hem (protoporfirin i Fe++)
hemoglobin - 75% è transport O2
mioglobina - 5-15% è rezerve O2 u mišićima
enzimi - 0,3% i stanično disanje
nehemski
transferin - 0,1% è prijenos Fe+++ iz plazme u tkiva
feritin i hemosiderin - 10-20% è depo željeza u
jetra
Dizeritropoetske anemije Uloga željeza u ljudskom organizmu
skladištenje i
prijevoz
kisik
energije
razmjena
metabolizam
BAS
podjela
Stanice
biosintetski
procesima
Dizeritropoetske anemije nedostatak željeza u
tijelo
o Dolazi do nedostatka željeza u organizmu,
ako je unos mineralnih
tvari manje od 1 mg dnevno.
Nedostatak željeza u ljudskom tijelu nije samo
hematoloških manifestacija, ali i uzroka
disfunkcija svih stanica (osobito u visoko
aerobna tkiva), uzrokujući negativne posljedice
poremećaji metabolizma željeza u ljudskom tijelu.
Nedostatak ovog vitalnog mikronutrijenta
neizbježno dovodi do poremećaja
hemoglobina, razvoj anemije i, kao rezultat toga, do
trofički poremećaji u organima i tkivima.
Dizeritropoetske anemije
Anemija uzrokovana nedostatkom željeza
- Ovo patološko stanje, okarakteriziransmanjenje količine hemoglobina i crvenih krvnih stanica zbog:
nedostatak unosa željeza
povećana potreba za željezom
prekomjerni gubitak željeza
Dizeritropoetske anemije
Anemija uzrokovana nedostatkom željeza
Anemija uzrokovana nedostatkom željeza -patološko stanje,
karakteriziran smanjenjem
hemoglobina po jedinici volumena krvi
što je posljedica neravnoteže između
primitak, korištenje (izdatak)
ili gubitak) željeza u tijelu.
Dizeritropoetske anemije
kronični gubitak krvi (maternice,
želučane, hemoroidalne, s tumorima)
nedovoljan unos Fe hranom
Malapsorpcija Fe (patologija gastrointestinalnog trakta)
povećani unos Fe tijekom rasta i
razvoj djeteta, tijekom dojenja i
trudnoće, s povećanim tjelesnim
opterećenja
Dizeritropoetske anemije
Etiologija anemije uzrokovane nedostatkom željeza
Dizeritropoetske anemijePATOGENEZA IDA
smanjenje rezervi željeza▼
smanjenje sadržaja serumsko željezo
▼
povećanje ukupnog kapaciteta vezanja željeza u serumu sa
smanjena zasićenost transferina željezom
▼
smanjenje inkorporacije željeza u eritroidne stanice
▼
smanjenje sinteze hema (povećanje protoporfirina u eritroidnom
Stanice)
▼
Anemija uzrokovana nedostatkom željeza
Dizeritropoetske anemije
Glavne kliničke manifestacije anemije nedostatka željeza
Hematološkisindrom
hemičan
hipoksija
- bljedilo kože i
sluznice
- tahikardija
- otežano disanje
- vrtoglavica,
glavobolja
- gubitak pamćenja i
pažnja
- opća slabost
umor
sideropeničan
sindrom
↓Sadržaj Fe(S).
Serumsko željezo je normalno
kod muškaraca - 13-30 µmol / l,
kod žena - 11,5-25 µmol / l
- suha koža
- lomljivi nokti i
dlaka
- poremećaji okusa
- oslabljen osjet mirisa
Dizeritropoetske anemije Dizeritropoetske anemije Dizeritropoetske anemije Dizeritropoetske anemije
sideropenijski sindrom
"sindrom hiposideroze" zbog nedostatka tkivaželjezo, što dovodi do smanjenja aktivnosti mnogih enzima
(citokrom oksidaza, peroksidaza, sukcinat dehidrogenaza itd.).
Znakovi:
izopačenost okusa (pica chlorotica) – neodoljiva želja
jesti nešto neobično i nejestivo (kreda, pasta za zube)
prah, ugljen, glina, pijesak, led), kao i sirovo tijesto, mljeveno meso, žitarice; ovaj
simptom je češći u djece i adolescenata, ali prilično često u
odrasle žene; ovisnost o začinjenoj, slanoj, kiseloj, začinjenoj hrani;
Perverzija osjeta mirisa – ovisnost o mirisima koja
većina ljudi ih doživljava kao neugodne (benzin,
kerozin, aceton, miris lakova, boja, kreme za cipele, naftalina itd.);
teška mišićna slabost i umor, atrofija mišića i
smanjena snaga mišića zbog nedostatka mioglobina i enzima
disanje tkiva;
distrofične promjene na koži i njezinim dodacima (suhoća,
ljuštenje, sklonost brzom stvaranju pukotina na koži;
tupost, lomljivost, gubitak, rano sijeda kosa; stanjivanje,
krhkost, poprečna ispruganost, tupost noktiju; simptom
koilonihija - udubljenje noktiju u obliku žlice);
Dizeritropoetske anemije
sideropenijski sindrom
kutni stomatitis - pukotine; glositis (u 10% pacijenata) - karakteriziraosjećaj boli i punoće u predjelu jezika, crvenilo njegovog vrha i in
daljnja atrofija papila (lakirani jezik); često viđeni
sklonost parodontnoj bolesti i karijesu;
atrofične promjene u sluznici gastrointestinalnog trakta
- očituje se suhoćom sluznice jednjaka i tegobama, te
ponekad bol pri gutanju hrane, osobito suhe hrane (sideropenična disfagija);
razvoj atrofičnog gastritisa i enteritisa.
simptom "plave bjeloočnice" (koju karakterizira plavkasta boja ili izražena
plava bjeloočnica. To je zbog kršenja sinteze kolagena u bjeloočnici, tj
stanji se i sjaji žilnica oči.
imperativni nagon za mokrenjem, nemogućnost zadržavanja urina kada
smijanje, kašljanje, kihanje, možda čak i mokrenje u krevet, što je zbog
slabost sfinktera mokraćnog mjehura;
sideropenično subfebrilno stanje - karakterizirano produljenim povećanjem
temperatura do subfebrilnih vrijednosti,
izražena sklonost akutnim respiratornim virusnim i
drugi infektivni i upalni procesi, kronične infekcije, koje
zbog kršenja fagocitne funkcije leukocita i slabljenja
imunološki sustavi;
smanjenje reparativnih procesa u koži, sluznicama.
Dizeritropoetske anemije
KOILONYCHIA
Dizeritropoetske anemije Dizeritropoetske anemije N.B.Sideroblasti su
eritrociti koštane srži
mozak koji sadrži željezo
(normalno 20-40%)
Dizeritropoetske anemije Osnovni kriteriji za IDA
nizak indeks boje
hipokromija eritrocita
mikrocitoza
smanjeno željezo u serumu
povećanje ukupnog vezanja željeza
sposobnosti seruma
smanjenje serumskog feritina
Dizeritropoetske anemije
Dijagnostički znakovi nedostatka željeza i anemije uzrokovane nedostatkom željeza
fazedeficit
žlijezda
feritin
serum
Željezo
serum
prelatentan
(skriven)
smanjenje
Latentan
(skriven)
smanjenje
smanjenje
smanjenje
smanjenje
Hemoglobin
Eksplicitan
smanjenje
Stanja nedostatka željeza
Dizeritropoetske anemijeLIJEČENJE IDA
Uklonite uzroke koji uzrokujurazvoj anemije
Uvođenje pripravaka željeza
dijetoterapija
Dijeta nije
nije
vodi
vodeći faktor
čimbenik oporavka
oporavak
Dijeta
ravnoteža željeza
željezo na
tijekom liječenja
izliječiti anemiju!
anemija!
ravnoteža
Izvori prehrambenog željeza
Izvori prehraneprehrambeno željezo
žlijezda
Izvori
Sir
1% kruha
Voće
5%
8%
58%
meso
10%
18%
Povrće
pomfrit
Dizeritropoetske anemije Kriteriji za učinkovito
učinkovita terapija
IDA terapija
IDA
Kriteriji
5-7 dan: retikulocitna kriza
od 3 - 4 tjedna: normalizacija Hb, Ht,
eritrocita
od 10 tjedana:
normalizacija
feritin (Fedepo)
Dizeritropoetske anemije Razlozi za neučinkovitost
neučinkovito
Uzroci
liječenje anemije
anemija
liječenje
nedovoljna doza željeza
malapsorpcija željeza u gastrointestinalnom traktu
odbijanje dodataka željeza zbog
nuspojave
preuranjen
poništiti pri dostizanju
normalna razina Hb
Diseritropoetski ane Trajanje terapije
terapija nedostatka željeza
nedostatak željeza
Trajanje
anemija (SZO,
(WHO, 2001.)
2001)
anemija
Nadopunjavanje deficita
željezo, uključujući
nadopunjavanje depoa željeza,
treba trajati do 6
mjeseca
upozoriti
recidiv
Anemija uzrokovana nedostatkom željeza. Procjena, prevencija i kontrola, WHO, 2001
Dizeritropoetske anemije Preuranjen
odvikavanje od droga
željezo je glavno
uzrok recidiva
anemija
Diseritropoetski ane
POTREBA ZA ISPRAVKOM
ISPRAVCINUŽNOST
djeca, tinejdžeri
sportaši
trudna, dojilja
starije osobe
žene reproduktivne dobi
obilne menstruacije
Dizeritropoetske anemije Etiopatogeneza
B i nedostatak folata
anemija
12
Dizeritropoetske anemije
Povijesna referenca
Godine 1855 engleski doktor Thomas Addison, a zatim 1872godine detaljnije njemački liječnik Opisao je Anton Birmer
bolest koja se naziva zloćudna (perniciozna)
anemija. Ubrzo je francuski liječnik Armand Trousseau predložio
ovu bolest nazvati Addisonovom anemijom i anemijom
Addison-Birman.
Godine 1926. izvijestili su J. Whipple, J. Minot i W. Murphy
Što perniciozna anemija liječiti dijetetski
prehrana sirovom jetrom i što je u osnovi bolesti
urođena nesposobnost želuca da luči supstancu,
neophodan za apsorpciju vitamina B12 u crijevima. Iza
Ovo im je otkriće donijelo Nobelovu nagradu 1934.
Dizeritropoetske anemije Anemija povezana s
Sinteza DNA i RNA
N.B.
Vitamin B i folna kiselina
sudjelovati u glavnim fazama
metabolizam purina i pirimidina
baze tijekom sinteze DNA i RNA.
Tijelo sadrži 4 mg zalihe
vitamin B12, koji je dovoljan za 4
godine.
12
Dizeritropoetske anemije
Metabolizam B12 u tijelu
U 12metilkobalamin
sinteza DNA
dijeljenje stanica
adenozinkobalamin
- regulira sintezu masnih kiselina
kiseline
- sudjeluje u edukaciji
sukcinatna kiselina iz
metilmalonska kiselina
Dizeritropoetske anemije
Metabolizam vitamina B12 (cijanokobalamin)
Metabolizam vitamina B (cijanokobalamin)12
Unos B12 hranom (dnevna potreba za njim je 1 mcg) +
unutarnji faktor Zamak u želucu (gastromukoprotein)
Apsorbira se u ileumu
Metilkobalamin
Folna kiselina
Tetrahidrofolna kiselina
sinteza DNA
Normalna hematopoeza
portalna vena
Jetra (depo B1212)
U krvi B12 + transkobalamin-2
5-deoksiadenozilkobalamin
Metilmalonska kiselina (toksična)
+ propionska kiselina
jantarna kiselina
Metabolizam masnih kiselina
B12 - anemija uzrokovana nedostatkom folata
- patološko stanjekarakterizira smanjenje
količina hemoglobina i eritrocita u
jedinica volumena krvi
zbog zamjene normoblastičnih
tip hematopoeze
megaloblastični tip zbog
poremećaji sinteze nukleinskih kiselina
u stanjima nedostatka vitamina B12 i/ili
folna kiselina.
Dizeritropoetske anemije
Etiologija B12 deficijentne anemije
deficitvanjski čimbenik Castle
– vit.B12 s hranom
deficit
unutarnji faktor
Castle - gastromukoprotein sintetiziran parijetalnim
želučane stanice, štiti vit. U 12
od uništenja
Dizeritropoetske anemije
Uzroci nedostatka vitamina B12
Uzroci nedostatka vitamina B1.
2.
3.
12
Nedovoljan sadržaj B12 u hrani (vanjski faktor Castle).
Malapsorpcija:
a)
kršenje sinteze gastromukoproteina (unutarnji faktor Castle):
atrofični gastritis dna želuca;
autoimune reakcije s proizvodnjom protutijela na parijetalne stanice
želuca i gastromukoproteina;
gastrektomija (nakon resekcije želuca, poluživot B12 je 1 godina;
nakon gastrektomije znakovi nedostatka B12 javljaju se nakon 4-5 godina);
rak želuca;
kongenitalni nedostatak gastromukoproteina;
b)
malapsorpcija B12 u tankom crijevu;
bolesti tanko crijevo povezana sa sindromom
malapsorpcija (kronični enteritis, celijakija (glutenska enteropatija),
SPRU (tropski proljev), Crohnova bolest)
resekcija ileuma;
rak tankog crijeva;
kongenitalna odsutnost receptora za kompleks vitamina B12 +
gastromukoprotein u tankom crijevu;
c)
natjecateljski unos vitamina B12;
invazija širokom trakavicom;
izražena crijevna disbakterioza.
Smanjena proizvodnja transkobalamina-2 u jetri i poremećen transport
vitamin B12 u koštanoj srži (s cirozom jetre).
Dizeritropoetske anemije
PATOGENEZA MBA
Glavne patogenetske karike u nastanku B12-deficijentne anemije
Kršenje sinteze DNA u hematopoetskim stanicama,uglavnom eritroblasti
Kršenje stanične diobe
Embrionalni tip hematopoeze (megaloblastični)
Megaloblasti rijetko sazrijevaju u megalocite zbog njihove hemolize
koštane srži i ne osiguravaju hematopoetsku funkciju (povećavaju
sadržaj nekonjugiranog bilirubina, urobilina, sterkobilina, m.b.
povišeno željezo u serumu s hemosiderozom unutarnjih organa)
Jezgra stanice sporo sazrijeva, u protoplazmi je povećan sadržaj
Hb - hiperkromija (Jollyjeva tijela, Cabot prstenovi), hipersermentonukleus
neutrofili
Dizeritropoetske anemije
Glavni klinički sindromi B12 deficijentne anemije
Hematološki sindrom(manifestira se pancitopenijom → hipoksijom,
krvarenje, imunodeficijencija)
Gastroenterološki
sindrom (manifestira se atrofičnim
glositis, gastritis, enteritis → kršenje
funkcije gastrointestinalnog trakta
neurološki sindrom
(manifestira se funikularnom mijelozom → klimav
hod, senzorni poremećaj
Dizeritropoetske anemije
Hematološki sindrom
poremećena proliferacija i sazrijevanje FEC-a
prijelaz iz normoblastičnog u
megaloblastični tip hematopoeze
stvaranje FEC s niskim otporom,
kratak životni vijek
anemija, leukopenija, trombocitopenija
Dizeritropoetske anemije Dizeritropoetske anemije Dizeritropoetske anemije
Patogenetska potkrijepljenost glavnih kliničkih sindroma B12 - anemije nedostatka
Gastroenterološki sindromporemećaj diobe i sazrijevanja stanica u sluznici
gastrointestinalni trakt
atrofija gastrointestinalne sluznice
upala različitih dijelova gastrointestinalnog trakta (glositis,
stomatitis, enterokolitis itd.) - disfunkcije
Dizeritropoetske anemije
Patogenetska potkrijepljenost glavnih kliničkih sindroma B12-deficijentne anemije
neurološki sindromporemećena sinteza masnih kiselina
nakupljanje metilmalonske kiseline
toksični učinak na mijelin
funikularna mijeloza (degeneracija stražnjeg i
bočni stupovi leđne moždine)
Dizeritropoetske anemije
Glavni diferencijalni kriteriji za anemiju nedostatka B12
Hematološki sindrom:hiperkromna anemija (CP iznad 1,1-1,3);
anizocitoza (megalocitoza), poikilocitoza,
bazofilna zrnatost, Cabotovi prstenovi, tjelešca
Jolly;
trostruka citopenija;
hipersegmentalna neutrofilija;
megaloblastični tip hematopoeze
podaci sternalne punkcije);
smanjenje B12 u krvi je manje od 200 pg / ml;
Dizeritropoetske anemije Dizeritropoetske anemije
Koštana srž kod anemije nedostatka B12
Dominiraoeritromegaloblasti sa
kašnjenje sazrijevanja
jezgre.
U pripremi, div
ubosti i
polisegmentarni
neutrofili.
Dizeritropoetske anemije Dizeritropoetske anemije
Periferna krvna slika kod B12 deficijentne anemije
Slika periferne krviB-deficijentna anemija
12
Dizeritropoetske anemije anemija uzrokovana nedostatkom folata
Rjeđi od nedostatka B12
Zaliha FC u tijelu je dizajnirana za 2-3 mjeseca.
FC se nalazi u svim proizvodima; kada se zagrije, on
propada
Apsorbira se u cijelom jejunumu, m.b. proljev
Transportni proteini nisu potrebni za apsorpciju FA.
Kongenitalni defekti FC kombiniraju se s mentalnim
zaostalost i ne ispravljaju se uvođenjem FC
Dizeritropoetske anemije
Uzroci anemije uzrokovane nedostatkom folata
pothranjenost (čestouzrok kod starijih osoba)
enteritis s malapsorpcijom;
uzimanje određenih lijekova koji deprimiraju
sinteza folne kiseline (metotreksat,
triamteren, antikonvulzivi,
barbiturati, metformin);
kronično trovanje alkoholom;
povećana potreba za folnom kiselinom
(maligni tumori, hemoliza,
eksfolijativni dermatitis, trudnoća).
Dizeritropoetske anemije
anemija uzrokovana nedostatkom folata
anemijaNedostatak folne kiseline
Profilaksa folne kiseline
smanjuje rizik kongenitalna patologija do 70%
SZO preporučuje obaveznu upotrebu
folna kiselina u trudnoći!!!
Dizeritropoetske anemije
Glavni diferencijalni kriteriji za anemiju nedostatka folata
Podaci o povijesti:trudnoća,
neonatalno razdoblje,
kronični alkoholizam,
kronična hemoliza,
mijeloproliferativne bolesti,
lijekovi (antagonisti folne kiseline,
antituberkulozi, antikonvulzivi).
Eritropoeza pati.
Nema funikularne mijeloze, lezija želuca.
Nema retikulocitne krize na B12.
U koštanoj srži samo su megaloblasti obojeni bojom.
s anemijom uzrokovanom nedostatkom B12 i anemijom uzrokovanom nedostatkom folne kiseline -
Ne.
Smanjenje folne kiseline u krvi je manje od 3 mg / ml (N - 3-25
mg\ml).
Dizeritropoetske anemije
Liječenje megaloblastične anemije
Vitamin B12 (cijanokobalamin) - IM 400-500 mcg (4-6 tjedana).Za neurološke poremećaje: B12 (1000 mcg) + kobalamid
(500 mcg) do nestanka neuroloških simptoma.
Po potrebi - doživotna primjena B12 (500 mcg) 1 put u 2
tjedana ili profilaktički tretman - B12 (400 mcg) 10-15 dana 1-2 puta godišnje.
samo transfuzija eritromase vitalne indikacije(na
sve anemije!):
Hb< 50 г/л,
Hb< 70 г/л с нарушением гемодинамики,
razvoj prekoma i kome, hitna priprema za operaciju i
itd.
Dehelmintizacija - uklanjanje široke trakavice (phenosal,
muška paprat).
Folna kiselina 5-15 mg/dan (do 30 mg/dan); preventivno
doza - 1-5 mg / dan.
Dizeritropoetske anemije
Kriteriji učinkovitosti liječenja
subjektivno poboljšanjeprvi dani liječenja;
retikulocitna kriza na 5-7
dan liječenja (za B deficijencnu anemiju);
12
poboljšanje krvne slike
drugi tjedan liječenja
normalizacija nakon 3-4 tjedna.
Dizeritropoetske anemije Etiopatogeneza
aplastičan
anemija
Dizeritropoetske anemije
aplastična anemija
APLASTIČNA ANEMIJA – hematološkasindrom zbog veliki broj endogeni i
egzogeni faktori, kvalitativni i
kvantitativne promjene u matičnoj stanici i njezinoj
mikrookruženje, kardinalni morfološki
koji je karakteriziran pancitopenijom
periferne krvi i masne degeneracije
koštana srž.
P. Ehrlich (1888) prvi je opisao AA.
Pojam "aplastična anemija" uveden je 1904. godine.
Chauffard.
Incidencija 4-5 ljudi na 1 milijun stanovnika godišnje (u
Europa)
Dobni vrhovi incidencije 20 i 65 godina
Dizeritropoetske anemije
aplastična anemija
Dizeritropoetske anemije Etiološki čimbenici AAlijekovi,
kemijske tvari,
virusi,
autoimuni procesi;
u 50% slučajeva etiologija je nepoznata (idiopatska AA).
Patogeneza AA
oštećenje pluripotentnih krvnih matičnih stanica
supresija hematopoeze
djelovanje imunološkog (staničnog, humoralnog)
mehanizmima
nedostatak čimbenika koji stimuliraju hematopoezu
željezo, B12, protoporfirin ne može biti
koristi hematopoetsko tkivo.
Dizeritropoetske anemije Aplastična anemija može biti
1.
Kongenitalna (sa sindromom kongenitalne anomalije ili bez)
2.
Stečena
AA je izoliran nizvodno
3.
akutan
4.
Subakutno
5.
Kronično
AA oblici
6.
imun
7.
Neimuni
Klinički sindromi AA
8.
Cirkulatorno-hipoksična
9.
Septičko-nekrotična
10.
Hemoragični
Dizeritropoetske anemije
aplastična anemija
Dizeritropoetske anemijeaplazija koštane srži
NAČELA, CILJEVI I METODE LIJEČENJAdizeritropoetska anemija
PRINCIPI
CILJEVI
ETIOTROPNI
Eliminirati
smanjenje
stupanj
kršenja
podjela i
diferencijacija
eritrokariocito
V
METODE
* Raskid
akcije
čimbenici
vodeći
do hipoplazije
kost
mozak
* Uvod
"oskudno"
faktori – uzroci
anemija
(vitamini B12,
B6, folna kiselina
kiselina,
PATOGENETSKE
SIMPTOMATSKI
Eliminirati
smanjenje
stupanj
hipoksija
spriječiti,
smanjenje
stupanj
hemosideroza
ispraviti
KShchR
Eliminirati
smanjenje
stupanj
posljedice
hipoksija
Eliminirati
neugodan
Osjetiti
* Upotreba
* Ispravak funkcije
kardio-vaskularni
sustavi, bubrezi,
jetra,...
antihipoksanti,
antioksidansi
* Uvod
pufer
rješenja
Dizeritropoetske anemije
Diferencijalna dijagnoza anemije
Dizeritropoetske anemijeDiferencijalna dijagnoza anemije
znakoviIDA
CAA
GA
MBA
AA
CPU
<1
<1
N (talasemija
< 1)
>1
N
Retikulociti
N ili ↓
N ili ↓
N ili ↓
↓↓
Siv. Fe
↓
N ili
N ili
N ili
trombociti
N
N
N ili ↓
↓
↓↓↓
Leukociti
N
N
N
↓
↓↓↓
Slezena
N
N
često
m/b
N
Jetra
N
često
često
često
N
Koštana srž
umjereno
hiperplazija
eritrocitna klica,
sideroblasti
↓↓.
umjereno
hiperplazija
eritrocitna klica,
sideroblasti
izražena
hiperplazija
eritrocitna loza.
megaloblas
tip
hematopoetski
nia
ugnjetavanje
Dizeritropoetske anemije Hvala na pažnji!
Posthemoragijska anemija. hemolitička anemija. anemija (anemija)- smanjenje ukupne razine hemoglobina (Hb), što se češće očituje u njegovom smanjenju u jedinici volumena krvi; kod djece mlađe od 6 godina ispod je 110 g / l, kod odraslih žena ispod 120 g / l, kod muškaraca - ispod 130 g / l. Prava anemija se od pseudoanemije razlikuje po vrijednosti hematokrita (u odraslih je 36-48%).
◊ U većini slučajeva, s izuzetkom anemije uzrokovane nedostatkom željeza i talasemije, anemija je također popraćena smanjenjem sadržaja crvenih krvnih stanica (ispod 3,9 10 12 /l).
Klasifikacija anemije provodi se na temelju nekoliko načela.
A. Indeksom boja.
1. Normokromni - 0,85-1,05
2. Hiperkromni - iznad 1,05, ali ne više od 1,60.
3. Hipokromni - ispod 0,85.
B. Prema prosječnom promjeru eritrocita.
1. Normocytic - 7-8 mikrona
2. Mikrocitni - manji od 6,5 mikrona
3. Makrocitni - 8-12 mikrona.
4. Megalocitni - više od 12 mikrona.
B. Sposobnošću regeneracije koštane srži (sadržajem retikulocita).
1. Regenerativni - 1-5%.
2. Hiporegenerator 0,5-1%.
3. Regenerator - manje od 0,5%.
4. Hiperregenerativno - više od 5%.
G. Prema tipu hematopoeze.
1. Normoblastični.
2. Megaloblastični.
D. Prema etiopatogenetskom principu.
1. Anemija zbog gubitka krvi (posthemoragijska):
a) akutni;
b) kronični.
2. Anemija zbog poremećenog stvaranja krvi:
a) deficijentna anemija (nedostatak vitamina, nedostatak željeza)
nye, nedostatak proteina);
b) hipo- i aplastični;
c) metaplastični;
d) disregulacijski.
3. Anemija zbog pojačanog razaranja krvi (hemolitička):
a) nasljedni;
b) kupljeno.
AKUTNA POSTHEMOROGIJSKA ANEMIJA
Stanje povezano s brzim gubitkom značajnog volumena krvi (20-25% krvi tijekom otprilike 1 sata). Čimbenik koji određuje stupanj disfunkcije i kompenzacije je nekorigirana hipovolemija.STADIJI NADOKNADE AKUTNOG GUBITKA KRVI
Refleksna faza kompenzacije. Javlja se 1. dan nakon akutnog gubitka krvi zbog aktivacije simpatoadrenalnog sustava: povećava se periferni vaskularni otpor, dolazi do redistribucije krvi (centralizacija cirkulacije krvi). Međutim, smanjuje se arterijski tlak, vraćanje krvi u srce, a time i minutni volumen srca.Hidramička faza kompenzacije. Javlja se 2-4 dana i sastoji se u premještanju tekućine iz izvanstaničnog prostora u krvne žile. Jedan od mehanizama hidremičke faze je kateholaminom izazvana hiperglikemija zbog glikogenolize u jetri; sadržaj osnovnih elektrolita u plazmi ostaje praktički nepromijenjen.
Faza kompenzacije koštane srži. U ovoj fazi (5-7 dana nakon akutnog gubitka krvi) važna je aktivacija stvaranja eritropoetina u bubrezima u pozadini teške hipoksije.
U prvo vrijeme nakon gubitka krvi, zbog smanjenja volumena vaskularnog korita, smanjenje sadržaja hemo-
globina i eritrocita, hematokrit se također ne mijenja.
U vezi s hidremijom počinje postupni pad razine hemoglobina i eritrocita - formira se normokromna anemija, koja kasnije postaje hipokromna zbog nedostatka željeza.
KRONIČNA POSTHEMOROGIJSKA ANEMIJA
Anemija koja se razvija kao rezultat opetovanog gubitka malih količina krvi tijekom krvarenja iz probavnog trakta, s bubrežnim, materničnim, nazalnim i hemoroidnim krvarenjem.Perifernu krv karakterizira smanjenje indeksa boje na 0,4-0,6, mikrocitoza, umjerena leukocitoza s neutrofilnim pomakom ulijevo. S dugim tijekom bolesti, anemija dobiva hiporegenerativni karakter.
ANEMIJA POVEZANA S POREMEĆANIM STVARANJEM KRVI
1. Disregulacijski- zbog kršenja regulacije hematopoeze sa smanjenjem proizvodnje eritropoetina ili povećanjem broja njihovih inhibitora (kronična bolest bubrega, hipofiza, nadbubrežne žlijezde, štitnjača).2. Oskudno- nastaje pri nedostatku tvari potrebnih za eritropoezu (željezo, vitamini, bjelančevine).
Anemija uzrokovana nedostatkom željezačini do 80% svih anemija i nastaje kao posljedica neravnoteže između unosa željeza u organizam, njegove upotrebe i gubitaka.
Gubici željeza opaženi su kod ponovljenih i dugotrajnih krvarenja - maternice, gastrointestinalnog, bubrežnog, plućnog, s hemoragijskom dijatezom.
U nekim slučajevima moguć je nedostatak željeza u prehrani (manje od 2 mg dnevno), na primjer, s malim unosom mesne hrane, s umjetnim hranjenjem ili s kasnim hranjenjem u djetinjstvu.
Smanjena apsorpcija željeza primjećuje se kod hipoacidnog gastritisa, kroničnog enteritisa ili kod resekcije gastrointestinalnog trakta.
Kršenje transporta željeza moguće je s nasljednom ili stečenom hipotransferinemijom.
Povećana potrošnja željeza javlja se tijekom razdoblja rasta i sazrijevanja, tijekom trudnoće i dojenja te kod kroničnih upalnih bolesti.
Nedostatak željeza prati povećanje neučinkovite eritropoeze, smanjenje životnog vijeka eritrocita.
Krvnu sliku karakterizira smanjenje sadržaja hemoglobina (od 100 do 20 g / l), sadržaj crvenih krvnih stanica može biti normalan ili značajno smanjen, otkrivena je hipokromija. Također je tipična sklonost mikrocitozi, poikilocitozi, regenerativna ili hiporegenerativna priroda anemije.
U perifernoj krvi nalaze se: razina serumskog željeza ispod 30 µg/l; ukupni kapacitet vezanja željeza krvnog seruma iznad 64,4 µmol/l; sadržaj feritina u krvi je ispod 40 mcg / l.
Nedostatak željeza u serumu očituje se povećanim umorom, perverzijom okusa i mirisa, općom slabošću, glavoboljama. Nedostatak željeza također dovodi do smanjenja razine mioglobina i aktivnosti enzima tkivnog disanja. Posljedica hipoksije su distrofični procesi u organima i tkivima. Često raslojavanje i lomljivost noktiju, stomatitis, karijes, atrofični gastritis itd.
ANEMIJA ZBOG NEDOSTATKA VITAMINA B12 (PERNICIOZNA)
Nedostatak vitamina B 12 može se razviti zbog kršenja njegovog unosa, apsorpcije, transporta, skladištenja i asimilacije na razini koštane srži.Malapsorpcija je vjerojatna u odsutnosti unutarnjeg čimbenika Castle (transcorrin), s atrofičnim procesima na dijelu želučane sluznice, s nasljednim selektivnim poremećajem proizvodnje vitamina, s autoimunim uništenjem, s agastričnim oblikom nedostatka.
Apsorpcija vitamina B12 oštro je ograničena s raširenom lezijom tankog crijeva - s enteritisom, celijakijom, a također i s njegovom resekcijom.
Patogenetska uloga kompetitivne potrošnje vitamina tijekom invazije širokom trakavicom, kao i kod sindroma "cekuma" (kod primjene anastomoze ostaju dijelovi tankog crijeva kroz koje hrana ne prolazi), kao i kod multiple divertikuloze tankog crijeva.
U nekim slučajevima nedostatak transkobalamina dovodi do nedostatka vitamina B 12.
Nedostatak vitamina B 12 uzrokuje kršenje stvaranja DNA i dalje poremećaj u diobi hematopoetskih stanica, tj. usporavanje mitotičkog procesa i smanjenje broja mitoza. U takvim uvjetima nastaje megaloblastični tip hematopoeze sličan embrionalnom tipu. Razvoj anemije povezan je sa sljedećim mehanizmima.
1. Smanjena mitotička aktivnost.
2. Neučinkovita eritropoeza zbog intramedularne destrukcije megaloblasta.
3. Ekstravaskularna hemoliza u slezeni zbog povećanih megalocita.
4. Intravaskularna hemoliza zbog smanjenja osmotske rezistencije membrane megalocita.
U perifernoj krvi otkriva se oštra anemija, uglavnom hiperkromna (indeks boje - 1,3-1,5), hiporegenerativna. Tipična je prisutnost nuklearnih ostataka, anizocitoza, poikilocitoza. Također su zabilježene neutropenija i trombocitopenija.
Folatnodeficijentna anemija po mehanizmu razvoja i krvnoj slici bliska je nedostatku vitamina B 12.
ANEMIJA POVEZANA S POREMEĆANOM SINTEZOM ILI KORIŠTENJEM PORFIRINA
Uzrokovana nasljednim ili stečenim nedostatkom enzima koji sudjeluju u sintezi porfirina ili hema, takva je anemija obično hipokromna, s visokim sadržajem željeza u tijelu, a često je karakterizirana hemosiderozom organa.Opisan je nasljedni nedostatak koproporfirinogen dekarboksilaze koja sintetizira protoporfirin. Očigledno, češće je bolest povezana s kršenjem sinteze aminolevulinske kiseline. Zbog poremećaja u sintezi protoporfirina, vezanje željeza postaje nemoguće - razvija se sideroahrestična anemija.
Stečena anemija ove vrste često se javlja kod trovanja olovom. Olovo blokira sulfhidrilne skupine u aktivnim mjestima dvaju enzima uključenih u sintezu hema: dehidraze aminolevulinske kiseline i hemsintetaze. Kao rezultat-
one u mokraći nakupljaju aminolevulinsku kiselinu, a u eritro-
cytach – protoporfirin.
Također je otkriveno smanjenje stope biosinteze globina (-lanac), povećana hemoliza. Olovo još uvijek može oslabiti aktivnost ionskih pumpi membrane eritrocita, što smanjuje razinu iona kalija i životni vijek stanica.
HIPO I APLASTIČNA ANEMIJA
Ove anemije su skup sindroma u kojima se, uz pancitopeniju, otkriva ugnjetavanje hematopoeze u koštanoj srži.Prema etiologiji aplastična anemija se dijeli na:
1. Pravi (idiopatski), ustavni i nasljedni, uzrokovan kršenjem reaktivnosti tijela ili endokrinom insuficijencijom.
2. Aplastična anemija povezana s djelovanjem štetnih čimbenika: zračenje, toksični čimbenici (benzen, živa), citotoksični (kloretilamin, ThioTEF, kolhicin, 6-merkaptopurin itd.), lijekovi (amidopirin, barbiturati, sulfonamidi, klorpromazin), infektivni (virusni hepatitis A, B, generalizirani oblici tuberkuloze, trbušni tifus, salmoneloza, septička stanja).
U patogenezi su važni sljedeći mehanizmi:
1. Smanjenje broja matičnih stanica ili njihovih defekata.
2. Kršenje mikrookruženja, što dovodi do promjene u matičnim stanicama.
3. Imunološki učinci koji uzrokuju poremećaje u radu matičnih stanica. Krvnu sliku karakterizira izražena, često normokromna, makrocitna, hiporegenerativna anemija. Primjećuju se značajna granulocitopenija i trombocitopenija. Smanjuje se broj mijelokariocita u koštanoj srži. Klinička slika ovisi o stupnju kršenja pojedinih hematopoetskih klica i njihovih kombinacija; uključuje anemični, trombocitopenijski i granulocitopenijski sindrom.
HEMOLITIČKA ANEMIJA
Ova skupina uključuje različite anemije povezane ili s nasljednim povećanim razaranjem crvenih krvnih stanica ili s djelovanjem hemolitičkih čimbenika egzogenog podrijetla.NASLJEDNA HEMOLITIČKA ANEMIJA
1. Anemija povezana s kršenjem membrane eritrocita (membranopatija). Nasljedna mikrosferocitoza (Minkowski-Choffardova bolest) - autosomno dominantan tip nasljeđivanja, karakteriziran povećanjem propusnosti membrane eritrocita i prekomjernim unosom natrijevih iona u stanicu. Postoji oticanje eritrocita, kršenje sposobnosti deformacije i smanjenje njihovog životnog vijeka, uništavanje slezene makrofagima.Kod mikrosferocitoze otkrivena je odsutnost ili kršenje vezanja proteina spektrin membrane na protein 4.1. Pretpostavlja se da je poremećeno stvaranje tetramernog oblika spektrina iz dimernog oblika, kao i nepostojanje proteina membrane eritrocita, označenih s 4.2.
Obično je anemija normokromna, regenerativna. Prema krvnoj slici, razlikuje se u različitim stupnjevima težine, tijekom hemolitičke krize je oštrija, ali se istodobno razvija visoka retikulocitoza.
Membranopatije također uključuju eliptocitozu (ovalocitozu), stomatocitozu (eritrociti u obliku usta).
Akantocitoza je uzrokovana kršenjem lipidne strukture membrane eritrocita.
2. Anemija povezana s poremećenom aktivnošću enzima eritrocita (enzimopatije). Nedostatak enzima uključenih u proizvodnju energije u eritrocitima može dovesti do kršenja ionskog sastava, smanjenja otpornosti na oksidirajuća sredstva i smanjenja životnog vijeka tih stanica.
Opisan je nasljedni nedostatak enzima likolize i metabolizma ATP (heksokinaza, heksofosfat izomeraza, fosfofruktokinaza, piruvat kinaza, ATPaza).
Nedostatak enzima pentozofosfatnog ciklusa (glukoza-6-fosfat dehidrogenaza) dovodi do nedostatka NADP H2 koji je neophodan za redukciju glutationa, faktora otpornog na djelovanje oksidansa. To se događa s nedostatkom enzima za sintezu glutationa - glutation sintetaze, glutation reduktaze, glutation peroksidaze.
U takvim slučajevima formira se anemija različite težine. Obično normokromna, s anizocitozom, poikilocitozom, polikromazijom. Sadržaj retikulocita je povećan, osobito tijekom egzacerbacija.
3. Anemija povezana s kršenjem strukture i sinteze hemoglobina (hemoglobinopatije). talasemija- skupina nasljednih bolesti povezanih s kršenjem sinteze jednog od lanaca hemoglobina (¸ ¸ ¸), što dovodi do kršenja njihove ravnoteže. U tom slučaju, prekomjerno formirani lanac se nakuplja i taloži u eritrokariocitima.
Talasemija je određena delecijom strukturnih gena odgovornih za sintezu odgovarajućeg lanca. Sintezu α-lanca kodiraju dva para gena koji se nalaze na 11. kromosomu tog para. Nedostatak α-lanca u embriju dovodi do intrauterine smrti.
Delecija u 1 od 4 gena koji kodiraju sintezu lanca uzrokuje blagi nedostatak, delecija u 2 gena je izraženija. Ako nedostaju 3 gena, tada se razvija hemoglobinopatija H. Hemoglobin H sastoji se od 4 lanca, nestabilan je, lako agregira i slezena ga lako uklanja iz cirkulacije.
Talasemije su karakterizirane blagom hipokromnom anemijom s ciljanjem eritrocita i bazofilnom interpunkcijom, umjerenom retikulocitozom.
Patogeneza talasemije je složenija. Gen koji kodira sintezu -lanca nalazi se na 16. kromosomu para, pored njega su geni odgovorni za sintezu - i -lanaca.
Dio -talasemije nastaje zbog kršenja spajanja (tj. promjena koje mRNA prolazi na putu od jezgre, gdje se sintetizira, do citoplazme). Potonje može dovesti do destabilizacije strukture. Zbog poremećaja sinteze α-lanca javlja se mnogo slobodnih β-lanca, što uzrokuje neučinkovitost eritropoeze uz pojačano razaranje eritrokariocita u koštanoj srži.
Anemija povezana s kršenjem strukture globinskih lanaca. Uzrokovane su zamjenom jedne ili više aminokiselina u globinskom lancu, nepostojanjem segmenta lanca ili njegovim produljenjem.
Najčešća anomalija u građi hemoglobina je hemoglobinopatija S. U slučaju homozigotnog nositeljstva govore o anemiji srpastih stanica, a kod heterozigotnosti o anomaliji srpastih stanica. Polumjesec je rezultat smanjene topljivosti hemoglobina, koji je napustio kisik i stvorio gel.
Mikroskopski pregled otkriva kristale od 1,5 µm. Pretpostavlja se da zamjena glutaminske kiseline valinom na 6. poziciji dovodi do povećanja veze jedne molekule globina s drugom.
Krvnu sliku karakterizira umjereno smanjenje razine hemoglobina i eritrocita, indeks boje je blizu jedan. Obojeni razmaz pokazuje bazofilnu interpunkciju, ciljanje, a ponekad i srpaste eritrocite. Srp je izraženiji u uzorku s natrijevim metabisulfitom ili nakon nanošenja steza na bazu prsta. Značajno je povećan sadržaj retikulocita.
STEČENA HEMOLITIČKA ANEMIJA
IMUNOSKE HEMOLITIČKE ANEMIJE
Heterogena skupina bolesti, ujedinjeni sudjelovanjem protutijela ili imunoloških limfocita u oštećenju i smrti eritrocita ili eritrokariocita.Izo- ili aloimuna anemija može se razviti s hemolitičkom bolešću novorođenčadi ili s transfuzijom krvi, ne-
kompatibilni prema sustavu AB0, Rhesus ili drugom sustavu na koji pacijent ima antitijela.
Transimune anemije nastaju kada antitijela majke s autoimunom hemolitičkom anemijom prijeđu placentu i uzrokuju hemolitičku anemiju u fetusa.
Heteroimuna anemija (haptenična) povezana s pojavom novih antigena na površini eritrocita (na primjer, kao rezultat fiksacije lijekova na eritrocitima - penicilin, sulfonamidi). Ponekad virus, također fiksiran na površini eritrocita, postaje hapten.
Autoimune hemolitičke anemije- skupina bolesti uzrokovanih stvaranjem protutijela protiv vlastitih antigena eritrocita ili eritrokariocita.
Osim idiopatskih, postoje i simptomatske autoimune anemije; kod njih se hemoliza razvija u pozadini drugih bolesti (maligni tumori različite lokalizacije i hemoblastoze, sistemski eritematozni lupus, reumatoidni artritis, stanja imunodeficijencije).
Najvjerojatnija patogenetska osnova autoimune hemolitičke anemije je slom imunološke tolerancije.
U krvnoj slici primjećuje se blaga anemija, češće normokromna, s povećanim sadržajem retikulocita. U hemolitičkim krizama krvna slika je u većoj mjeri poremećena, moguće su retikulocitne krize s povećanjem sadržaja retikulocita do 80-90%.
Hipoplastična anemija je bolest krvnog sustava koju karakterizira inhibicija hematopoetske funkcije koštane srži, a očituje se nedovoljnim stvaranjem eritrocita, leukocita i trombocita (panhemocitopenija) ili samo eritrocita (parcijalna hipoplastična anemija, eritroblastoftiza). Temelj patološkog procesa je kršenje proliferacije i diferencijacije stanica koštane srži. Karakteristična značajka ove bolesti krvnog sustava je potpuna iscrpljenost (aplazija) koštane srži i duboko kršenje njezine funkcije, što je popraćeno teškom anemijom, leukopenijom i trombocitopenijom. Nedovoljna proizvodnja stanica u koštanoj srži određuje glavne mehanizme razvoja bolesti - anemični sindrom, infektivne komplikacije zbog granulocitopenije i hemoragični sindrom.
Glavni etiološki čimbenici hipoplastične anemije su: ionizirajuće zračenje; insekticidi; citotoksični lijekovi; drugi lijekovi; antitijela protiv stanica koštane srži; virusne infekcije (virusni hepatitis); nasljedni faktori; idiopatske hipo- i aplastične anemije.
krvna slika
U ispitivanju periferne krvi zabilježena je pancitopenija, teška anemija s niskom retikulocitozom, izražena anizopoicilocitoza. Sadržaj hemoglobina pada na 15-20 g/l. Leukopenija, trombocitopenija različitog stupnja. Naglo ubrzanje ESR - do 60--80 min / h. Proučavanje hematopoeze koštane srži kod aplastične anemije otkriva sliku gotovo potpune devastacije koštane srži.
Patogeneza
Trenutno su glavni patogenetski čimbenici aplastične anemije:
- poraz pluripotentne hematopoetske matične stanice;
- oštećenje staničnog mikrookruženja hematopoetske matične stanice i neizravno oštećenje njezine funkcije;
- imunološka depresija hematopoeze i apoptoza hematopoetskih matičnih stanica;
- skraćivanje života eritrocita;
- · kršenje metabolizma hematopoetskih stanica.
Poraz pluripotentne hematopoetske matične stanice- najvažniji patogenetski čimbenik aplastične anemije. Matična stanica je predak svih hematopoetskih stanica. S aplastičnom anemijom, sposobnost stvaranja kolonija koštane srži značajno je smanjena, proliferacija hematopoetskih stanica je poremećena, a na kraju se formira sindrom pancitopenije - leukopenija, anemija, trombocitopenija. Konačno, mehanizam inhibicije aktivnosti pluripotentnih matičnih hematopoetskih stanica nije razjašnjen.
Klinička slika
Glavni klinički i laboratorijski simptomi stečene hipo- i aplastične anemije s oštećenjem sva tri hematopoetska izdanka koštane srži posljedica su potpune inhibicije hematopoeze, kao i hipoksije organa i tkiva te hemoragijskog sindroma. Ozbiljnost simptoma ovisi o težini i tijeku anemije.
Pacijenti imaju pritužbe karakteristične za anemični sindrom. Karakteristična su krvarenja (gingivalna, nazalna, gastrointestinalna, bubrežna, krvarenja iz maternice) i česte zarazne i upalne bolesti. U akutnom obliku simptomi se razvijaju brzo i tijek bolesti je težak od samog početka. Ali kod većine pacijenata bolest se razvija prilično sporo, postupno, u određenoj mjeri, pacijenti se prilagođavaju anemiji. Bolest se obično prepoznaje po teškim simptomima.
Prilikom pregleda bolesnika pozornost privlači izraženo bljedilo kože i vidljivih sluznica, često s ikteričnom nijansom; hemoragijski osip na koži, često u obliku modrica različitih veličina. Često se na mjestu ubrizgavanja (intramuskularno, intravenski, supkutano) stvaraju opsežni hematomi. Hemoragični osip lokaliziran je uglavnom u području nogu, bedara, trbuha, ponekad na licu. Moguća su krvarenja na konjunktivi i vidljivim sluznicama – usne, sluznica usne šupljine. Može doći do ozbiljnog nazalnog, gastrointestinalnog, bubrežnog, plućnog, maternice, intracerebralnog krvarenja. Periferni limfni čvorovi nisu povećani.
Prilikom pregleda unutarnjih organa mogu se otkriti sljedeće promjene:
- Dišni sustav - česti bronhitis, upala pluća.
- · Kardiovaskularni sustav - sindrom miokardijalne distrofije.
- · Probavni sustav - s teškim hemoragičnim sindromom, erozija se može otkriti na sluznici želuca, dvanaesniku 12.
Često se hemosideroza unutarnjih organa razvija zbog povećanog uništavanja neispravnih eritrocita, smanjenja upotrebe željeza u koštanoj srži, poremećene sinteze hema i čestih transfuzija eritrocitne mase.
Laboratorijski podaci i instrumentalne studije
Opća analiza krvi- izraženo smanjenje broja crvenih krvnih stanica i hemoglobina; anemija u većine bolesnika je normokromna, normocitna; karakteriziran odsutnošću ili oštrim smanjenjem broja retikulocita (regenerativna anemija); postoji leukopenija zbog granulocitopenije s relativnom limfocitozom; karakteriziran trombocitopenijom. Stoga je najznačajnija laboratorijska manifestacija hipo- i aplastične anemije pancitopenija. ESR povećan.
Kemija krvi- sadržaj željeza u serumu je povećan, postotak zasićenja transferina željezom značajno je povećan.
Pregled sternalnog punktata (mijelogram)-- izraženo smanjenje stanica eritrocitnog i granulocitnog reda, limfocita i značajno smanjenje megakariocitne klice. U teškim slučajevima, koštana srž izgleda "opustošena", samo pojedinačne stanice mogu se naći u punktatu prsne kosti. U koštanoj srži značajno se povećava sadržaj željeza, smještenog i izvanstanično i unutarstanično.
Dijagnostički kriteriji
- Normokromna normocitna regeneratorska anemija s naglim smanjenjem ili potpunim odsustvom retikulocita, povećanjem ESR-a.
- · Leukocitopenija, apsolutna granulocitopenija, relativna limfocitoza.
- Trombocitopenija.
- · Izražen apsolutni deficit u mijelogramu stanica eritro-, leuko- i trombopoeze, kašnjenje u njihovom sazrijevanju.
- * Povećanje sadržaja željeza unutar eritrokariocita i izvanstanično.
- Naglo smanjenje broja ili potpuni nestanak hematopoetskih stanica i zamjena hematopoetske koštane srži masnim tkivom u trepanobioptatu iliuma glavna je metoda za provjeru dijagnoze hipo- i aplastične anemije).
- Povećane razine željeza u serumu.
Najčešće nedostatak željeza u organizmu uzrokuje gubitak krvi, zbog čega dolazi do nesklada između unosa željeza u organizam hranom i razine njegove iskorištenosti tijekom stvaranja crvenih krvnih zrnaca.
Konkretno, anemiju uzrokovanu nedostatkom željeza mogu uzrokovati: krvarenja iz žila oštećenih tijekom stvaranja peptičkih ulkusa želuca i dvanaesnika, menstrualni gubitak krvi. Ponekad u novorođenčadi i djece intenzitet eritropoeze prevladava nad unosom željeza, što uzrokuje anemiju bez gubitka krvi.
Anemija zbog kronične upale
Anemija se često javlja u bolesnika s dugotrajnim (više od mjesec dana) upalnim bolestima. Ozbiljnost anemije izravno je povezana s trajanjem i težinom upale. Bolesti koje najčešće dovode do anemije ovog porijekla su subakutni bakterijski endokarditis, osteomijelitis, apsces pluća, tuberkuloza i pijelonefritis.
Autoimune bolesti (reumatoidni artritis, itd.) također karakteriziraju kronične upale i anemiju.
Jedan od uzroka anemije u bolesnika sa zloćudnim novotvorinama je pridružena kronična upala.
Anemiju zbog kronične upale uzrokuju:
1. Inhibicija eritropoeze zbog njezine dugotrajne stimulacije citokinima (čimbenici stimulacije kolonija) koje stvaraju i otpuštaju aktivirani stanični efektori kronične upale.
2. Neuspjeh u kompenzaciji smanjenja životnog vijeka eritrocita.
Kod anemije zbog kronične upale, smanjenje sadržaja željeza u eritroblastima posljedica je kršenja njegove isporuke do stanica eritroidne loze koštane srži u razvoju. Nedostatak željeza dovodi do hipokromije i mikrocitoze eritrocita. Nedostatak željeza dostupnog za sintezu hemoglobina dovodi do povećanja sadržaja protoporfirina u eritrocitima. Masa željeza raspoloživa za eritropoezu, unatoč normalnom sadržaju u organizmu, smanjuje se pretjeranom sustavnom aktivacijom mononuklearnih fagocita, kao i njihovom hiperplazijom.
Kao rezultat hiperplazije i hiperaktivacije u sustavu mononuklearnih fagocita dolazi do prekomjernog hvatanja željeza od strane aktiviranih mononuklearnih stanica, koje imaju povećanu sposobnost apsorpcije ovog elementa u tragovima. Povećana sposobnost mononuklearnih stanica da apsorbiraju željezo uvelike je posljedica visoke koncentracije interleukina-1 u cirkulirajućoj krvi, koja se povećava s kroničnom upalom. Pod utjecajem interleukina-1, koji u povećanoj koncentraciji cirkulira krvlju, neutrofili cijelog organizma intenzivno oslobađaju laktoferin. Ovaj protein veže slobodno željezo, koje se oslobađa tijekom razaranja umirućih crvenih krvnih zrnaca, i transportira ga u povećanim količinama do mononuklearnih stanica, koje hvataju i zadržavaju ovaj mikroelement. Posljedično dolazi do inhibicije eritropoeze, što je posljedica smanjenja raspoloživosti željeza za stvaranje eritroidnih stanica.
Vjerojatno se jedna od karika u patogenezi anemije zbog kronične upale može smatrati prekomjernim uništavanjem eritrocita kao posljedicom hiperaktivacije i hiperplazije u sustavu mononuklearnih fagocita.
Dokazuje se skraćivanjem života gotovo normalnih eritrocita čije se patološke promjene svode na smanjen sadržaj željeza i porast sadržaja protoporfirina.
Sideroblastične anemije
Te su anemije povezane s poremećenom sintezom hema kao komponente hemoglobina. Kršenje sinteze hemoglobina u sideroblastičnoj anemiji karakterizira nakupljanje željeza u mitohondrijima koji se nalaze oko jezgre patoloških eritroidnih stanica (sideroblasta). Ove stanice formiraju prstenastu konturu oko stanične jezgre. Poremećaji u sintezi hema u bolesnika sa sideroblastičnom anemijom uzrokuju hipokromiju i mikrocitozu.
Postoje dvije vrste sideroblastične anemije:
1. Nasljedna sideroblastična anemija, koja je monogena bolest, čiji je prijenos s roditelja na bolesnika povezan s kromosomom X ili se nasljeđuje autosomno recesivno. Pretpostavlja se da je nasljedna sideroblastična anemija uzrokovana kongenitalnim nedostatkom aktivnosti enzima sintetaze gama-aminolevulinske kiseline (ključnog enzima u prvom koraku u sintezi porfirina).
Inhibicija aktivnosti enzima može biti primarna ili može biti rezultat urođene malformacije njegovog esencijalnog kofaktora, piridoksal-5-fosfata.
2. Stečena sideroblastična anemija javlja se češće nego nasljedna. Stečena sideroblastična anemija može biti posljedica nuspojava lijekova (izoniazid i dr.). Osim toga, mogu biti idiopatski.
Kršenje iskorištenja željeza za stvaranje hema u sideroblastičnoj anemiji očituje se povećanjem sadržaja slobodnih kationa željeza u serumu, kao i povećanjem koncentracije feritina u njemu.
Talasemija je monogena bolest koja se temelji na inhibiciji sinteze jednog od polimernih lanaca koji čine molekulu globina. Ovisno o vrsti lanca čija je sinteza nedovoljna, talasemija se klasificira u jednu od dvije glavne skupine:
1. Alfa talasemija. Ove bolesti su uzrokovane delecijom (uklanjanjem) alfa-globin gena iz genoma. Postoje četiri takva gena. Ovisno o tome koji je gen izgubljen u genomu, sideroblastična anemija varira u težini od blage do teške, što dovodi do fetalne smrti u maternici.
2. Beta-talasemija, koja uzrokuje odsutnost ili disfunkciju odgovarajućeg gena. Kada je gen disfunkcionalan, dolazi do njegove transkripcije, ali rezultira proizvodnjom abnormalne ribonukleinske kiseline (RNA). Osim toga, disfunkcija gena također se može sastojati od smanjenog stvaranja normalne RNA. Genom sadrži dva različita beta-globinska gena. Dakle, postoje dvije vrste beta talasemije. Kod težeg oblika beta-talasemije (Couleyeva anemija) njezini simptomi postaju vidljivi već u djetinjstvu. Obično u dobi od trideset godina, unatoč transfuziji krvi, dolazi do smrtnog ishoda. Kod manje teške beta-talasemije nema indikacija za transfuziju krvi, a anemija ne ograničava životni vijek.
Pregledom krvnog razmaza u bolesnika s talasemijom otkriva se poikilocitoza, odnosno patološka varijabilnost oblika crvenih krvnih stanica.