Jedno z najważniejszych uogólnień w immunologia koniec XX i początek XXI wieku. było stworzenie opartej na nauce doktryny odporności wrodzonej (z angielskiego odporności wrodzonej), naturalnej, naturalnej i adaptacyjnej (z angielskiego odporności adaptacyjnej) lub adaptacyjnej, odporności nabytej (z angielskiego odporności nabytej). W praktyce immunologicznej często używa się terminów odporność „wrodzona” i „adaptacyjna”, komponenty wrodzone i adaptacyjne. układ odpornościowy, wrodzona i nabyta odpowiedź immunologiczna. Obydwa typy odporności realizowane są poprzez czynniki komórkowe i humoralne. Terminy takie jak „odporność nieswoista”, „nieswoista reaktywność immunologiczna” i tym podobne należą już do przeszłości.
Odporność wrodzona i nabyta reprezentuje dwie współdziałające części jednego układu, który zapewnia rozwój odpowiedzi immunologicznej na genetycznie obce substancje.
Odporność wrodzona- dziedzicznie ustalony system ochrony organizmów wielokomórkowych przed wszelkimi patogennymi i niepatogennymi mikroorganizmami, a także endogennymi produktami niszczenia tkanek.
Jak najwcześniej forma obrony immunologicznej organizmu, wykształciła się odporność wrodzona początkowe etapy ewolucja organizmów wielokomórkowych, aż do pojawienia się zdolności do rearanżacji genów immunoglobulin i TCR, a także możliwości rozpoznawania „własnej” i pełnoprawnej pamięci immunologicznej. Dowodem na to jest obecność różnych wrodzonych genów obronnych u bezkręgowców i roślin. Wiadomo, że bezkręgowce (na przykład stawonogi) mają elementy komórkowe, które pełnią funkcję fagocytarną, oraz czynniki humoralne, takie jak peptydy przeciwdrobnoustrojowe, lektyny itp., które skutecznie rozpoznają i atakują mikroorganizmy chorobotwórcze. Wszystkie te składniki są konserwatywne, dziedziczone i nie podlegają modyfikacjom genetycznym w ciągu życia.
Scharakteryzowano główne cechy wyróżniające oznaki systemy odporność wrodzona.
Odporność wrodzona zapewnia rozpoznanie i eliminację patogenów w ciągu pierwszych kilku minut lub godzin po ich przedostaniu się do organizmu, gdy mechanizmy odporności nabytej są jeszcze nieobecne.
Funkcja wrodzonego układu odpornościowego zachodzi poprzez różnorodne elementy komórkowe (makrofagi, DC, neutrofile, komórki tuczne, eozynofile, bazofile, komórki NK, komórki NKT, niektóre komórki niehematopoetyczne) i czynniki humoralne (naturalne przeciwciała, cytokiny, dopełniacz, białka ostrej fazy, kwasy kationowe) peptydy przeciwdrobnoustrojowe, lizozym itp.).
Komórki wrodzonego układu odpornościowego:
nie twórz klonów. Brak klonalności w organizacji wrodzonego układu odpornościowego jest jedną z jego głównych różnic w stosunku do nabytego układu odpornościowego. W tym sensie każda komórka odporności wrodzonej działa indywidualnie, podczas gdy w przypadku odpowiedzi odporności nabytej wszystkie komórki w obrębie klonu (społeczności) podlegają jednemu, genetycznie zdeterminowanemu programowi;
nie podlegają selekcji negatywnej i pozytywnej;
biorą udział w reakcjach fagocytozy, cytolizy, w tym bakteriolizy, neutralizacji, produkcji cytokin itp.
Uznanie patogeny przez komórki układu odporności wrodzonej realizowana jest poprzez liczne struktury receptorowe, takie jak receptory zmiatające (receptory zmiatające), receptory mannozowe, receptory dopełniacza (CR1, CR3, CR4), receptory lektynowe itp. Grupa specjalna Receptory odporności wrodzonej to tak zwane receptory rozpoznające wzorce (PRR).
Uznają konserwatystów, struktury wspólne dla wielu typów mikroorganizmów, tak zwane wzorce molekularne związane z patogenami (PAMP). Obecnie intensywnie badana jest budowa i funkcje receptorów odporności wrodzonej, takich jak receptory Toll-podobne (TLR), NOD-1, NOD-2, RIG itp. Receptory układu odporności wrodzonej są konserwatywne ewolucyjnie.
Receptory opłat po raz pierwszy odkryto u Drosophila. Receptory Toll-podobne (TLR) u ssaków mają podobną strukturę i funkcję. Receptory tej rodziny są szeroko reprezentowane różne komórki układ odpornościowy (monocyty, DC, leukocyty itp.), a także na wiele komórek organizmu (fibroblasty, śródbłonek, nabłonek, kardiomiocyty itp.). System TLR omówiono bardziej szczegółowo poniżej.
Czynniki odporności wrodzonej nie zmieniają się w trakcie życia organizmu, są kontrolowane przez geny linii zarodkowej i są dziedziczone.
Aktywacja odporności wrodzonej nie tworzy długotrwałej pamięci immunologicznej, ale służy warunek wstępny rozwój nabytej odpowiedzi immunologicznej.
Wszystkie te funkcje są niezwykle ważne dla ochrony przed mikroorganizmami chorobotwórczymi, ale są niewystarczające do życia wysoko zorganizowanych organizmów wielokomórkowych, takich jak kręgowce. To w nich w procesie ewolucji powstały nowe składniki odpornościowe i ukształtował się układ odpornościowy, którego główną funkcją była kontrola nad stałością genetyczną środowiska wewnętrznego organizmu wielokomórkowego. Układ odpornościowy stanął przed zadaniem rozpoznania i zapamiętania „swojego”. Wszystko, co jest antygenowo „własne”, musi zostać zachowane, a wszystko, co jest antygenowo „obce”, musi zostać usunięte z organizmu. W kontekście wielomilionowej różnorodności obcych struktur antygenowych nie da się obejść się bez niewielkiego zestawu genów przekazywanych w drodze dziedziczenia (tzw. genów linii zarodkowej).
Ogólny układ odpornościowy człowieka dzieli się na dwa duże podsystemy - nieswoistą naturalną odporność wrodzoną i nabytą odporność specyficzną (adaptacyjną). Zastanówmy się, co to jest odporność wrodzona jak to działa i dlaczego dana osoba tego potrzebuje. W chwili urodzenia dziecko wchodzi w środowisko odmienne od sterylnego życia wewnątrzmacicznego. Nawet jeśli przestrzegane są wszystkie zasady aseptyki i antyseptyki, dosłownie od pierwszej sekundy życia jest on narażony na atak mikroorganizmów. Jednak dziecko nie zachoruje od chwili urodzenia! Dlaczego to się dzieje? Chodzi przede wszystkim o wrodzoną odporność, która może uchronić noworodka przed niebezpieczeństwem infekcji. Odporność wrodzona jest trwała, jest dziedziczona, co jest związane z biologicznymi właściwościami organizmu. Na przykład zwierzęta nie cierpią na ludzkie choroby weneryczne, a ludzie nie cierpią na księgosusz. Wrodzony układ odpornościowy tworzy potężną barierę zapobiegającą przedostawaniu się bakterii, wirusów, grzybów i tak dalej do organizmu.
Komórki fagocytowe
Odporność wrodzona zapewnia 60% całkowitej obrony naszego organizmu. Zapewnia rozpoznanie i eliminację patogenów w ciągu pierwszych kilku minut lub godzin po ich przedostaniu się do organizmu. Odporność wrodzona zaczyna tworzyć się w połowie pierwszego trymestru ciąży z fagocytami. Fagocyty to komórki zdolne do wchłaniania obcych organizmów. „Wyrastają” z komórek macierzystych i przechodzą „trening” w śledzionie, dzięki czemu potrafią później odróżnić siebie od innych. Komórki fagocytowe zwykle krążą po całym organizmie w poszukiwaniu obcych materiałów, ale mogą zostać wezwane do określonego miejsca przez cytokiny. Fagocytoza jest ważną cechą komórkowego składnika odporności wrodzonej i najprawdopodobniej reprezentuje ją najwięcej stary mundur ochrona organizmu, ponieważ fagocyty występują zarówno u kręgowców, jak i bezkręgowców.
Czynniki odporności wrodzonej
Odporność wrodzona- To wrodzona zdolność niszczenia wszystkiego, co obce ciału. Stanowi pierwszą linię obrony organizmu ssaków przed nowotworami i chorobami zakaźnymi. Główną zewnętrzną barierą ochronną, która zapobiega przedostawaniu się mikroorganizmów do organizmu człowieka, jest skóra i błony śluzowe. Właściwości ochronne skóry to przede wszystkim jej nieprzepuszczalność ( bariera fizyczna) oraz obecność na powierzchni inhibitorów mikroorganizmów (kwasu mlekowego i kwasów tłuszczowych w pocie i wydzielinach). gruczoły łojowe, niskie pH powierzchni). Błona śluzowa ma wieloskładnikowy mechanizm obronny. Wydzielany przez jego komórki śluz zapobiega przyleganiu do niego drobnoustrojów, a ruch rzęsek pomaga „wymiatać” obce substancje z dróg oddechowych. Łzy, ślina i mocz aktywnie zmywają obce substancje z błon śluzowych. Wiele płynów wydzielanych przez organizm ma specyficzne właściwości bakteriobójcze. Na przykład, kwas chlorowodorowyżołądek, sperminę i cynk w nasieniu, laktoperoksydazę w mleku matki i lizozym w wielu wydzielinach zewnętrznych (nos, łzy, żółć, treść dwunastnicy, mleko matki itp.) mają silne właściwości bakteriobójcze. Niektóre enzymy mają również działanie bakteriobójcze, na przykład hialuronidaza, α1-antytrypsyna, lipoproteinaza.
Wrodzone komórki odpornościowe
Wrodzone komórki odpornościowe nie twórz klonów. Każda komórka wrodzonego układu odpornościowego działa indywidualnie. Czynniki odporności wrodzonej nie zmieniają się w trakcie życia organizmu, są kontrolowane przez geny linii zarodkowej i są dziedziczone. Komórki odporności wrodzonej, komórki NK lub komórki NK, są zdolne do zabijania szerokiego zakresu komórek – od komórek zakażonych wirusem po komórki nowotworowe. Spadek aktywności komórek NK i spadek liczby komórek w populacji komórek NK są związane z rozwojem i szybkim postępem chorób takich jak nowotwory, wirusowe zapalenie wątroby, AIDS, zespół chronicznego zmęczenia, zespół niedoborów odporności oraz szeregu schorzeń. choroby autoimmunologiczne. Wykazało to wiele badań niskie poziomy Populacja komórek NK koreluje z szybszym rozprzestrzenianiem się nowotworów, krótszym życiem pacjentów i większą śmiertelnością. Wzrost aktywności funkcjonalnej komórek NK jest bezpośrednio powiązany z manifestacją działania przeciwwirusowego i przeciwnowotworowego. Poszukiwanie leków zwiększających aktywność tej części układu odporności wrodzonej wydaje się strategicznie perspektywiczne dla rozwoju. leki przeciwwirusowe szerokie spektrum działania. Dlatego czołowi naukowcy na całym świecie są zajęci poszukiwaniem takich leków. Tymczasem taki lek już istnieje, ale o tym poniżej.
Stymulatory komórek odporności wrodzonej
Niestety, u prawie połowy populacji naszej planety poziom komórek NK jest znacznie niższy niż normalnie. Ten stan nazywa się niedoborem odporności. Niedobory odporności prowadzą do częstszych chorób zakaźnych i są przyczyną większej zachorowalności i śmiertelności na nowotwory. Dlatego dzisiaj istnieje pilna potrzeba opracowania środków stymulujących wzrost liczby i aktywności funkcjonalnej NK, a co za tym idzie, prowadzących do eliminacji niedoborów odporności i pomagających wzmocnić układ odpornościowy.  W tym celu w praktyce stosuje się immunomodulatory i adaptogeny. Ich aktywność nie jest jednak wystarczająco wysoka. Niedawno ustalono, że najbardziej aktywnymi stymulatorami funkcji komórek NK są tzw. białka czynnika transferu, które zawarte są w leukocytach krwi oraz, jak się okazuje, w siarze krów, kóz i żółtku jaja. Białka te wykazują 4-5 razy większą aktywność immunostymulującą w porównaniu ze znanymi aktywnymi immunomodulatorami stosowanymi w medycynie praktycznej. A dzięki dostępności źródła czynników transferowych otwiera się możliwość ich pozyskiwania w nieograniczonych ilościach. Firma 4Life zainspirowana możliwościami transferferów zaczęła jako pierwsza produkować lek Transfer Factor, który opiera się na transferorach pochodzących z siary krowiej i żółtek jaj. Wchłonięte do krwi czynniki transferowe pędzą do cząsteczki DNA, sprawdzają ją pod kątem uszkodzeń i dzięki zawartym w nich informacjom przywracają jej integralność. Rezultatem jest debugowanie wszystkich procesów odpornościowych. Innymi słowy, po przyjęciu Transfer Factor sam układ odpornościowy zaczyna rozumieć, kiedy, jak i jak zareagować na ten czy inny rodzaj zagrożenia. Już dziś możesz kupić Transfer Factor na Ukrainie, w tym celu wystarczy do nas zadzwonić lub wypełnić specjalny formularz zamówienia.
W tym celu w praktyce stosuje się immunomodulatory i adaptogeny. Ich aktywność nie jest jednak wystarczająco wysoka. Niedawno ustalono, że najbardziej aktywnymi stymulatorami funkcji komórek NK są tzw. białka czynnika transferu, które zawarte są w leukocytach krwi oraz, jak się okazuje, w siarze krów, kóz i żółtku jaja. Białka te wykazują 4-5 razy większą aktywność immunostymulującą w porównaniu ze znanymi aktywnymi immunomodulatorami stosowanymi w medycynie praktycznej. A dzięki dostępności źródła czynników transferowych otwiera się możliwość ich pozyskiwania w nieograniczonych ilościach. Firma 4Life zainspirowana możliwościami transferferów zaczęła jako pierwsza produkować lek Transfer Factor, który opiera się na transferorach pochodzących z siary krowiej i żółtek jaj. Wchłonięte do krwi czynniki transferowe pędzą do cząsteczki DNA, sprawdzają ją pod kątem uszkodzeń i dzięki zawartym w nich informacjom przywracają jej integralność. Rezultatem jest debugowanie wszystkich procesów odpornościowych. Innymi słowy, po przyjęciu Transfer Factor sam układ odpornościowy zaczyna rozumieć, kiedy, jak i jak zareagować na ten czy inny rodzaj zagrożenia. Już dziś możesz kupić Transfer Factor na Ukrainie, w tym celu wystarczy do nas zadzwonić lub wypełnić specjalny formularz zamówienia.
Wzmocnienie odporności. Jednak niewielu z nas wie, że koncepcja układu odpornościowego ma swoje własne typy i cechy. Czym jest odporność człowieka? Rozwiążmy to razem.
Trochę terminologii
Pod tym pojęciem kryje się zdolność organizmu do zapobiegania działaniu bakterii, toksyn i innych szkodliwych substancji. Lekarze rozróżniają takie rodzaje odporności, jak wrodzona i nabyta, które z kolei dzielą się na inne formy, o których porozmawiamy nieco później.
Głównym zadaniem układu odpornościowego organizmu jest utrzymanie zdrowia i prawidłowego funkcjonowania wszystkich narządów i układów człowieka. Odporność pełni zatem rolę bariery ochronnej, która nas oddziela środowisko. Przyjrzyjmy się bliżej rodzajom i formom funkcji ochronnych organizmu ludzkiego.
Odporność wrodzona
Ten rodzaj ochrony jest związany z cechami ciała dziedziczonymi w chwili urodzenia. Funkcjonowanie odporności wrodzonej zapewnia wiele czynników komórkowych i pozakomórkowych (tzw.). Na przykład skóra i błony śluzowe stanowią niezawodną barierę dla większości drobnoustrojów. Organizm chroniony jest także przez pot, gruczoły łojowe, ślinianki. Uwalniane przez nie substancje są dla większości szkodliwe bakterie chorobotwórcze. Prawidłowa mikroflora jelitowa zawiera mikroorganizmy, które są naturalnymi wrogami wielu patogenów. Zwalczają także infekcje w przewodzie pokarmowym sok żołądkowy, enzymy i żółć.
Naturalne mechanizmy obronne organizmu są bardzo silne. Ale jego wrogowie - mikroorganizmy, obce cząsteczki i komórki - nieustannie próbują przedostać się do środka, zakłócając integralność barier lub normalne wydzielanie narządów i układów - obniżając naturalną odporność. Czynnikami prowokującymi w takiej sytuacji są hipotermia lub stres, brak witamin lub leków, brak równowagi hormonalnej lub interwencja chirurgiczna. W tym przypadku przenikanie mikroorganizmów do organizmu jest znacznie ułatwione. Ale tutaj wchodzi w życie inny rodzaj obrony ciała. Porozmawiamy o tym szczegółowo później.
Odporność nabyta
Jeśli obcy czynnik przedostał się przez naturalną barierę do krwioobiegu organizmu, może pojawić się kilka możliwości powiązania układu odpornościowego z bakteriami, z których jedną jest choroba zakaźna. W takim przypadku aktywowana jest odporność nabyta, która w przyszłości zwalczy infekcję.
Główną cechą tego typu odporności jest wytwarzanie specyficznych przeciwciał przeciwko określonemu antygenowi. Powstaje w ciągu życia człowieka i nie jest dziedziczona. Wyjątkowość odporności nabytej polega na tym, że w zależności od przebytych chorób ulega ona zmianom, wytwarzając nowe przeciwciała. Tego typu funkcje ochronne organizmu mogą być naturalne lub nabyte sztucznie. Rozważmy szczegółowo te formy odporności.
Jeśli po tym pojawi się ochronna bariera immunologiczna przebyta choroba nazywa się to naturalną odpornością nabytą. Po ataku patogenów organizm sam wytwarza przeciwciała. Czasami chronią organizm przed ponownym zakażeniem tygodniami i miesiącami (grypą, ARVI), a może nawet przez długie lata lub przez całe życie, jak w przypadku odry lub szkarlatyny (ta odporność nazywa się trwałą).
Kiedy osobie wstrzykuje się osłabione patogeny, które powodują odpowiedź immunologiczną w organizmie, mówimy o sztucznie nabytej odporności czynnej. Jeśli do organizmu zostaną wprowadzone gotowe przeciwciała, powstaje odporność bierna, która pozwala w możliwie najkrótszym czasie chronić osobę, która miała kontakt z pacjentem. Jednak ta forma funkcji ochronnych organizmu jest słabsza w porównaniu z aktywnym typem nabytej bariery immunologicznej.
Uderzającym przedstawicielem odporności biernej jest noworodek. Jeszcze w łonie matki dziecko otrzymuje przez łożysko przeciwciała przeciwko patogenom chorób, na które cierpiała matka. W ciągu 3-6 miesięcy życia ten rodzaj odporności słabnie, a pod koniec pierwszego roku życia całkowicie zanika. Można go jednak wzmocnić, ćwicząc karmienie piersią.
Podsumowując wszystko powyższe, możemy stwierdzić, że odporność jest dość złożonym systemem, który wymaga stałej pomocy z zewnątrz w postaci szczepień, przestrzegania zasad higieny, zdrowe odżywianie I aktywność fizyczna. Oznacza to, że aby być zdrowym, wystarczy przestrzegać tych zasad.
9.1. Wprowadzenie do immunologii9.1.1. Główne etapy rozwoju immunologii
Każdy człowiek na planecie (z wyjątkiem bliźniąt jednojajowych) ma unikalne, genetycznie zdeterminowane cechy biopolimerów, z których zbudowane jest jego ciało. Jednakże jego ciało żyje i rozwija się w bezpośrednim kontakcie z przedstawicielami przyrody żywej i nieożywionej oraz różnymi cząsteczkami bioorganicznymi pochodzenia naturalnego lub sztucznego, które wykazują aktywność biologiczną. Dostając się do organizmu człowieka, odpady i tkanki innych ludzi, zwierząt, roślin, drobnoustrojów, a także obce cząsteczki mogą zakłócać i zakłócać procesy biologiczne, stwarzając zagrożenie dla życia jednostki. Osobliwość z tych czynników to obcość genetyczna. Często takie produkty powstają wewnątrz organizmu człowieka w wyniku syntetycznego działania zamieszkującej nas mikroflory, mutacji komórkowych i różnorodnych modyfikacji makrocząsteczek, z których jesteśmy zbudowani.
Aby chronić przed niechcianą i destrukcyjną interwencją, ewolucja stworzyła przedstawicieli żywej natury specjalny system przeciwdziałanie, którego skumulowany efekt określono jako odporność(od łac. odporności- wyzwolenie od czegoś, nienaruszalność). Terminem tym posługiwano się już w średniowieczu na określenie np. zwolnienia z płacenia podatków, a później – nietykalności misji dyplomatycznej. Znaczenie tego terminu dokładnie odpowiada zadaniom biologicznym, jakie wyznaczyła ewolucja w odniesieniu do odporności.
Do najważniejszych z nich należy rozpoznanie różnicy genetycznej pomiędzy strukturami interwencyjnymi a własnymi i wyeliminowanie jej wpływu na procesy biologiczne zachodzące w organizmie za pomocą zestawu specjalnych reakcji i mechanizmów. Ostatecznym celem układu odpornościowego jest zachowanie homeostazy, integralności strukturalnej i funkcjonalnej oraz indywidualności genetycznej zarówno pojedynczego organizmu, jak i gatunku jako całości, a także opracowanie sposobów zapobiegania takim ingerencjom w przyszłości.
W konsekwencji odporność jest sposobem ochrony organizmu przed genetycznie obcymi substancjami pochodzenia egzogennego i endogennego, mającym na celu utrzymanie i zachowanie homeostazy, integralności strukturalnej i funkcjonalnej organizmu oraz indywidualności genetycznej każdego organizmu i gatunku jako całości.
Odporność jako ogólne zjawisko biologiczne i ogólnomedyczne, jego budowa anatomiczna i mechanizmy funkcjonowania w organizmie badana jest przez naukę specjalną - immunologię. Nauka ta powstała ponad 100 lat temu. Wraz z postępem wiedzy ludzkiej, zmieniały się poglądy na temat odporności, jej roli w organizmie i mechanizmach reakcji immunologicznych, poszerzał się zakres praktycznego wykorzystania osiągnięć immunologii, a co za tym idzie, zmieniało się samo określenie immunologii jako nauki . Immunologię często interpretuje się jako naukę badającą odporność swoistą na patogeny chorób zakaźnych i opracowującą metody ochrony przed nimi. Jest to pogląd jednostronny, który nie zapewnia kompleksowego, wszechstronnego rozumienia nauki, opartego na istocie i mechanizmach odporności oraz jej roli w życiu organizmu. NA nowoczesna scena rozwoju doktryny odporności, immunologię można zdefiniować jako ogólną naukę biologiczną i ogólnomedyczną, która bada metody i mechanizmy ochrony organizmu przed genetycznie obcymi substancjami pochodzenia egzogennego i endogennego w celu utrzymania homeostazy, integralności strukturalnej i funkcjonalnej ciała i indywidualności genetycznej jednostki i gatunku jako całości. Definicja ta podkreśla, że immunologia jako nauka jest jednolita niezależnie od przedmiotu badań: człowieka, zwierzęcia czy rośliny. Oczywiście podstawy anatomiczne i fizjologiczne, zestaw mechanizmów i reakcji, a także metody ochrony przed antygenami u przedstawicieli zwierząt
I flora będzie się różnić, ale podstawowa istota odporności nie ulegnie zmianie. W immunologii wyróżnia się trzy dziedziny: immunologię medyczną (homoimmunologię), zooimmunologię i fitoimmunologię, które zajmują się badaniem odporności odpowiednio u ludzi, zwierząt i roślin, a w każdym z nich - ogólnej i specyficznej. Jedną z jego najważniejszych sekcji jest immunologia medyczna. Immunologia medyczna rozwiązuje dziś tak ważne problemy jak diagnostyka, profilaktyka i leczenie chorób zakaźnych (immunoprewencja czy wakcynologia), schorzeń alergicznych (alergologia), nowotwory złośliwe(immuno-onkologia), choroby, w których mechanizmie biorą udział procesy immunopatologiczne (immunopatologia), związki immunologiczne matki z płodem na wszystkich etapach rozrodu (immunologia rozrodu), bada mechanizmy odpornościowe i wnosi praktyczny wkład w rozwiązanie problemu przeszczepiania narządów i tkanek (immunologia transplantacyjna); Wyróżnia się także immunohematologię, która bada relację dawcy i biorcy podczas transfuzji krwi, immunofarmakologię, która bada wpływ na procesy odpornościowe substancje lecznicze. W ostatnie lata wyróżniono immunologię kliniczną i środowiskową. Immunologia kliniczna bada i rozwija problemy diagnostyki i leczenia chorób wynikających z wrodzonych (pierwotnych) i nabytych (wtórnych) niedoborów odporności, a immunologia środowiskowa zajmuje się wpływem na układ odpornościowy wszelkiego rodzaju czynniki środowiskowe(klimatyczno-geograficzne, społeczne, zawodowe itp.).
Chronologicznie immunologia jako nauka przeszła już przez dwa duże okresy (Ulyankina T.I., 1994): okres protoimmunologii (od okres starożytny do lat 80. XIX w.), związany ze spontaniczną, empiryczną wiedzą o reakcjach obronnych organizmu oraz okresem kształtowania się immunologii eksperymentalnej i teoretycznej (od lat 80. XIX w. do drugiej dekady XX w.). W drugim okresie zakończono tworzenie immunologii klasycznej, która miała głównie charakter immunologii zakaźnej. Od połowy XX wieku immunologia wkroczyła w trzeci okres, genetyki molekularnej, który trwa do dziś. Okres ten charakteryzuje się szybkim rozwojem immunologii molekularnej i komórkowej oraz immunogenetyki.
Zapobieganie ospie poprzez szczepienie ludzi ospą krowią zaproponowano ponad 200 lat temu Angielski lekarz E. Jenner jednak spostrzeżenie to miało charakter czysto empiryczny. Dlatego francuski chemik L. Pasteur, który odkrył zasadę szczepień, oraz rosyjski zoolog II.I. słusznie uważani są za twórców immunologii naukowej. Mechnikov jest autorem doktryny fagocytozy i niemieckiego biochemika P. Ehrlicha, który sformułował hipotezę o przeciwciałach. W 1888 roku za wybitne zasługi L. Pasteura dla ludzkości, z darowizn publicznych utworzono Instytut Immunologii (obecnie Instytut Pasteura), będący szkołą, wokół której skupiali się immunologowie z wielu krajów. Rosyjscy naukowcy aktywnie uczestniczyli w tworzeniu i rozwoju immunologii. Od ponad 25 lat I.I. Mechnikov był zastępcą dyrektora ds. nauki w Instytucie Pasteura, tj. był jego najbliższym asystentem i osobą o podobnych poglądach. W Instytucie Pasteura pracowało wielu wybitnych rosyjskich naukowców: M. Bezredka, N.F. Gamaleya, Los Angeles Tarasowicz, G.N. Gabrichevsky, I.G. Sawczenko, S.V. Korshun, D.K. Zabolotny, V.A. Barykin, N.Ya. i F.Ya. Chistovichi i wielu innych. Naukowcy ci kontynuowali rozwój tradycji Pasteura i Miecznikowa w immunologii i zasadniczo stworzyli rosyjską szkołę immunologów.
Rosyjscy naukowcy są właścicielami wielu wybitne odkrycia w zakresie immunologii: I.I. Mechnikov położył podwaliny pod doktrynę fagocytozy, V.K. Wysokowycz jako jeden z pierwszych sformułował rolę układu siateczkowo-śródbłonkowego w odporności, G.N. Gabrichevsky opisał zjawisko chemotaksji leukocytów, F.Ya. Chistowicz stał u początków odkrycia antygenów tkankowych, M. Raisky ustalił zjawisko ponownego szczepienia, tj. pamięć immunologiczna, M. Sacharow - jeden z twórców doktryny anafilaksji, akademik. LA. Zilber stał u początków doktryny o antygenach nowotworowych, akademik. P.F. Zdrodovsky uzasadnił fizjologiczny kierunek w immunologii, akademik. R.V. Petrov wniósł znaczący wkład w rozwój niezakaźnej immunologii.
Rosyjscy naukowcy są słusznie liderami w rozwoju podstawowych i stosowanych problemów wakcynologii i ogólnie immunoprofilaktyki. Nazwiska twórców szczepionek przeciwko tularemii (B.Ya. Elbert i N.A. Gaisky) są dobrze znane w naszym kraju i za granicą. wąglik(N.N. Ginzburg), polio
lita (M.P. Chumakov, A.A. Smorodintsev), odra, świnka, grypa (A.A. Smorodintsev), gorączka Q i tyfus (P.F. Zdrodovsky), polianatoksyny przeciwko infekcjom ran i zatruciu jadem kiełbasianym (A A. Vorobyov, G. V. Vygodchikov, P. N. Burgasov) i inne. naukowcy brali czynny udział w opracowywaniu szczepionek i innych leków immunobiologicznych, strategiach i taktyce immunoprofilaktyki, globalnej eliminacji i ograniczaniu chorób zakaźnych. W szczególności z ich inicjatywy i przy ich pomocy wykorzeniono z świata ospę prawdziwą (V.M. Zhdanov, O.G. Andzhaparidze), polio udało się skutecznie wykorzenić (M.P. Chumakov, S.G. Drozdov).
W stosunkowo krótkim okresie historycznym immunologia osiągnęła znaczące wyniki w ograniczaniu i eliminowaniu chorób ludzkich, zachowując i utrzymując zdrowie mieszkańców naszej planety.
9.1.2. Rodzaje odporności
Umiejętność rozpoznawania obcych struktur i ochrony własnego ciała przed najeźdźcami ukształtowała się dość wcześnie. Organizmy niższe, zwłaszcza bezkręgowce (gąbki, koelenteraty, robaki), posiadają już elementarne systemy ochrony przed wszelkimi substancjami obcymi. Organizm ludzki, podobnie jak wszystkie zwierzęta stałocieplne, posiada już złożony system przeciwdziałania czynnikom obcym genetycznie. Jednakże budowa anatomiczna, funkcje fizjologiczne i reakcje, które zapewniają taką ochronę u niektórych gatunków zwierząt, u ludzi i organizmy niższe w zależności od poziomu rozwoju ewolucyjnego różnią się znacznie.
Zatem fagocytoza i hamowanie allogeniczne, jako jedna z wczesnych filogenetycznych reakcji obronnych, są nieodłączne dla wszystkich organizmów wielokomórkowych; zróżnicowane komórki leukocytopodobne, które pełnią funkcje odporności komórkowej, pojawiają się już w koelenteratach i mięczakach; w cyklostomach (lamreyach) pojawiają się podstawy grasicy, limfocyty T, immunoglobuliny i odnotowuje się pamięć immunologiczną; ryby mają już narządy limfatyczne typowe dla zwierząt wyższych – grasicę i śledzionę, komórki plazmatyczne i przeciwciała klasy M; ptaki mają Główny autorytet odporność w postaci torebki Fabrycjusza, mają zdolność natychmiastowego reagowania w postaci nadwrażliwości
nowy typ. Wreszcie u ssaków układ odpornościowy osiąga maksimum wysoki poziom rozwój: powstają systemy T, B i A komórki odpornościowe, zachodzi ich kooperatywna interakcja, pojawia się zdolność do syntezy immunoglobulin różnych klas i form odpowiedzi immunologicznej.
W zależności od poziomu rozwoju ewolucyjnego, charakterystyki i złożoności utworzonego układu odpornościowego oraz zdolności tego ostatniego do reagowania określonymi reakcjami na antygeny, w immunologii zwyczajowo rozróżnia się odrębne typy odporności.
Wprowadzono zatem pojęcie odporności wrodzonej i nabytej (ryc. 9.1). Odporność wrodzona lub gatunkowa, zwana także dziedziczną, genetyczną, konstytucyjną, jest genetycznie utrwaloną, dziedziczną odpornością osobników danego gatunku na jakikolwiek obcy czynnik powstały w procesie filogenezy. Przykładem jest odporność człowieka na niektóre patogeny, w tym szczególnie niebezpieczne dla zwierząt gospodarskich (księgosusz, rzekomy pomór drobiu atakujący ptaki, ospa końska itp.) oraz niewrażliwość człowieka na bakteriofagi infekujące komórki bakteryjne. Odporność gatunkową można wyjaśnić na różne sposoby: niezdolność obcego czynnika do przylegania do komórek i cząsteczek docelowych, które determinują inicjację procesu patologicznego i aktywację układu odpornościowego, jego szybkie zniszczenie przez enzymy makroorganizmu oraz brak warunki kolonizacji makroorganizmu.
Może być odporność gatunkowa absolutny I względny. Na przykład żaby niewrażliwe na toksynę tężcową reagują na jej podanie, gdy wzrasta temperatura ich ciała. Zwierzęta laboratoryjne, które są niewrażliwe na jakikolwiek obcy czynnik, reagują na to na tle wprowadzenia leków immunosupresyjnych lub usunięcia centralnego narządu odporności - grasicy.
Odporność nabyta to odporność na wrażliwy na nią czynnik obcy w organizmie człowieka lub zwierzęcia, nabyta w procesie rozwoju jednostki, tj. rozwój każdego człowieka indywidualnie. Jego podstawą jest potencjał ochrony immunologicznej, który realizowany jest tylko wtedy, gdy jest to konieczne i pod pewnymi warunkami. Odporność nabyta, a raczej jej końcowy rezultat, nie jest dziedziczona sama w sobie (w przeciwieństwie do oczywiście potencji), lecz jest indywidualnym doświadczeniem na całe życie.
Ryż. 9.1. Klasyfikacja rodzajów odporności
Wyróżnić naturalny I sztuczny odporność nabyta. Przykładem naturalnej odporności nabytej u człowieka jest odporność na infekcję, która pojawia się po przebytej chorobie choroba zakaźna(tzw. odporność poinfekcyjna), np. po szkarlatynie. Sztuczna odporność nabyta jest tworzona celowo, aby wytworzyć odporność w organizmie
na konkretny czynnik poprzez wprowadzenie specjalnych preparatów immunobiologicznych, np. szczepionek, surowic odpornościowych, komórek immunokompetentnych (patrz rozdział 14).
Odporność nabyta może być aktywny I bierny. Aktywna odporność ze względu na bezpośrednie zaangażowanie układu odpornościowego w proces jego powstawania (np. odporność poszczepienna, odporność poinfekcyjna). Odporność bierna powstaje poprzez wprowadzenie do organizmu gotowych immunoodczynników, które mogą zapewnić niezbędną ochronę. Leki te obejmują przeciwciała (preparaty immunoglobulin i surowice odpornościowe) i limfocyty. Odporność bierna powstaje u płodu w okresie embrionalnym w wyniku przenikania przeciwciał matczynych przez łożysko, a podczas karmienia piersią - gdy dziecko wchłania przeciwciała zawarte w mleku.
Ponieważ w tworzeniu odporności biorą udział komórki układu odpornościowego i czynniki humoralne, jest to akceptowane odporność czynna różnicują się w zależności od tego, który składnik odpowiedzi immunologicznej odgrywa wiodącą rolę w tworzeniu ochrony przed antygenem. Pod tym względem istnieje rozróżnienie humoralny, komórkowy odporność. Przykładem odporności komórkowej jest odporność na przeszczepy, w przypadku której wiodącą rolę w odporności odgrywają cytotoksyczne limfocyty T. Odporność podczas infekcji toksycznych (błonica) i zatruć (tężec, zatrucie jadem kiełbasianym) opiera się głównie na przeciwciałach (antytoksynach).
W zależności od kierunku odporności, tj. charakter obcego agenta, emituje antytoksyczne, przeciwwirusowe, przeciwgrzybicze, przeciwbakteryjne, przeciwpierwotniakowe, transplantacyjne, przeciwnowotworowe i inne rodzaje odporności.
Odporność można utrzymać lub utrzymać w przypadku braku lub tylko w obecności obcego czynnika w organizmie. W pierwszym przypadku taki czynnik pełni rolę czynnika wyzwalającego i nazywa się odporność jałowy, w sekundę - niesterylny. Przykładem odporności sterylnej jest odporność poszczepienna po wprowadzeniu zabitych szczepionek, a odpornością niesterylną jest odporność na gruźlicę, która jest podtrzymywana przez stałą obecność Mycobacterium tuberculosis w organizmie.
Immunitet może być systemowe te. uogólniony, rozprzestrzeniający się po całym ciele i lokalny, w którym
Obserwuje się wyraźniejszy opór poszczególnych narządów i tkanek. Z reguły biorąc pod uwagę funkcje budowa anatomiczna i organizacji funkcjonowania, pojęcie „odporności miejscowej” odnosi się do odporności błon śluzowych (dlatego czasami nazywa się ją śluzówką) oraz skóra. Podział ten jest również warunkowy, ponieważ w procesie rozwoju odporności te typy odporności mogą się wzajemnie przekształcać.
9.2. Odporność wrodzona
Wrodzony(gatunkowe, genetyczne, konstytucyjne, naturalne, niespecyficzne) odporność- jest to odporność na czynniki zakaźne (lub antygeny) rozwinięta w procesie filogenezy, dziedziczona i nieodłączna u wszystkich osobników tego samego gatunku.
Główną cechą czynników biologicznych i mechanizmów zapewniających taką oporność jest obecność w organizmie gotowych (wstępnie uformowanych) efektorów, które są w stanie zapewnić szybkie zniszczenie patogenu, bez długotrwałych reakcji przygotowawczych. Stanowią pierwszą linię obrony organizmu przed zewnętrzną agresją mikrobiologiczną lub antygenową.
9.2.1. Czynniki odporności wrodzonej
Jeśli uwzględnimy trajektorię drobnoustroju chorobotwórczego w dynamice procesu infekcyjnego, łatwo zauważyć, że organizm buduje na tej drodze różne linie obrony (tabela 9.1). Przede wszystkim jest to nabłonek powłokowy skóry i błon śluzowych, który wykazuje odporność na kolonizację. Jeśli patogen jest uzbrojony w odpowiednie czynniki inwazyjne, wówczas penetruje tkankę podnabłonkową, gdzie rozwija się ostra reakcja zapalna, ograniczając patogen przy bramie wejściowej. Kolejną stacją na drodze patogenu są regionalne węzły chłonne, przez które transportowany jest on przez limfę naczynia limfatyczne, drenując tkankę łączną. Naczynia i węzły limfatyczne reagują na penetrację rozwojem zapalenia naczyń chłonnych i zapalenia węzłów chłonnych. Po pokonaniu tej bariery drobnoustroje przedostają się do krwi poprzez odprowadzające naczynia limfatyczne – w odpowiedzi może rozwinąć się ogólnoustrojowa odpowiedź zapalna.
weterynarz. Jeśli drobnoustrój nie umiera we krwi, rozprzestrzenia się krwionośnie na narządy wewnętrzne - rozwijają się uogólnione formy infekcji.
Tabela 9.1. Czynniki i mechanizmy odporności przeciwinfekcyjnej (zasada wzmacniania obrony przeciwdrobnoustrojowej według Mayansky A.N., 2003)
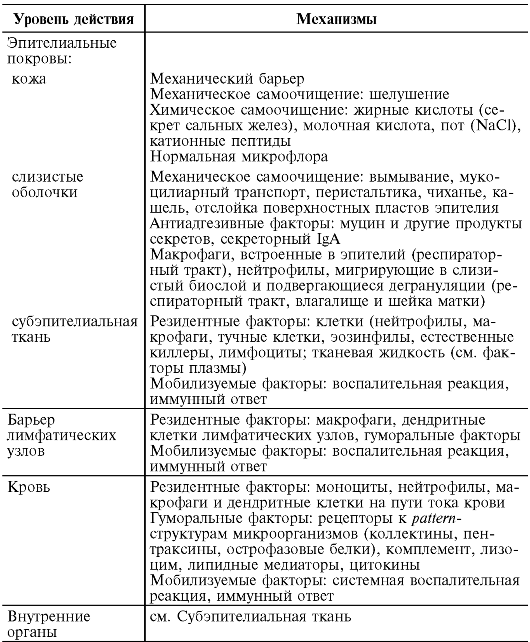 Czynniki odporności wrodzonej obejmują:
Czynniki odporności wrodzonej obejmują:
Skóra i błony śluzowe;
Czynniki komórkowe: neutrofile, makrofagi, komórki dendrytyczne, eozynofile, bazofile, komórki NK;
Czynniki humoralne: układ dopełniacza, rozpuszczalne receptory dla struktur powierzchniowych mikroorganizmów (struktury wzorcowe), peptydy przeciwdrobnoustrojowe, interferony.
Skóra i błony śluzowe. Cienka warstwa komórek nabłonkowych wyściełających powierzchnię skóry i błon śluzowych stanowi barierę praktycznie nieprzeniknioną dla mikroorganizmów. Oddziela sterylne tkanki organizmu od mikrobiologicznego świata zewnętrznego.
Skóra pokryte wielowarstwowym nabłonkiem płaskonabłonkowym, w którym wyróżnia się dwie warstwy: rogową i podstawną.
Keratynocyty warstwy rogowej naskórka to martwe komórki, odporne na działanie agresywnych związków chemicznych. Na ich powierzchni nie ma receptorów dla cząsteczek adhezyjnych mikroorganizmów, dlatego wykazują znaczną odporność na kolonizację i stanowią najskuteczniejszą barierę dla większości bakterii, grzybów, wirusów i pierwotniaków. Wyjątkiem jest S. aureus, Pr. trądzik, I. pestis, i najprawdopodobniej przenikają albo przez mikropęknięcia, albo za pomocą owadów wysysających krew, albo przez ujścia gruczołów potowych i łojowych. Najbardziej wrażliwe są usta gruczołów łojowych i potowych oraz mieszki włosowe w skórze, ponieważ tutaj warstwa zrogowaciałego nabłonka staje się cieńsza. W ochronie tych miejsc ważną rolę odgrywają produkty wydzielane przez gruczoły potowe i łojowe, zawierające kwasy mlekowy i tłuszczowy, enzymy oraz peptydy antybakteryjne o działaniu antybakteryjnym. To właśnie w ustach przydatków skóry zlokalizowana jest głęboko zasiedlająca mikroflora, która tworzy mikrokolonie i wytwarza czynniki ochronne (patrz rozdział 4).
Oprócz keratynocytów naskórek zawiera jeszcze dwa rodzaje komórek - komórki Langerhansa i komórki Greensteina (przetworzone epidermocyty, stanowiące 1-3% karocytów warstwy podstawnej). Komórki Langerhansa i Greensteina mają pochodzenie mieloidalne i należą do komórek dendrytycznych. Zakłada się, że komórki te mają przeciwną funkcję. Komórki Langerhansa biorą udział w prezentacji antygenu i indukują odpowiedź immunologiczną, a komórki Greensteina wytwarzają cytokiny, które tłumią odpowiedź immunologiczną.
reakcje mune na skórze. Typowe keratynocyty i komórki dendrytyczne naskórka wraz ze strukturami limfoidalnymi skóry właściwej biorą czynny udział w reakcjach odporności nabytej (patrz poniżej).
Zdrowa skóra ma wysoka zdolność do samooczyszczenia. Łatwo to udowodnić, nakładając na jej powierzchnię bakterie nietypowe dla skóry – po pewnym czasie drobnoustroje te znikają. Na tej zasadzie opierają się metody oceny funkcji bakteriobójczej skóry.
Błony śluzowe. Większość infekcji zaczyna się nie od skóry, ale od błon śluzowych. Wynika to po pierwsze z większy obszar ich powierzchnie (błony śluzowe ok. 400 m 2, skóra ok. 2 m 2), po drugie, z mniejszą ochroną.
Błony śluzowe nie posiadają nabłonka wielowarstwowego płaskiego. Na ich powierzchni znajduje się tylko jedna warstwa komórek nabłonkowych. W jelicie są to jednowarstwowy nabłonek kolumnowy, kubkowe komórki wydzielnicze i komórki M (komórki nabłonka błony komórkowej), zlokalizowane w warstwie komórek nabłonkowych, pokrywających nagromadzenia limfoidalne. Komórki M są najbardziej podatne na penetrację wielu patogennych mikroorganizmów ze względu na szereg cech: obecność specyficznych receptorów dla niektórych mikroorganizmów (Salmonella, Shigella, patogenna Escherichia itp.), których nie ma na sąsiednich enterocytach; rozrzedzona warstwa śluzu; zdolność do endocytozy i pipocytozy, co zapewnia ułatwiony transport antygenów i mikroorganizmów z rurki jelitowej do tkanki limfatycznej związanej ze śluzem (patrz rozdział 12); brak silnego aparatu lizosomalnego, charakterystycznego dla makrofagów i neutrofili, dzięki któremu bakterie i wirusy przemieszczają się do przestrzeni podnabłonkowej bez zniszczenia.
Komórki M należą do ukształtowanego ewolucyjnie systemu ułatwionego transportu antygenów do komórek immunokompetentnych, a bakterie i wirusy wykorzystują tę drogę do translokacji przez barierę nabłonkową.
Komórki nabłonkowe, podobne do jelitowych komórek M, związane z tkanką limfatyczną, występują w błonach śluzowych drzewa oskrzelowo-pęcherzykowego, nosogardzieli i układu rozrodczego.
Odporność na kolonizację nabłonka powłokowego. Każdy proces zakaźny rozpoczyna się od przylegania patogenu do błony śluzowej
powierzchni wrażliwych komórek nabłonkowych (z wyjątkiem mikroorganizmów przenoszonych przez ukąszenia owadów lub pionowo, tj. z matki na płód). Dopiero po zdobyciu przyczółka mikroby zyskują zdolność namnażania się przy bramie wejściowej i tworzenia kolonii. Toksyny i enzymy chorobotwórcze gromadzą się w kolonii w ilościach niezbędnych do pokonania bariery nabłonkowej. Proces ten nazywa się kolonizacją. Przez odporność kolonizacyjną rozumie się odporność nabłonka skóry i błon śluzowych na kolonizację przez obce mikroorganizmy. Odporność na kolonizację błon śluzowych zapewnia mucyna, wydzielana przez komórki kubkowe i tworząca na powierzchni złożony biofilm. W tę biowarstwę wbudowane są wszystkie narzędzia ochronne: zamieszkująca mikroflora, substancje bakteriobójcze (lizozym, laktoferyna, toksyczne metabolity tlenu, azotu itp.), Wydzielnicze immunoglobuliny, fagocyty.
Rola normalnej mikroflory(patrz rozdział 4.3). Najważniejszym mechanizmem udziału mikroflory rezydentnej w odporności kolonizacyjnej jest jej zdolność do wytwarzania bakteriocyn (substancji antybiotykopodobnych), krótkołańcuchowych kwasów tłuszczowych, kwasu mlekowego, siarkowodoru i nadtlenku wodoru. Właściwości te mają lakto-, bifidobakterie i bakteroidy.
Dzięki aktywności enzymatycznej bakterii beztlenowych w jelicie kwasy żółciowe ulegają dekoniugacji, tworząc kwas dezoksycholowy, który jest toksyczny dla bakterii chorobotwórczych i oportunistycznych.
Mucyna wraz z polisacharydami wytwarzanymi przez bakterie rezydentne (w szczególności pałeczki kwasu mlekowego) tworzy na powierzchni błon śluzowych wyraźny glikonaliks (biofilm), który skutecznie ekranuje miejsca zrostów i czyni je niedostępnymi dla przypadkowych bakterii. Komórki kubkowe tworzą mieszaninę sialo- i sulfomycyn, których stosunek zmienia się w różnych biotonach. O unikalnym składzie mikroflory w różnych niszach ekologicznych w dużej mierze decyduje ilość i jakość mucyny.
Komórki fagocytarne i produkty ich degranulacji. Makrofagi i neutrofile migrują do biowarstwy śluzowej na powierzchni nabłonka. Wraz z fagocytozą komórki te wydzielają biocyd
produkty zewnętrzne zawarte w ich lizosomach (lizozym, peroksydaza, laktoferyna, defansyny, toksyczne metabolity tlenu i azotu), które zwiększają właściwości przeciwdrobnoustrojowe wydzielin.
Czynniki chemiczne i mechaniczne. W odporności nabłonka powłokowego błon śluzowych ważną rolę odgrywają wydzieliny o wyraźnych właściwościach biobójczych i antyadhezyjnych: łzy, ślina, sok żołądkowy, enzymy i kwasy żółciowe jelita cienkiego, wydzielina szyjki macicy i pochwy żeński układ rozrodczy.
Dzięki ukierunkowanym ruchom - perystaltyce mięśni gładkich jelit, rzęskom nabłonka rzęskowego w drogach oddechowych, moczu w układ moczowy- powstałe wydzieliny wraz z zawartymi w nich mikroorganizmami przemieszczają się w kierunku wyjścia i są wyprowadzane.
Odporność błon śluzowych na kolonizację wzmacniają wydzielnicze immunoglobuliny A, syntetyzowane przez tkankę limfatyczną związaną ze śluzem.
Nabłonek powłokowy błony śluzowej ulega ciągłej regeneracji dzięki komórkom macierzystym zlokalizowanym w grubości błon śluzowych. W jelicie funkcję tę pełnią komórki krypt, w których wraz z komórkami macierzystymi zlokalizowane są komórki Panetha – specjalne komórki syntetyzujące białka antybakteryjne (lizozym, peptydy kationowe). Białka te chronią nie tylko komórki macierzyste, ale także komórki nabłonka powłokowego. W przypadku zapalenia ściany błony śluzowej wzrasta produkcja tych białek.
Odporność kolonizacyjną nabłonka powłokowego zapewnia cały zespół mechanizmów ochronnych odporności wrodzonej i nabytej (immunoglobuliny wydzielnicze) i stanowi podstawę odporności organizmu na większość mikroorganizmów bytujących w otoczenie zewnętrzne. Brak specyficznych receptorów dla niektórych mikroorganizmów na komórkach nabłonkowych wydaje się być podstawowym mechanizmem oporności genetycznej zwierząt jednego gatunku na drobnoustroje chorobotwórcze dla zwierząt innego gatunku.
9.2.2. Czynniki komórkowe
Neutrofile i makrofagi. Zdolność do endocytozy (absorpcji cząstek z utworzeniem wakuoli wewnątrzkomórkowej) jest
wytwarzany przez wszystkie komórki eukariotyczne. W ten sposób wiele patogennych mikroorganizmów przenika do komórek. Jednak w większości zakażonych komórek nie ma mechanizmów (lub są one słabe), które zapewniają zniszczenie patogenu. W procesie ewolucji w ciele organizmów wielokomórkowych powstały wyspecjalizowane komórki z potężnymi wewnątrzkomórkowymi systemami zabijania, których głównym „zajęciem” jest fagocytoza (z greckiego. fagos- Pożeram, cytozy- komórka) - absorpcja cząstek o średnicy co najmniej 0,1 mikrona (w przeciwieństwie do pinocytozy - absorpcja cząstek o mniejszej średnicy i makrocząsteczek) i zniszczenie wychwyconych drobnoustrojów. Takie właściwości mają leukocyty wielojądrzaste (głównie neutrofile) i fagocyty jednojądrzaste (komórki te czasami nazywane są fagocytami zawodowymi).
Po raz pierwszy pomysł rolę ochronną komórki ruchliwe (mikro- i makrofagi) sformułował w 1883 roku I.I. Miecznikowa, który w 1909 r. otrzymał Nagrodę Nobla za stworzenie komórkowo-humoralnej teorii odporności (we współpracy z P. Ehrlichem).
Neutrofile i fagocyty jednojądrzaste mają wspólne pochodzenie szpikowe z krwiotwórczych komórek macierzystych. Komórki te różnią się jednak wieloma właściwościami.
Neutrofile są najliczniejszą i najbardziej mobilną populacją fagocytów, których dojrzewanie rozpoczyna się i kończy w szpiku kostnym. Około 70% wszystkich neutrofili magazynuje się jako rezerwę w szpiku kostnym, skąd pod wpływem odpowiednich bodźców (cytokiny prozapalne, produkty pochodzenia mikrobiologicznego, składnik dopełniacza C5a, czynniki stymulujące kolonie, kortykosteroidy, katecholaminy) mogą pilnie przedostać się przez krew do miejsca zniszczenia tkanki i uczestniczyć w rozwoju ostrej odpowiedzi zapalnej. Neutrofile stanowią „zespół szybkiego reagowania” w systemie obrony przeciwdrobnoustrojowej.
Neutrofile są komórkami krótkotrwałymi, ich żywotność wynosi około 15 dni. Ze szpiku kostnego przedostają się do krwioobiegu jako dojrzałe komórki, które utraciły zdolność różnicowania i proliferacji. Z krwi neutrofile przemieszczają się do tkanek, gdzie albo umierają, albo wychodzą na powierzchnię błon śluzowych, gdzie kończą swój cykl życiowy.
Fagocyty jednojądrzaste są reprezentowane przez promonocyty szpiku kostnego, monocyty krwi i makrofagi tkankowe. Monocyty, w przeciwieństwie do neutrofili, są niedojrzałymi komórkami, które po wejściu krwiobieg i dalej w tkance dojrzewają do makrofagów tkankowych (opłucnej i otrzewnej, komórek Kupffera wątroby, pęcherzyków płucnych, komórek międzypalcowych węzłów chłonnych, szpiku kostnego, osteoklastów, mikrogliocytów, komórek mezangialnych nerek, komórek Sertoliego jąder, Langerhansa i komórki Greensteina skóry). Żywotność fagocytów jednojądrzastych wynosi od 40 do 60 dni. Makrofagi nie są komórkami bardzo szybkimi, ale są rozproszone po wszystkich tkankach i w przeciwieństwie do neutrofili nie potrzebują tak pilnej mobilizacji. Jeśli będziemy kontynuować analogię z neutrofilami, wówczas makrofagi we wrodzonym układzie odpornościowym są „siłami specjalnymi”.
Ważną cechą neutrofili i makrofagów jest obecność w ich cytoplazmie dużej liczby lizosomów - granulek o wielkości 200-500 nm zawierających różne enzymy, produkty bakteriobójcze i biologicznie aktywne (lizozym, mieloperoksydaza, defensyny, białko bakteriobójcze, laktoferyna, proteinazy, katepsyny, kolagenaza itp.). d.). Dzięki tak różnorodnej „broni” fagocyty mają potężny potencjał destrukcyjny i regulacyjny.
Neutrofile i makrofagi są wrażliwe na wszelkie zmiany w homeostazie. W tym celu są wyposażone w bogaty arsenał receptorów zlokalizowanych na ich błonie cytoplazmatycznej (ryc. 9.2):
Receptory rozpoznania obcego - Receptory Toll-podobne (Receptor Toll-podobny- TLR), po raz pierwszy odkryty przez A. Poltoraka w 1998 r. u muszki owocowej, a następnie znaleziony w neutrofilach, makrofagach i komórkach dendrytycznych. Znaczenie odkrycia receptorów Toll-podobnych jest porównywalne z wcześniejszym odkryciem receptorów rozpoznających antygen w limfocytach. Receptory Toll-podobne rozpoznają nie antygeny, których różnorodność w przyrodzie jest niezwykle duża (około 10 18 wariantów), ale grubsze, powtarzające się molekularne wzorce węglowodanów i lipidów - struktury wzorców (z ang. wzór- wzór), które nie znajdują się na komórkach organizmu żywiciela, ale są obecne u pierwotniaków, grzybów, bakterii, wirusów. Repertuar takich wzorów jest niewielki i wynosi około 20
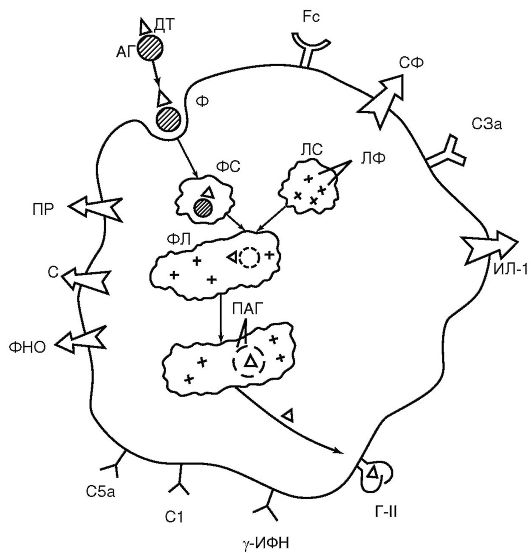 Ryż. 9.2. Struktury funkcjonalne makrofaga (schemat): AG - antygen; DT – determinant antygenowy; FS - fagosom; LS - lizosom; LF - enzymy lizosomalne; PL - fagolizosom; PAG - antygen przetworzony; G-II - antygen zgodności tkankowej klasy II (MHC II); Fc - receptor dla fragmentu Fc cząsteczki immunoglobuliny; C1, C3a, C5a - receptory składników dopełniacza; γ-IFN – receptor dla γ-MFN; C - wydzielanie składników dopełniacza; PR - wydzielanie rodników nadtlenkowych; ILD-1 – wydzielanie; TNF – wydzielanie czynnika martwicy nowotworu; SF - wydzielanie enzymów
Ryż. 9.2. Struktury funkcjonalne makrofaga (schemat): AG - antygen; DT – determinant antygenowy; FS - fagosom; LS - lizosom; LF - enzymy lizosomalne; PL - fagolizosom; PAG - antygen przetworzony; G-II - antygen zgodności tkankowej klasy II (MHC II); Fc - receptor dla fragmentu Fc cząsteczki immunoglobuliny; C1, C3a, C5a - receptory składników dopełniacza; γ-IFN – receptor dla γ-MFN; C - wydzielanie składników dopełniacza; PR - wydzielanie rodników nadtlenkowych; ILD-1 – wydzielanie; TNF – wydzielanie czynnika martwicy nowotworu; SF - wydzielanie enzymów
szaleńcy. Myto Receptory podobne to rodzina glikoprotein błonowych; znanych jest 11 typów takich receptorów, zdolnych do rozpoznawania całej palety wzór-struktury mikroorganizmów (lipopolisacharydy, gliko-, lipoproteiny-
ys, kwasy nukleinowe, białka szok termiczny itp.). Oddziaływanie receptorów Toll-like z odpowiednimi ligandami powoduje transkrypcję genów dla cytokin prozapalnych i cząsteczek kostymulujących, które są niezbędne do migracji, adhezji komórek, fagocytozy i prezentacji antygenów limfocytom;
Receptory mannozowo-fukozowe rozpoznające składniki węglowodanowe struktur powierzchniowych mikroorganizmów;
Receptory śmieci (receptor zmiatający)- do wiązania błon fosfolipidowych i składników własnych zniszczonych komórek. Uczestniczyć w fagocytozie uszkodzonych i umierających komórek;
Receptory dla składników dopełniacza C3b i C4b;
Receptory dla fragmentów Fc IgG. Receptory te, podobnie jak receptory składników dopełniacza, odgrywają ważną rolę w wiązaniu kompleksów immunologicznych i fagocytozie bakterii znakowanych immunoglobulinami i dopełniaczem (efekt opsonizacji);
Receptory cytokin, chemokin, hormonów, leukotrienów, prostaglandyn itp. pozwalają na interakcję z limfocytami i reagowanie na wszelkie zmiany w środowisku wewnętrznym organizmu.
Główną funkcją neutrofili i makrofagów jest fagocytoza. Fagocytoza to proces wchłaniania cząstek lub dużych kompleksów makromolekularnych przez komórkę. Składa się z kilku kolejnych etapów:
Aktywacja i chemotaksja - ukierunkowany ruch komórki w kierunku obiektu fagocytozy w kierunku rosnącego stężenia chemoatraktantów, których rolę odgrywają chemokiny, składniki dopełniacza i komórki drobnoustrojów, produkty degradacji tkanek organizmu;
Adhezja (przyczepianie) cząstek do powierzchni fagocytu. W adhezji ważną rolę odgrywają receptory Toll-podobne, a także receptory fragmentu Fc immunoglobuliny i składnika C3b dopełniacza (ta fagocytoza nazywana jest immunologią). Immunoglobuliny M, G, C3b-, C4b-składniki dopełniacza zwiększają adhezję (są opsoninami) i służą jako pomost pomiędzy komórką drobnoustroju a fagocytem;
Absorpcja cząstek, ich zanurzenie w cytoplazmie i utworzenie wakuoli (fagosomu);
Zabijanie wewnątrzkomórkowe (zabijanie) i trawienie. Po wchłonięciu cząsteczki fagosomu łączą się z lizosomami - powstaje fagolizosom, w którym bakterie giną pod wpływem produktów bakteriobójczych granulek (układ bakteriobójczy niezależny od tlenu). Jednocześnie wzrasta zużycie tlenu i glukozy w komórce - rozwija się tzw. Eksplozja oddechowa (oksydacyjna), która prowadzi do powstania toksycznych metabolitów tlenu i azotu (H 2 O 2, anion ponadtlenkowy O 2, kwas podchlorawy, piroksyazotyn), które mają silne działanie bakteriobójcze (układ bakteriobójczy zależny od tlenu). Nie wszystkie mikroorganizmy są wrażliwe na bakteriobójcze układy fagocytów. Gonokoki, paciorkowce, prątki i inne przeżywają po kontakcie z fagocytami, taką fagocytozę nazywa się niepełną.
Fagocyty, oprócz fagocytozy (endocytozy), mogą przeprowadzać swoje reakcje cytotoksyczne poprzez egzocytozę - uwalniając swoje granulki na zewnątrz (degranulacja) - w ten sposób fagocyty dokonują pozakomórkowego zabijania. Neutrofile w odróżnieniu od makrofagów potrafią tworzyć pozakomórkowe pułapki bakteriobójcze – w procesie aktywacji komórka wyrzuca nici DNA, w których znajdują się ziarnistości z enzymami bakteriobójczymi. Ze względu na lepkość DNA bakterie przyczepiają się do pułapek i są zabijane przez enzym.
Neutrofile i makrofagi są najważniejszym składnikiem odporności wrodzonej, ale ich rola w ochronie przed różnymi drobnoustrojami jest inna. Neutrofile są skuteczne przeciwko infekcjom wywołanym przez patogeny zewnątrzkomórkowe ( ziarniaki ropne, enterobakterie itp.), które indukują rozwój ostrej odpowiedzi zapalnej. W przypadku takich infekcji skuteczna jest współpraca neutrofili, dopełniacza i przeciwciał. Makrofagi chronią przed patogenami wewnątrzkomórkowymi (prątkami, riketsjami, chlamydiami itp.), które powodują rozwój przewlekłego zapalenia ziarniniakowego, w którym główną rolę odgrywa współpraca makrofagów z limfocytami T.
Oprócz udziału w obronie przeciwdrobnoustrojowej, fagocyty biorą udział w usuwaniu obumierających, starych komórek i produktów ich rozkładu, cząstek nieorganicznych (węgiel, pył mineralny itp.) z organizmu. Fagocyty (zwłaszcza makrofagi) przygotowują antygen
składników, pełnią funkcję wydzielniczą, syntetyzują i wydzielają szeroki zasięg związki biologicznie czynne: cytokiny (interleukiny-1, 6, 8, 12, czynnik martwicy nowotworu), prostaglandyny, leukotrieny, interferony α i γ. Dzięki tym mediatorom fagocyty aktywnie uczestniczą w utrzymaniu homeostazy, procesach zapalnych, nabytej odpowiedzi immunologicznej i regeneracji.
Eozynofile należą do leukocytów wielojądrzastych. Różnią się od neutrofili tym, że mają słabą aktywność fagocytarną. Eozynofile spożywają niektóre bakterie, ale ich zabijanie wewnątrzkomórkowe jest mniej skuteczne niż w przypadku neutrofili.
Naturalni zabójcy. Komórki NK to duże komórki podobne do limfocytów, które powstają z prekursorów limfoidalnych. Występują we krwi i tkankach, zwłaszcza w wątrobie, błonie śluzowej żeńskiego układu rozrodczego i śledzionie. Komórki NK, takie jak fagocyty, zawierają lizosomy, ale nie wykazują aktywności fagocytarnej.
Komórki NK rozpoznają i eliminują komórki docelowe, które mają zmienione markery charakterystyczne dla zdrowych komórek lub ich brak. Wiadomo, że dzieje się tak głównie w przypadku komórek zmutowanych lub zakażonych wirusem. Dlatego komórki NK odgrywają ważną rolę w nadzorze przeciwnowotworowym, czyli niszczeniu komórek zakażonych wirusami. Komórki NK wywierają swój efekt cytotoksyczny za pomocą specjalnego białka, perforyny, które podobnie jak kompleks dopełniacza atakującego błonę tworzy pory w błonach komórek docelowych.
9.2.3. Czynniki humoralne
System uzupełniający. Układ dopełniacza jest wieloskładnikowym, wieloenzymatycznym układem samoorganizującym się białek surowicy, które normalnie znajdują się w stanie nieaktywnym. Kiedy w środowisku wewnętrznym pojawiają się produkty mikrobiologiczne, uruchamiany jest proces zwany aktywacją dopełniacza. Aktywacja następuje w formie reakcji kaskadowej, gdy każdy poprzedni element systemu aktywuje następny. Podczas samoorganizacji układu powstają aktywne produkty rozkładu białek, które pełnią trzy ważne funkcje: powodują perforację błony komórkowej i lizę komórek, zapewniają opsonizację mikroorganizmów w celu ich dalszej fagocytozy oraz inicjują rozwój reakcji zapalnych naczyń.
Dopełnienie zwane „aleksyną” zostało opisane w 1899 roku przez francuskiego mikrobiologa J. Bordeta, a następnie nazwane dopełnieniem przez niemieckiego mikrobiologa P. Ehrlicha (komplement- dodatek) jako czynnik dodatkowy do przeciwciał powodujących lizę komórek.
Układ dopełniacza obejmuje 9 głównych białek (oznaczonych jako C1, C2-C9), a także podskładniki - produkty rozkładu tych białek (Clg, C3b, C3a itp.), Inhibitory.
Kluczowym wydarzeniem dla układu dopełniacza jest jego aktywacja. Może zachodzić na trzy sposoby: klasyczny, lektynowy i alternatywny (ryc. 9.3).
Klasyczny sposób. W szlaku klasycznym czynnikiem aktywującym są kompleksy antygen-przeciwciało. W tym przypadku fragment Fc i IgG kompleksów immunologicznych są aktywowane przez podskładnik Cr, Cr jest rozszczepiany z wytworzeniem Cls, który hydrolizuje C4, który jest rozszczepiany na C4a (anafilotoksynę) i C4b. C4b aktywuje C2, który z kolei aktywuje komponent C3 (kluczowy komponent systemu). Składnik C3 jest rozszczepiany na anafilotoksynę C3a i opsoninę C3b. Aktywacji składnika C5 dopełniacza towarzyszy także utworzenie dwóch aktywnych fragmentów białkowych: C5a – anafilotoksyny, chemoatraktanta dla neutrofili i C5b – aktywującego składnik C6. W efekcie powstaje kompleks C5, b, 7, 8, 9, który nazywany jest atakiem błonowym. Końcową fazą aktywacji dopełniacza jest utworzenie w komórce poru transbłonowego i uwolnienie jego zawartości na zewnątrz. W rezultacie komórka pęcznieje i ulega lizie.
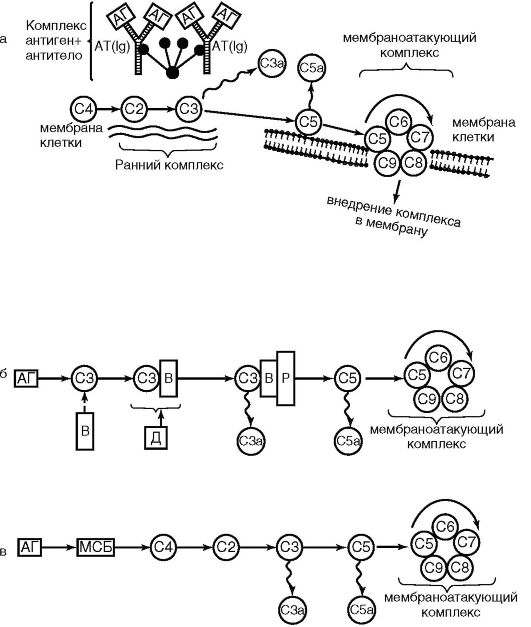 Ryż. 9.3.Ścieżki aktywacji dopełniacza: klasyczne (a); alternatywa (b); lektyna (c); C1-C9 – składniki dopełniacza; AG - antygen; AT - przeciwciało; ViD - białka; P - właściwa; MBP – białko wiążące mannozę
Ryż. 9.3.Ścieżki aktywacji dopełniacza: klasyczne (a); alternatywa (b); lektyna (c); C1-C9 – składniki dopełniacza; AG - antygen; AT - przeciwciało; ViD - białka; P - właściwa; MBP – białko wiążące mannozę
Szlak lektynowy. Pod wieloma względami przypomina ten klasyczny. Jedyna różnica polega na tym, że na szlaku lektynowym jedno z białek ostrej fazy, lektyna wiążąca mannozę, oddziałuje z mannozą na powierzchni komórek drobnoustrojów (prototyp kompleksu antygen-przeciwciało) i kompleks ten aktywuje C4 i C2.
Alternatywny sposób. Zachodzi bez udziału przeciwciał i omija pierwsze 3 składniki C1-C4-C2. Alternatywny szlak inicjowany jest przez składniki ściany komórkowej bakterii Gram-ujemnych (lipopolisacharydy, peptydoglikany), wirusy, które wiążą się sekwencyjnie z białkami P (properdyna), B i D. Kompleksy te bezpośrednio przekształcają składnik C3.
Złożona reakcja kaskadowa dopełniacza zachodzi tylko w obecności jonów Ca i Mg.
Efekty biologiczne produktów aktywacji dopełniacza:
Niezależnie od ścieżki aktywacja dopełniacza kończy się utworzeniem kompleksu atakującego błonę (C5, b, 7, 8, 9) i lizą komórek (bakterii, erytrocytów i innych komórek);
Powstałe składniki C3a, C4a i C5a są anafilotoksynami, wiążą się z receptorami bazofilów krwi i tkanek, wywołując ich degranulację – uwolnienie histaminy, serotoniny i innych mediatorów wazoaktywnych (mediatorów odpowiedzi zapalnej). Ponadto C5a jest chemoatraktantem dla fagocytów, przyciąga te komórki do miejsca zapalenia;
C3b, C4b są opsoninami, zwiększają adhezję kompleksów immunologicznych do błon makrofagów, neutrofili, erytrocytów i tym samym wzmagają fagocytozę.
Rozpuszczalne receptory patogenów. Są to białka krwi, które bezpośrednio wiążą się z różnymi konserwatywnymi, powtarzającymi się strukturami węglowodanowymi lub lipidowymi komórki drobnoustroju ( wzór-Struktury). Białka te mają właściwości opsoniczne, niektóre z nich aktywują dopełniacz.
Główną częścią rozpuszczalnych receptorów są białka ostrej fazy. Stężenie tych białek we krwi gwałtownie wzrasta w odpowiedzi na rozwój stanu zapalnego na skutek infekcji lub uszkodzenia tkanek. Białka ostrej fazy obejmują:
Białko C-reaktywne (stanowi większość białek ostrej fazy), które otrzymało swoją nazwę ze względu na swoje zdolności
wiążą się z fosforylocholiną (C-polisacharydem) pneumokoków. Tworzenie kompleksu CRP-fosforylocholina sprzyja fagocytozie bakteryjnej, ponieważ kompleks wiąże się z Clg i aktywuje klasyczny szlak dopełniacza. Białko jest syntetyzowane w wątrobie, a jego stężenie szybko wzrasta w odpowiedzi na interleukinę-b;
Amyloid P w surowicy ma podobną strukturę i funkcję do białka C-reaktywnego;
Lektyna wiążąca mannozę aktywuje dopełniacz poprzez szlak lektynowy i jest jednym z przedstawicieli białek kolektyny serwatkowej, które rozpoznają reszty węglowodanowe i działają jako opsoniny. Syntetyzowany w wątrobie;
Białka surfaktantów płuc również należą do rodziny kolektyn. Mają właściwości opsoniczne, szczególnie przeciwko grzybom jednokomórkowym Pneumocystis carinii;
Kolejną grupą białek ostrej fazy są białka wiążące żelazo - transferyna, haptoglobina, hemopeksyna. Takie białka zapobiegają namnażaniu się bakterii wymagających tego pierwiastka.
Peptydy przeciwdrobnoustrojowe. Jednym z takich peptydów jest lizozym. Lizozym jest enzymem muromidazą o masie cząsteczkowej 14 000-16 000, który powoduje hydrolizę mureiny (peptydoglikanu) ściany komórkowej bakterii i ich lizę. Otwarty w 1909 roku przez P.L. Laszczenkow, wyizolowany w 1922 r. przez A. Fleminga.
Lizozym występuje we wszystkich płynach biologicznych: surowicy krwi, ślinie, łzach, mleku. Jest wytwarzany przez neutrofile i makrofagi (zawarte w ich ziarnistościach). Lizozym ma większy wpływ na bakterie Gram-dodatnie, których podstawą ściany komórkowej jest peptydoglikan. Ściany komórkowe bakterii Gram-ujemnych mogą również zostać uszkodzone przez lizozym, jeśli zostały wcześniej wystawione na działanie kompleksu atakującego błonę układu dopełniacza.
Defensyny i katelicydyny to peptydy o działaniu przeciwdrobnoustrojowym. Tworzą je komórki wielu eukariontów i zawierają 13-18 reszt aminokwasowych. Do chwili obecnej znanych jest około 500 takich peptydów. U ssaków peptydy bakteriobójcze należą do rodzin defensyn i katelicydyn. Ziarnistości ludzkich makrofagów i neutrofili zawierają α-defensyny. Są również syntetyzowane przez komórki nabłonkowe jelit, płuc i pęcherza moczowego.
Rodzina interferonów. Interferon (IFN) został odkryty w 1957 roku przez A. Isaacsa i J. Lindemana podczas badań interferencji wirusów (od łac. pochować- między, fereny- przewoźnik). Interferencja to zjawisko, w wyniku którego tkanki zakażone jednym wirusem stają się odporne na zakażenie innym wirusem. Stwierdzono, że taka oporność jest związana z wytwarzaniem przez zakażone komórki specjalnego białka, które nazwano interferonem.
Obecnie interferony są dobrze zbadane. Są rodziną glikoprotein o masie cząsteczkowej od 15 000 do 70 000. W zależności od źródła produkcji białka te dzielą się na interferony typu I i typu II.
Do typu I zalicza się IFN α i β, które są produkowane przez komórki zakażone wirusem: IFN-α przez leukocyty, IFN-β przez fibroblasty. W ostatnich latach opisano trzy nowe interferony: IFN-τ/ε (IFN pochodzący z trofoblastu), IFN-λ i IFN-K. IFN-α i β biorą udział w obronie przeciwwirusowej.
Mechanizm działania IFN-α i β nie jest powiązany z bezpośrednim działaniem na wirusy. Jest ona spowodowana aktywacją w komórce szeregu genów blokujących reprodukcję wirusa. Kluczowym ogniwem jest indukcja syntezy kinazy białkowej R, która zakłóca translację wirusowego mRNA i wyzwala apoptozę zakażonych komórek poprzez reakcje zależne od Bc1-2 i kaspazy. Innym mechanizmem jest aktywacja utajonej endonukleazy RNA, która powoduje zniszczenie wirusowego kwasu nukleinowego.
Typ II obejmuje interferon γ. Jest wytwarzany przez limfocyty T i komórki NK po stymulacji antygenowej.
Interferon jest stale syntetyzowany przez komórki, a jego stężenie we krwi zwykle niewiele się zmienia. Jednakże produkcja IF wzrasta w przypadku zakażenia komórek wirusami lub w wyniku działania jego induktorów – interferonogenów (wirusowego RNA, DNA, złożonych polimerów).
Obecnie szeroko stosowane są interferony (zarówno leukocytowe, jak i rekombinowane) oraz interferonogeny. praktyka kliniczna do zapobiegania i leczenia ostrych infekcji wirusowych (grypa), a także do celów terapeutycznych w chorobach przewlekłych infekcje wirusowe(wirusowe zapalenie wątroby typu B, C, opryszczka, stwardnienie rozsiane itp.). Ponieważ interferony mają nie tylko działanie przeciwwirusowe, ale także przeciwnowotworowe, stosuje się je również w leczeniu raka.
9.2.4. Cechy odporności wrodzonej i nabytej
Obecnie czynniki odporności wrodzonej nie są zwykle nazywane niespecyficznymi. Mechanizmy barierowe odporności wrodzonej i nabytej różnią się jedynie dokładnością dostrojenia do „obcego”. Fagocyty i rozpuszczalne receptory odporności wrodzonej rozpoznają „wzorce”, a limfocyty rozpoznają szczegóły takiego obrazu. Odporność wrodzona to ewolucyjnie starsza metoda obrony, nieodłączna niemal wszystkim żywym istotom, od organizmów wielokomórkowych, roślin po ssaki, ze względu na szybkość reakcji na inwazję obcego czynnika; stanowi podstawę odporności na infekcje i chroni organizm od większości drobnoustrojów chorobotwórczych. Jedynie te patogeny, z którymi nie radzą sobie czynniki odporności wrodzonej, to odporność limfocytowa.
Podział mechanizmów obrony przeciwdrobnoustrojowej na wrodzone i nabyte lub przedimmunologiczne i odpornościowe (wg R.M. Khaitov, 200b) jest warunkowy, gdyż jeśli rozpatrzymy proces odpornościowy w czasie, to oba są ogniwami tego samego łańcucha: po pierwsze, fagocyty i rozpuszczalne receptory dla wzór- struktury mikrobiologiczne, bez takiej edycji dalszy rozwój odpowiedzi limfocytowej jest niemożliwy, po czym limfocyty ponownie przyciągają fagocyty jako komórki efektorowe w celu zniszczenia patogenów.
Jednocześnie dla lepszego zrozumienia tego złożonego zjawiska wskazany jest podział odporności na wrodzoną i nabytą (tab. 9.2). Mechanizmy wrodzonej odporności zapewniają szybką ochronę, po czym organizm buduje silniejszą, warstwową obronę.
Tabela 9.2. Cechy odporności wrodzonej i nabytej
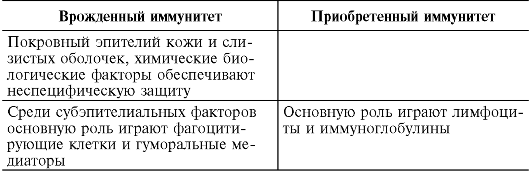 Koniec stołu. 9.2
Koniec stołu. 9.2
 Zadania do samodzielnego przygotowania (samokontroli)
Zadania do samodzielnego przygotowania (samokontroli)
Wiele substancji i infekcji (mikroorganizmów, wirusów) dostających się do organizmu powoduje choroby. Niebezpieczni są także wewnętrzni wrogowie organizmu – jego martwe komórki, nowotworowe lub zakażone wirusami. Jednak nasz organizm jest w stanie chronić się przed zewnętrznymi i wewnętrznymi czynnikami obcymi. Ta zdolność nazywa się odpornością. Odporność zapewnia układ odpornościowy organizmu. jego składnikami są leukocyty i narządy, w których się rozmnażają i specjalizują (dojrzewają). To jest czerwony szpik kostny grasica(grasica), śledziona, Węzły chłonne oraz tkanki limfatyczne zlokalizowane w układzie pokarmowym, oddechowym i moczowym. Wszystkie leukocyty powstają w szpiku kostnym i dojrzewają w różnych narządach. Z nich leukocyty krążą wraz z krwią i limfą i dostają się do tkanek.
Leukocyty obejmują kilka typów komórek różnych konstrukcji(limfocyty, monocyty, eozynofile itp.). Limfocyty dzielą się na limfocyty T (dojrzałe w grasicy) i limfocyty B (dojrzałe w szpiku kostnym).
Znacząca liczba leukocytów różne rodzaje(53-81%) są zdolne do fagocytozy. Więcej fagocytów znajduje się w tkanki łączne nerki, płuca, wątroba, skóra.
Nieswoista odporność wrodzona
Skóra i błony śluzowe uniemożliwiają przedostanie się obcych osób do organizmu. Złuszczanie martwych komórek nabłonka skóry i ruch kosmków błony śluzowej usuwają je i niszczą substancje bakteriobójcze wydzieliny potu i gruczołów łojowych, śluzu nabłonkowego itp.
Jeśli obce czynniki dostaną się do organizmu, fagocyty są do nich wysyłane i niszczą agresorów. W przypadku penetracji duża ilość obcy lub masowa śmierć fagocytów w walce z nimi, szpik kostny przyspiesza reprodukcję takich komórek i stają się dostępne nowe siły do walki. Tak to działa odporność komórkowa. Jest to ściśle powiązane z humoralnymi czynnikami odporności – pewnymi białkami, które są stale obecne we krwi. Niektóre białka przyczepiają się do błony mikroorganizmu, wskazując na obecność obcego - ułatwia to fagocytozę. Inne biorą udział w niszczeniu obcej błony komórkowej. Interferony białek osocza krwi pomagają organizmowi zwalczać wirusy.
Fagocyty I
Fagocyty I humoralne czynniki odporności które działają w pierwszej fazie walki, wpływają jednakowo na wszystkich agresorów. Te metody ochrony są dziedziczone, tj. wrodzony. Dlatego taką odporność nazywa się nieswoistą wrodzoną.
Specyficzna odporność nabyta. Organizm nie zawsze jest w stanie poradzić sobie z obcymi czynnikami bez pomocy odporność swoista. W związku z tym stosuje inne metody - takie, które działają na agresorów zgodnie z ich charakterystyką. W tych specyficznych reakcjach organizmu wyróżnia się także dwie części - humoralną i komórkową. Odporność humoralna jest realizowana przez limfocyty B, a odporność komórkowa przez limfocyty T.
Czynniki humoralne
Czynniki humoralne specyficzne reakcje odpornościowe przeciwciała - białka immunoglobulinowe. są produkowane przez limfocyty B w odpowiedzi na antygeny – substancje, które organizm postrzega jako obce. Zwykle są to określone białka znajdujące się w otoczkach agresorów lub wytwarzane przez nich toksyny. Limfocyty B reagują na każdy antygen wytwarzając przeciwciało, które specyficznie odpowiada temu antygenowi. Białka te łączą się z antygenem i tworzą kompleksy antygen-przeciwciało – następuje neutralizacja zarówno antygenu, jak i agresora.
Łącze komórkowe
Łącze komórkowe immunitet swoisty inaczej niszczy cudzoziemców. W ten sposób limfocyty T mogą przyłączać się do błon komórek dotkniętych wirusem lub bakterią i niszczyć je.
Konsekwencje destrukcyjne zajęcia Limfocyty T są eliminowane przez fagocyty, które pożerają zneutralizowanych agresorów i martwe komórki.
Limfocyty krążące we krwi i przepływie limfy ulegają aktywacji dopiero wtedy, gdy rozpoznają antygen. Ich identyfikacja antygenu, który jako pierwszy dostał się do organizmu człowieka, jest złożonym procesem, który może trwać do 14 dni. Jego konsekwencją jest odpowiedź immunologiczna, która zwykle obejmuje Limfocyty T i B. Limfocyty B rozpoznają antygen i zaczynają syntetyzować przeciwko niemu przeciwciała. Jednocześnie limfocyty B, które są również wrażliwe na ten antygen, rozmnażają się w narządach układu odpornościowego. Część z nich przyłącza się do ataku humoralnego, wytwarzając przeciwciała z ogromną szybkością (do 30 000 cząsteczek na sekundę). Inne limfocyty B stają się komórkami pamięci. Limfocyty T kontrolują odpowiedź immunologiczną poprzez wytwarzanie różnych interleukin. Interleukiny mogą zwiększać lub zmniejszać aktywność limfocytów B, stymulować proliferację limfocytów T i powstawanie komórek T pamięci lub tłumić te procesy.
Komórki pamięci
Komórki pamięci przez miesiące, a czasem i lata, zachowują zdolność reagowania na inwazję „znanego” antygenu. Nie tracą czasu na rozpoznanie tego, odpowiedź immunologiczna pojawia się natychmiast i wytwarza się więcej przeciwciał. W ten sposób powstaje specyficzna odporność nabyta.
Odpowiedź immunologiczna
Odpowiedź immunologiczna przy pierwszym spotkaniu z infekcją zwykle towarzyszy Czuję się niedobrze osoba, gorączka itp. Jeśli dana osoba nabyła odporność na tę infekcję, nie obserwuje się objawów choroby.
Sztuczna odporność nabyta. Istnieją infekcje, z którymi pierwsze spotkanie może być śmiertelne dla człowieka. Aby wytworzyć przeciwko nim odporność, są szczepieni - szczepionka jest wprowadzana do organizmu ludzkiego. Jest to niewielka ilość zabitych lub osłabionych patogenów lub substancji będących produktami ich życiowej aktywności. Taka infekcja nie prowadzi do choroby. Jednak po podaniu szczepionki rozwija się pełnoprawna reakcja immunologiczna: wytwarzane są przeciwciała specyficzne dla tego patogenu i powstają komórki pamięci. Dlatego po szczepieniu organizm napotyka żywe patogeny, atakując w pełni uzbrojony. W ten sposób poprzez wprowadzenie szczepionek powstaje sztuczna odporność nabyta.


