Insulina Lantus jest lekiem hipoglikemicznym, którego stosowanie jest przepisywane osobom insulinozależnym - w tym celu pacjent musi przejść wszystkie niezbędne badania, aby postawić konkretną diagnozę. Ten lek z substancją czynną glargine może być stosowany nie tylko przez osobę dorosłą, ale także przez dziecko od 6 lat.
Co to jest insulina
Jeśli lekarz przepisał lekarstwo, takie jak strzykawka Lantus, dobrze byłoby zacząć od poznania, o co chodzi w insulinie. Tak więc insulina jest hormonem peptydowym wytwarzanym przez trzustkę, ma duży wpływ na metabolizm w prawie wszystkich tkankach ludzkiego organizmu. Ale głównym wyzwaniem jest obniżenie stężenia glukozy we krwi.
Ze względu na powolne wchłanianie po wstrzyknięciu leku Lantus pod skórę lek ten można stosować raz dziennie (czasami nazywane jest to przedłużonym uwalnianiem). Główną funkcją jest regulacja metabolizmu węglowodanów, tj. metabolizm glukozy. Glargine wchodząca w skład leku wchłania się wolniej niż insulina NPH, w wyniku czego nie powstaje szczyt aktywności, który z reguły następuje bezpośrednio po wstrzyknięciu.
Insulina - forma uwalniania
Insulina długo działająca jest produkowana w postaci wstrzykiwacza Lantus. Roztwór do kursów wstrzyknięć jest dostarczany w specjalnym wkładzie zawierającym 3 ml tego produktu. Jeden blister zawiera 5 takich wkładów. 1 ml roztworu zawiera 3,6378 mg (co odpowiada 100 j.) Insuliny glargine i kilka dodatkowych składników.
Zaleca się przechowywanie leku nie dłużej niż 3 lata po wyprodukowaniu. Do normalnej zawartości Lantusa potrzebujesz lodówki o temperaturze 2-8 stopni. Okres trwałości w godz warunki temperaturowe od 15 do 25 stopni zmniejsza się do 4 tygodni. Zabrania się zamrażania roztworu! Kupując lek, nie leń się, aby sprawdzić aktualną datę ważności, aby nie zaszkodzić własnemu zdrowiu.
Lantus - instrukcje użytkowania
Produkt leczniczy jest przeznaczony wyłącznie do wstrzyknięć podskórnych i dlatego nie wolno go podawać dożylnie. Długi (przedłużony) okres działania wynika z faktu, że insulina Lantus jest wstrzykiwana do podskórnej tkanki tłuszczowej. Zaleca się, aby przy każdym wstrzyknięciu zmieniać miejsce wstrzyknięcia w zalecanych obszarach lokalnych. Podanie dożylne może prowadzić do różnych zaburzeń i rozwoju ciężkiej hipoglikemii. Podczas terapii Lantus pacjent musi prowadzić określony tryb życia.
Przed wprowadzeniem należy dokładnie zapoznać się z instrukcją dołączoną do wstrzykiwacza, aby dokładnie przestrzegać zaleceń producenta. Jeśli wstrzykiwacz strzykawki lub jego igła są w wadliwym stanie, konieczne jest użycie nowego produktu. Przed zamocowaniem wkładu w strzykawce pacjent musi przez kilka godzin przechowywać roztwór w temperaturze pokojowej. Należy używać wyłącznie wkładów, w których roztwór leku jest wolny od zmętnienia, przebarwień i osadu.
Przed użyciem wkładu konieczne jest usunięcie wszystkich pęcherzyków powietrza - jest to jasno określone w instrukcji. Nie należy zapominać, że ponowne napełnianie zużytych wkładów jest zabronione, a produkt sprzedawany jest wyłącznie na podstawie recepty lekarskiej. Niektóre popularne analogi Lantusa (po łacinie - Lantus) wg substancja aktywna i efekt terapeutyczny:
- Levemir Penfill;
- Apidra;
- Glulizyna;
- Detemir;
- Humalog mix 25;
- Protafan i in.
Jak znaleźć dawkę Lantusa
Lek podaje się tylko raz dziennie o tej samej porze. Dawkowanie Lantusa jest ściśle dobierane indywidualnie... Dozwolone jest przepisywanie leku pacjentom z cukrzycą, w połączeniu z doustnymi lekami przeciwcukrzycowymi. Jednostki działania preparatu Lantus różnią się od jednostek działania innych insulin - należy to wziąć pod uwagę przed rozpoczęciem stosowania.
Konieczne może być dostosowanie dawki leku, jeśli pacjent będzie jednocześnie stosował leki wpływające na metabolizm glukozy. Na przykład Lantus może wzmacniać działanie niektórych inhibitorów, fibratów, sulfonamidów, salicylanów itp. Jednak beta-blokery i klonidyna mogą pomóc zarówno zmniejszyć, jak i wzmocnić (zwiększyć) skuteczność tego leku.
Lantus podczas ciąży
Badania kliniczne działanie farmakologiczne lek nie był podawany kobietom w ciąży. Mimo to opinie pacjentów wskazują, że jakiekolwiek negatywny wpływ nie wpływa na rozwój płodu i przebieg ciąży. Konieczne jest jednak przepisywanie leku Lantus w czasie ciąży ze szczególną ostrożnością i pod warunkiem starannej kontroli stosowanej dawki.
Skutki uboczne
Lantus, jak każdy inny lek, ma swoją własną negatywne strony... Podczas stosowania pacjenci często mają do czynienia z takim skutkiem, jak hipoglikemia. Ten efekt to znak, że podawanie insuliny odbywa się w dawce przekraczającej zapotrzebowanie pacjenta. Inni skutki uboczne Lantus wyraża się w:
- pojawienie się lipoatrofii, lipohipertrofii z tkanki podskórnej i skóry;
- rozwój retinopatii, zaburzeń smaku i pogorszenia widzenia;
- zaburzenia narządów zmysłów i system nerwowy;
- zaburzenia metaboliczne w postaci hipoglikemii;
- reakcje alergiczne w miejscu wstrzyknięcia, obrzęk;
- szok anafilaktyczny;
- skurcz oskrzeli;
- zatrzymanie sodu w organizmie;
- mialgia.
Przeciwwskazania
Pomimo tego, że Lantus, sądząc po wielu recenzjach, jest w stanie przedłużyć skuteczne leczenie ma kilka przeciwwskazań, z którymi koniecznie trzeba się zapoznać. Przede wszystkim leku nie należy stosować u pacjentów z nietolerancją. substancja aktywna lek lub jego składniki pomocnicze. Inne przeciwwskazania do stosowania insuliny tego typu:
- hipoglikemia;
- terapia cukrzycowej kwasicy ketonowej;
- wiek poniżej 6 lat.
Ponadto Lantus muszą być przyjmowane z najwyższą ostrożnością przez osoby, które są narażone na wysokie ryzyko zdrowotne podczas epizodów hipoglikemii. Dotyczy to również pacjentów z retinopatią proliferacyjną, zwężeniem naczyń mózgowych i wieńcowych. Jednocześnie należy unikać czynności wymagających zwiększonej uwagi, ponieważ z hiper- lub hipoglikemią, czasami zmniejsza się ostrość wzroku i zdolność koncentracji.

Cena insuliny Lantus
Ile kosztuje lek dzisiaj? Nie można bowiem udzielić jednoznacznej odpowiedzi na to pytanie, ponieważ Koszt insuliny Lantus, w zależności od apteki i miasta, może się znacznie różnić. Średnia cena tego typu leku wynosi od 3 do 3,5 tysiąca rubli. Ale są miejsca, w których 3 ml roztworu do wstrzykiwań kosztuje do 4 tysięcy rubli. Dlatego przed zakupem pacjent powinien dokonać porównania cen, aby wybrać najbardziej ekonomiczną opcję.
Wideo
Insulina (od lat. insula - wysepka) jest hormonem białkowo-peptydowym wytwarzanym przez komórki β wysepek Langerhansa trzustki. W warunkach fizjologicznych w komórkach β insulina powstaje z preproinsuliny, jednołańcuchowego białka prekursorowego, składającego się ze 110 reszt aminokwasowych. Po przejściu przez błonę szorstkiej retikulum endoplazmatycznego, peptyd sygnałowy złożony z 24 aminokwasów jest odcinany z preproinsuliny i powstaje proinsulina. W aparacie Golgiego długi łańcuch proinsuliny jest upakowany w granulki, w których w wyniku hydrolizy cztery zasadowe reszty aminokwasowe są rozszczepiane z wytworzeniem insuliny i peptydu C-końcowego (fizjologiczna funkcja peptydu C jest nieznana ).
Cząsteczka insuliny składa się z dwóch łańcuchów polipeptydowych. Jedna z nich zawiera 21 reszt aminokwasowych (łańcuch A), druga - 30 reszt aminokwasowych (łańcuch B). Łańcuchy są połączone dwoma mostkami dwusiarczkowymi. Trzeci mostek dwusiarczkowy jest utworzony w łańcuchu A. Całkowita masa cząsteczkowa cząsteczki insuliny wynosi około 5700. Sekwencja aminokwasów insuliny jest uważana za konserwatywną. Większość gatunków ma jeden gen insuliny, który koduje jedno białko. Wyjątkiem są szczury i myszy (mają dwa geny insuliny), produkują dwie insuliny, które różnią się dwiema resztami aminokwasowymi łańcucha B.
Podstawowa struktura insuliny w różnych gatunkach biologicznych, m.in. u różnych ssaków jest nieco inny. Najbliżej budowy insuliny ludzkiej jest insulina świńska, która różni się od insuliny ludzkiej jednym aminokwasem (zawiera resztę alaniny w łańcuchu B zamiast reszty aminokwasowej treoniny). Insulina bydlęca różni się od insuliny ludzkiej trzema resztami aminokwasowymi.
Odniesienie historyczne. W 1921 roku Frederick G. Bunting i Charles G. Best, pracując w laboratorium Johna J. R. McLeoda na Uniwersytecie w Toronto, wyizolowali ekstrakt z trzustki (później okazało się, że zawiera on amorficzną insulinę), który obniżył poziom glukozy we krwi u psów. z eksperymentalną cukrzycą. W 1922 r. Pierwszemu choremu, 14-letniemu Leonardowi Thompsonowi z cukrzycą podano ekstrakt z trzustki i tym samym uratowano mu życie. W 1923 roku James B. Collip opracował metodę oczyszczania ekstraktu z trzustki, która następnie umożliwiła otrzymanie aktywnych ekstraktów z trzustki świń i bydła z powtarzalnymi wynikami. W 1923 r. Bunting i McLeod otrzymali Nagrodę Nobla w dziedzinie fizjologii lub medycyny za odkrycie insuliny. W 1926 roku J. Abel i V. Du Vigneau otrzymali insulinę w postaci krystalicznej. W 1939 r. Insulina została po raz pierwszy zatwierdzona przez FDA (Food and Drug Administration). Frederick Sanger w pełni rozszyfrował sekwencję aminokwasów insuliny (1949-1954). W 1958 roku Sanger otrzymał nagroda Nobla za pracę nad rozszyfrowaniem struktury białek, zwłaszcza insuliny. W 1963 roku zsyntetyzowano sztuczną insulinę. Pierwsza rekombinowana ludzka insulina została zatwierdzona przez FDA w 1982 r. Ultrakrótko działający analog insuliny (insulina lispro) został zatwierdzony przez FDA w 1996 r.
Mechanizm akcji. W realizacji działania insuliny wiodącą rolę odgrywa jej oddziaływanie z określonymi receptorami zlokalizowanymi na błona plazmatyczna komórki i tworzenie kompleksu insulina-receptor. W połączeniu z receptorem insuliny insulina wnika do komórki, gdzie wpływa na procesy fosforylacji białka komórkowe i wyzwala liczne reakcje wewnątrzkomórkowe.
U ssaków receptory insuliny znajdują się na prawie wszystkich komórkach - zarówno na klasycznych komórkach docelowych insuliny (hepatocytach, miocytach, lipocytach), jak i na komórkach krwi, mózgu i gonad. Liczba receptorów na różnych komórkach waha się od 40 (erytrocyty) do 300 tysięcy (hepatocyty i lipocyty). Receptor insulinowy jest stale syntetyzowany i degradowany, a jego okres półtrwania wynosi 7–12 godzin.
Receptor insulinowy jest dużą transbłonową glikoproteiną składającą się z dwóch podjednostek α \u200b\u200bo masie cząsteczkowej 135 kDa (każda zawierająca 719 lub 731 reszt aminokwasowych, w zależności od splicingu mRNA) i dwóch podjednostek β o masie cząsteczkowej 95 kDa (620 reszty aminokwasowe). Podjednostki są połączone wiązaniami disiarczkowymi i tworzą heterotetrameryczną strukturę β-α-α-β. Podjednostki alfa są zlokalizowane na zewnątrzkomórkowo i zawierają miejsca wiązania insuliny, będące rozpoznawalną częścią receptora. Podjednostki beta tworzą domenę transbłonową, posiadają aktywność kinazy tyrozynowej i pełnią funkcję konwersji sygnału. Wiązanie się insuliny z podjednostkami α receptora insuliny prowadzi do pobudzenia aktywności kinazy tyrozynowej podjednostek β przez autofosforylację ich reszt tyrozynowych, agregację α, β-heterodimerów i szybką internalizację kompleksów hormon-receptor. Aktywowany receptor insuliny wyzwala kaskadę reakcji biochemicznych, m.in. fosforylacja innych białek wewnątrz komórki. Pierwsza z tych reakcji to fosforylacja czterech białek zwanych substratami receptora insuliny, IRS-1, IRS-2, IRS-3 i IRS-4.
Farmakologiczne działanie insuliny.Insulina wpływa na prawie wszystkie narządy i tkanki. Jednak jego głównym celem jest wątroba, mięśnie i tkanka tłuszczowa.
Insulina endogenna jest najważniejszym regulatorem metabolizmu węglowodanów, insulina egzogenna jest swoistym środkiem redukującym cukier. Wpływ insuliny na metabolizm węglowodanów wynika z faktu, że nasila ona transport glukozy błona komórkowa a jej wykorzystanie przez tkanki sprzyja przemianie glukozy w glikogen w wątrobie. Insulina hamuje również endogenną produkcję glukozy poprzez hamowanie glikogenolizy (rozpadu glikogenu do glukozy) i glukoneogenezy (synteza glukozy ze źródeł niewęglowodanowych, takich jak aminokwasy, kwasy tłuszczowe). Oprócz efektów hipoglikemicznych insulina ma wiele innych skutków.
Wpływ insuliny na metabolizm tłuszczów przejawia się hamowaniem lipolizy, co prowadzi do zmniejszenia dostaw wolnych kwasów tłuszczowych do krwiobiegu. Insulina przeszkadza w tworzeniu ciał ketonowych w organizmie. Insulina nasila syntezę kwasów tłuszczowych i ich późniejszą estryfikację.
Insulina bierze udział w metabolizmie białek: zwiększa transport aminokwasów przez błonę komórkową, stymuluje syntezę peptydów, ogranicza zużycie białka przez tkanki oraz hamuje przemianę aminokwasów w ketokwasy.
Działaniu insuliny towarzyszy aktywacja lub hamowanie szeregu enzymów: pobudzane są syntetazy glikogenu, dehydrogenazy pirogronianowej, heksokinaza, hamowane są lipazy (zarówno hydrolizujące lipidy tkanki tłuszczowej, jak i lipaza lipoproteinowa, co zmniejsza „zmętnienie” surowicy po spożyciu pokarmów bogatych w tłuszcze).
W fizjologicznej regulacji biosyntezy i wydzielania insuliny przez trzustkę główną rolę odgrywa stężenie glukozy we krwi: wraz ze wzrostem jej zawartości zwiększa się wydzielanie insuliny, a wraz ze spadkiem zwalnia. Oprócz glukozy na wydzielanie insuliny wpływają elektrolity (zwłaszcza jony Ca 2+), aminokwasy (w tym leucyna i arginina), glukagon, somatostatyna.
Farmakokinetyka. Preparaty insuliny podaje się podskórnie, domięśniowo lub dożylnie (dożylnie podaje się tylko insuliny krótko działające i tylko w przypadku cukrzycy w przypadku precoma i śpiączki). Nie można wprowadzić / w zawiesinie insuliny. Temperatura wstrzykniętej insuliny powinna być równa temperaturze pokojowej, ponieważ zimna insulina jest wchłaniana wolniej. Najbardziej optymalnym sposobem ciągłej insulinoterapii w praktyce klinicznej jest podawanie podskórne.
Stopień wchłaniania i początek działania insuliny zależą od miejsca wstrzyknięcia (zwykle insulina jest wstrzykiwana w brzuch, uda, pośladki, ramiona), dawki (objętości wstrzykniętej insuliny), stężenia insuliny w preparacie itp.
Szybkość wchłaniania insuliny do krwi z miejsca wstrzyknięcia podskórnego zależy od wielu czynników - rodzaju insuliny, miejsca wstrzyknięcia, miejscowego przepływu krwi, miejscowej aktywności mięśni, ilości wstrzykniętej insuliny (zaleca się nie więcej niż 12-16 JEDNOSTEK leku w jedno miejsce). Insulina przenika do krwiobiegu najszybciej z tkanki podskórnej przedniej ściany jamy brzusznej, wolniej z okolicy barku, przedniej części uda, a jeszcze wolniej z okolicy podłopatkowej i pośladków. Wynika to ze stopnia unaczynienia podskórnej tkanki tłuszczowej tych okolic. Profil działania insuliny podlega znacznym wahaniom, jak w różni ludziei ta sama osoba.
We krwi insulina wiąże się z globulinami alfa i beta, zwykle 5-25%, ale wiązanie może wzrosnąć podczas leczenia ze względu na pojawienie się przeciwciał w surowicy (produkcja przeciwciał przeciwko egzogennej insulinie prowadzi do insulinooporności; przy stosowaniu nowoczesnych wysoce oczyszczonych leki, rzadko występuje insulinooporność). T 1/2 krwi to mniej niż 10 minut. Większość insulina dostająca się do krwiobiegu ulega proteolitycznej degradacji w wątrobie i nerkach. Jest szybko wydalany z organizmu przez nerki (60%) i wątrobę (40%); mniej niż 1,5% jest wydalane z moczem w postaci niezmienionej.
Obecnie stosowane preparaty insuliny różnią się pod wieloma względami, m.in. ze względu na źródło pochodzenia, czas działania, pH roztworu (kwaśne i obojętne), obecność konserwantów (fenol, krezol, fenol-krezol, metyloparaben), stężenie insuliny - 40, 80, 100, 200, 500 U / ml .
Klasyfikacja. Insuliny są zwykle klasyfikowane według pochodzenia (analogi insuliny bydlęcej, świńskiej, ludzkiej i ludzkiej) oraz czasu działania.
W zależności od źródła produkcji wyróżnia się insuliny pochodzenia zwierzęcego (głównie preparaty insuliny wieprzowej), półsyntetyczne preparaty insuliny ludzkiej (otrzymywane z insuliny wieprzowej metodą transformacji enzymatycznej), preparaty insuliny ludzkiej modyfikowane genetycznie (rekombinowane DNA, uzyskane za pomocą inżynierii genetycznej).
Dla zastosowanie medyczne insulina była wcześniej pozyskiwana głównie z trzustki bydlęcej, następnie z trzustki świń, ponieważ insulina świńska jest bliższa insulinie ludzkiej. Ponieważ insulina bydlęca, która różni się od insuliny ludzkiej trzema aminokwasami, dość często powoduje reakcje alergiczne, dziś praktycznie nie jest używany. Insulina wieprzowa, która różni się od insuliny ludzkiej jednym aminokwasem, jest mniej skłonna do wywoływania reakcji alergicznych. W przypadku niedostatecznego oczyszczenia leki insulinowe mogą zawierać zanieczyszczenia (proinsulina, glukagon, somatostatyna, białka, polipeptydy), które mogą powodować różne działania niepożądane. Nowoczesne technologie pozwalają na otrzymanie preparatów insuliny oczyszczonej (mono-pik - oczyszczonej chromatograficznie z wyodrębnieniem „piku” insuliny), wysoko oczyszczonej (jednoskładnikowej) i skrystalizowanej. Spośród preparatów insuliny pochodzenia zwierzęcego preferowana jest insulina monopowa otrzymywana z trzustki świń. Insulina otrzymana metodami inżynierii genetycznej w pełni odpowiada składowi aminokwasowemu insuliny ludzkiej.
Aktywność insuliny określa się metodą biologiczną (zdolność do obniżania stężenia glukozy we krwi królików) lub metodą fizykochemiczną (metodą elektroforezy na papierze lub chromatografii na papierze). Jedną jednostką działania lub jednostką międzynarodową jest aktywność 0,04082 mg krystalicznej insuliny. Trzustka ludzka zawiera do 8 mg insuliny (około 200 j.).
W zależności od czasu działania preparaty insuliny dzielimy na leki krótko i ultrakrótko działające - imitują normalne fizjologiczne wydzielanie insuliny przez trzustkę w odpowiedzi na stymulację, leki o średnim czasie działania i leki długo działające - symulują podstawowe (podstawowe) wydzielanie insuliny, a także leki złożone (łączą oba działania) ...
Wyróżnia się następujące grupy:
(działanie hipoglikemiczne rozwija się w ciągu 10-20 minut po podaniu podskórnym, szczyt działania występuje średnio po 1-3 godzinach, czas działania 3-5 godzin):
Insulina lispro (Humalog);
Insulina Aspart (NovoRapid Penfill, NovoRapid FlexPen);
Insulina glulizynowa (Apidra).
Insuliny krótko działające (początek działania zwykle po 30-60 minutach; maksymalne działanie po 2-4 godzinach; czas działania do 6-8 godzin):
Rozpuszczalna insulina [inżynieria genetyczna człowieka] (Actrapid HM, Gensulin R, Rinsulin R, Humulin Regular);
Rozpuszczalna insulina [ludzka półsyntetyczna] (Biogulin R, Humodar R);
Rozpuszczalna insulina [jednoskładnikowy świński składnik] (Actrapid MS, Monodar, Monosuinsulin MK).
Preparaty insuliny długo działającej - obejmuje leki o średnim czasie działania i długo działające.
(początek po 1,5-2 godzinach; szczyt po 3-12 godzinach; czas trwania 8-12 godzin):
Insulina-izofan [inżynieria genetyczna człowieka] (Biosulin N, Gansulin N, Gensulin N, Insuman Bazal GT, Insuran NPKh, Protafan NM, Rinsulin NPKh, Humulin NPKh);
Insulina-izofan [ludzki półsyntetyczny] (Biogulina N, Humodar B);
Insulina-izofan [jednoskładnikowa wieprzowina] (Monodar B, Protafan MS);
Zawiesina związku insulinowo-cynkowego (Monotard MS).
Insuliny długo działające (początek po 4-8 godzinach; szczyt po 8-18 godzinach; całkowity czas trwania 20-30 godzin):
Insulina glargine (Lantus);
Insulina detemir (Levemir Penfill, Levemir FlexPen).
Preparaty insuliny o złożonym działaniu(leki dwufazowe) (działanie hipoglikemiczne rozpoczyna się 30 minut po podaniu podskórnym, osiąga maksimum po 2-8 godzinach i utrzymuje się do 18-20 godzin):
Insulina dwufazowa [ludzka półsyntetyczna] (Biogulin 70/30, Humodar K25);
Insulina dwufazowa [inżynieria genetyczna człowieka] (Gansulin 30R, Gensulin M 30, Insuman Comb 25 GT, Mixtard 30 NM, Humulin M3);
Insulina aspart dwufazowa (NovoMix 30 Penfill, NovoMix 30 FlexPen).
Insuliny ultrakrótko działające- analogi ludzkiej insuliny. Wiadomo, że endogenna insulina w komórkach β trzustki, jak również cząsteczki hormonów w wytwarzanych krótko działających roztworach insuliny są polimeryzowane i są heksamerami. Przy podawaniu podskórnym formy heksameryczne wchłaniają się powoli i nie można osiągnąć maksymalnego stężenia hormonu we krwi, podobnego do tego u zdrowej osoby po jedzeniu. Pierwszym krótko działającym analogiem insuliny, który wchłania się z tkanki podskórnej 3 razy szybciej niż insulina ludzka, była insulina lispro. Insulina lispro jest pochodną insuliny ludzkiej otrzymywaną przez przegrupowanie dwóch reszt aminokwasowych w cząsteczce insuliny (lizyna i prolina w pozycjach 28 i 29 łańcucha B). Modyfikacja cząsteczki insuliny zakłóca tworzenie się heksamerów i zapewnia szybki przepływ leku do krwi. Niemal natychmiast po podaniu podskórnym do tkanek cząsteczki insuliny lispro w postaci heksamerów szybko dysocjują na monomery i dostają się do krwiobiegu. Inny analog insuliny, insulina aspart, został stworzony przez zastąpienie proliny w pozycji B28 ujemnie naładowanym kwasem asparaginowym. Podobnie jak insulina lispro, po podaniu s / c również szybko rozkłada się na monomery. W insulinie glulizynowej zastąpienie aminokwasu asparaginy insuliny ludzkiej w pozycji B3 lizyną i lizyną w pozycji B29 kwasem glutaminowym również sprzyja szybszemu wchłanianiu. Analogi insuliny działające ultrakrótko można podawać bezpośrednio przed lub po posiłku.
Insuliny krótko działające (zwane też rozpuszczalnymi) to roztwory w buforze o obojętnym pH (6,6-8,0). Są przeznaczone do podskórnej, rzadziej - wstrzyknięcie domięśniowe... W razie potrzeby podaje się je również dożylnie. Mają szybki i stosunkowo krótkotrwały efekt hipoglikemiczny. Efekt po wstrzyknięciu podskórnym występuje w ciągu 15-20 minut, osiąga maksimum po 2 godzinach; całkowity czas działania wynosi około 6 h. Stosowane są głównie w szpitalu podczas ustalania wymaganej dawki insuliny dla pacjenta, a także gdy potrzebny jest szybki (pilny) efekt - w śpiączce cukrzycowej i przedkomorze. Przy podawaniu dożylnym T 1/2 wynosi 5 minut, dlatego w przypadku cukrzycowej śpiączki ketonowej insulinę wstrzykuje się dożylnie. Preparaty insuliny krótkodziałającej są również stosowane jako środki anaboliczne i są zwykle przepisywane w małych dawkach (4-8 U 1-2 razy dziennie).
Insuliny o średnim działaniu mniej rozpuszczalne, wolniej wchłaniane z tkanki podskórnej, przez co działają dłużej. Długotrwały efekt tych leków osiąga się dzięki obecności specjalnego przedłużacza - protaminy (izofan, protafan, podstawa) lub cynku. Spowolnienie wchłaniania insuliny w preparatach zawierających zawiesinę związku cynkowego insuliny spowodowane jest obecnością kryształów cynku. Insulina NPH (obojętna protamina Hagedorna lub izofan) jest zawiesiną insuliny i protaminy (protaminy, białka izolowanego z mleka ryb) w stosunku stechiometrycznym.
Insulina długo działająca Insulina glargine, analog ludzkiej insuliny, otrzymywany metodą rekombinacji DNA, jest pierwszym preparatem insuliny, który nie wykazuje wyraźnego szczytu działania. Insulina glargine jest otrzymywana poprzez dwie modyfikacje cząsteczki insuliny: zastąpienie w pozycji 21 łańcucha A (asparaginy) glicyną i dodanie dwóch reszt argininy na C-końcu łańcucha B. Lek jest klarownym roztworem o pH 4. Kwaśne pH stabilizuje heksamery insuliny i zapewnia długotrwałe i przewidywalne wchłanianie leku z tkanki podskórnej. Jednak ze względu na kwaśne pH insuliny glargine nie można łączyć z insulinami krótko działającymi, które mają obojętne pH. Pojedyncza dawka insuliny glargine zapewnia 24-godzinną kontrolę glikemii bez szczytu. Większość preparatów insulinowych ma tzw. „Szczyt” działania, który obserwujemy, gdy stężenie insuliny we krwi osiąga maksimum. Insulina glargine nie osiąga szczytu, ponieważ jest uwalniana do krwiobiegu w stosunkowo stałym tempie.
Dostępne są różne preparaty insuliny o przedłużonym uwalnianiu postacie dawkowaniaktóre mają działanie hipoglikemiczne o różnym czasie trwania (od 10 do 36 godzin). Przedłużony efekt pozwala zmniejszyć liczbę codziennych zastrzyków. Zwykle produkowane są w postaci zawiesin podawanych wyłącznie podskórnie lub domięśniowo. W śpiączce cukrzycowej i stanach przedrakowych nie stosuje się leków o przedłużonym uwalnianiu.
Połączone preparaty insulinowe to zawiesiny składające się z krótko działającej obojętnej rozpuszczalnej insuliny i insuliny izofanowej (średnio działającej) w określonych proporcjach. Ta kombinacja insulin o różnym czasie działania w jednym leku pozwala pacjentowi pozbyć się dwóch zastrzyków, gdy leki są stosowane oddzielnie.
Wskazania. Głównym wskazaniem do stosowania insuliny jest cukrzyca typu 1, ale pod pewnymi warunkami jest ona również przepisywana przy cukrzycy typu 2, m.in. z opornością na doustne leki hipoglikemizujące, z ciężkimi chorobami współistniejącymi, w przygotowaniu do zabiegów chirurgicznych, w śpiączce cukrzycowej, z cukrzycą u kobiet w ciąży. Insuliny krótko działające są stosowane nie tylko w cukrzycy, ale także w niektórych innych procesy patologicznenp. przy ogólnym wyczerpaniu (jako środek anaboliczny), furunculosis, tyreotoksykozie, chorobach żołądka (atonia, gastroptoza), przewlekłym zapaleniu wątroby, formy początkowe marskość wątroby, a także niektóre choroba umysłowa (wprowadzenie dużych dawek insuliny - tzw. śpiączka hipoglikemiczna); bywa stosowany jako składnik roztworów „polaryzacyjnych” stosowanych w leczeniu ostrej niewydolności serca.
Insulina jest główną terapią specyficzną cukrzyca... Leczenie cukrzycy odbywa się według specjalnie opracowanych schematów z użyciem preparatów insulinowych o różnym czasie działania. Wybór leku zależy od ciężkości i charakterystyki przebiegu choroby, ogólnego stanu pacjenta oraz szybkości wystąpienia i czasu trwania hipoglikemizującego działania leku.
Wszystkie preparaty insulinowe są stosowane pod warunkiem obowiązkowego przestrzegania diety z ograniczeniem wartości energetycznej żywności (od 1700 do 3000 kcal).
Przy ustalaniu dawki insuliny kierują się poziomem glikemii na czczo oraz w ciągu dnia, a także poziomem cukromoczu w ciągu dnia. Ostateczny dobór dawki przeprowadza się pod kontrolą zmniejszenia hiperglikemii, cukromoczu, a także ogólnego stanu pacjenta.
Przeciwwskazania. Insulina jest przeciwwskazana w chorobach i stanach występujących przy hipoglikemii (na przykład insulinoma), z ostre choroby wątroba, trzustka, nerki, wrzody żołądka i dwunastnica, niewyrównane wady serca, z ostrą niewydolnością wieńcową i niektórymi innymi chorobami.
Stosowanie w ciąży.Podstawową terapią lekową na cukrzycę w ciąży jest insulinoterapia prowadzona pod ścisłym nadzorem. W cukrzycy typu 1 kontynuuje się leczenie insuliną. W przypadku cukrzycy typu 2 doustne leki hipoglikemizujące są anulowane i stosowana jest dieta.
Cukrzyca ciążowa (cukrzyca ciążowa) to zaburzenie metaboliczne węglowodanów, które po raz pierwszy pojawia się podczas ciąży. Cukrzyca ciążowa wiąże się ze zwiększonym ryzykiem śmiertelności okołoporodowej, występowaniem wrodzonych wad rozwojowych oraz ryzykiem progresji cukrzycy po 5–10 latach od porodu. Leczenie cukrzycy ciążowej rozpoczyna się od terapii dietetycznej. Jeśli terapia dietetyczna jest nieskuteczna, stosuje się insulinę.
W przypadku pacjentek z cukrzycą już istniejącą lub ciążową ważne jest utrzymanie odpowiedniej regulacji metabolicznej przez cały okres ciąży. Zapotrzebowanie na insulinę może się zmniejszyć w pierwszym trymestrze ciąży i zwiększyć w II-III trymestrze. Podczas porodu i bezpośrednio po porodzie zapotrzebowanie na insulinę może się gwałtownie zmniejszyć (wzrasta ryzyko hipoglikemii). W takich przypadkach dokładne monitorowanie stężenia glukozy we krwi jest niezbędne.
Insulina nie przenika przez barierę łożyskową. Jednak matczyne przeciwciała IgG przeciwko insulinie przechodzą przez łożysko i prawdopodobnie powodują hiperglikemię u płodu, neutralizując wydzielaną insulinę. Z drugiej strony niechciana dysocjacja kompleksów insulina-przeciwciało może prowadzić do hiperinsulinemii i hipoglikemii u płodu lub noworodka. Wykazano, że przejściu z preparatów insuliny bydlęcej / świńskiej na preparaty jednoskładnikowe towarzyszy spadek miana przeciwciał. W związku z tym w czasie ciąży zaleca się stosowanie wyłącznie preparatów insuliny ludzkiej.
Analogi insuliny (podobnie jak inne niedawno opracowane leki) są stosowane ostrożnie podczas ciąży, chociaż nie ma wiarygodnych dowodów na działania niepożądane. Zgodnie z ogólnie uznanymi zaleceniami FDA (Food and Drug Administration), które określają możliwość stosowania leków w ciąży, preparaty insuliny działające na płód zaliczane są do kategorii B (badanie rozrodu zwierząt nie wykazało niekorzystnego wpływ na płód, ale nie przeprowadzono odpowiednich i ściśle kontrolowanych badań u kobiet w ciąży) lub kategorii C (badania reprodukcji zwierząt wykazały niekorzystny wpływ na płód, a odpowiednie i ściśle kontrolowane badania u kobiet w ciąży wykazały nie przeprowadzono, jednak potencjalne korzyści związane ze stosowaniem leków u kobiet w ciąży mogą uzasadniać ich stosowanie, pomimo możliwego ryzyka). Zatem insulina lispro należy do klasy B, a insulina aspart i insulina glargine do klasy C.
Powikłania insulinoterapii. Hipoglikemia. Wprowadzenie zbyt dużych dawek, a także brak spożycia węglowodanów z pożywieniem może spowodować niepożądany stan hipoglikemii, śpiączkę hipoglikemiczną z utratą przytomności, drgawki i zahamowanie czynności serca. Hipoglikemia może również rozwinąć się w wyniku działania dodatkowych czynników zwiększających wrażliwość na insulinę (np. Niewydolność kory nadnerczy, niedoczynność przysadki) lub zwiększających wychwyt glukozy przez tkanki (wysiłek fizyczny).
DO wczesne objawy hipoglikemia, która jest w dużej mierze związana z aktywacją współczulnego układu nerwowego (objawy adrenergiczne), obejmuje tachykardię, zimne poty, drżenie, z aktywacją układu przywspółczulnego - silny głód, nudności i uczucie mrowienia w ustach i języku. Przy pierwszych oznakach hipoglikemii konieczne są pilne środki: pacjent musi wypić słodką herbatę lub zjeść kilka kostek cukru. W śpiączce hipoglikemicznej do żyły wstrzykuje się 40% roztwór glukozy w ilości 20-40 ml lub więcej, aż pacjent wyjdzie ze śpiączki (zwykle nie więcej niż 100 ml). Hipoglikemię można również złagodzić przez domięśniowe lub podskórne podanie glukagonu.
Przybranie na wadze przy insulinoterapii wiąże się z eliminacją cukromoczu, wzrostem rzeczywistej kaloryczności pożywienia, wzrostem apetytu i stymulacją lipogenezy pod wpływem insuliny. Z zastrzeżeniem zasad racjonalnego żywienia, to efekt uboczny można uniknąć.
Stosowanie nowoczesnych wysokooczyszczonych preparatów hormonalnych (zwłaszcza preparatów insuliny ludzkiej wytworzonych metodami inżynierii genetycznej) stosunkowo rzadko prowadzi do rozwoju insulinooporność i zjawiska alergiejednak takie przypadki nie są wykluczone. Rozwój ostrej reakcji alergicznej wymaga natychmiastowej terapii odczulającej i zastąpienia leku. Jeśli wystąpi reakcja na preparaty insuliny wołowej / wieprzowej, należy je zastąpić preparatami insuliny ludzkiej. Miejscowe i ogólnoustrojowe reakcje (swędzenie, miejscowa lub ogólnoustrojowa wysypka, tworzenie guzków podskórnych w miejscu wstrzyknięcia) są związane z niedostatecznym oczyszczeniem insuliny z zanieczyszczeń lub ze stosowaniem insuliny bydlęcej lub świńskiej różniącej się sekwencją aminokwasów od ludzkiej.
Najczęstszymi reakcjami alergicznymi są reakcje skórne, w których pośredniczą przeciwciała IgE. Sporadycznie obserwuje się ogólnoustrojowe reakcje alergiczne, a także insulinooporność, w której pośredniczą przeciwciała IgG.
Niedowidzenie. Przejściowe wady wzroku pojawiają się na samym początku insulinoterapii i ustępują samoistnie po 2-3 tygodniach.
Obrzęk. W pierwszych tygodniach terapii dochodzi również do przemijającego obrzęku nóg na skutek zalegania płynów w organizmie, tzw. obrzęk insuliny.
Lokalne reakcje obejmują lipodystrofia w miejscu wielokrotnych wstrzyknięć (rzadkie powikłanie). Przydziel lipoatrofię (zanik podskórnych złogów tłuszczu) i lipohipertrofię (wzrost podskórnych złogów tłuszczu). Te dwa stany mają inny charakter. Obecnie praktycznie nie stwierdza się lipoatrofii, reakcji immunologicznej spowodowanej głównie podawaniem słabo oczyszczonych preparatów insuliny pochodzenia zwierzęcego. Lipohipertrofia rozwija się również przy stosowaniu wysoko oczyszczonych preparatów insuliny ludzkiej i może wystąpić przy naruszeniu techniki iniekcji (preparat na zimno, przedostawanie się alkoholu pod skórę), a także na skutek miejscowego działania anabolicznego samego preparatu. Tworzy lipohipertrofia wada kosmetycznaco jest problemem dla pacjentów. Ponadto z powodu tej wady wchłanianie leku jest upośledzone. Aby zapobiec rozwojowi lipohipertrofii, zaleca się ciągłą zmianę miejsc wstrzyknięcia w tym samym obszarze, zachowując co najmniej 1 cm odstęp między dwoma nakłuciami.
Mogą wystąpić miejscowe reakcje, takie jak ból w miejscu wstrzyknięcia.
Interakcja. Preparaty insuliny można łączyć ze sobą. Wiele leków może powodować hipo- lub hiperglikemię lub zmieniać odpowiedź pacjenta z cukrzycą na leczenie. Należy wziąć pod uwagę możliwe interakcje przy jednoczesnym stosowaniu insuliny z innymi leki... Alfa-blokery i agoniści beta-adrenergiczni zwiększają wydzielanie endogennej insuliny i wzmacniają działanie leku. Hipoglikemiczne działanie insuliny wzmacniają doustne leki hipoglikemizujące, salicylany, inhibitory MAO (w tym furazolidon, prokarbazyna, selegilina), inhibitory ACE, bromokryptyna, oktreotyd, sulfonamidy, steroidy anaboliczne (zwłaszcza oksandrolon, metrogeny i wrażliwość tkanek na glukagon, które prowadzi do hipoglikemii, szczególnie w przypadku insulinooporności; może być konieczne zmniejszenie dawki insuliny), analogi somatostatyny, guanetydyna, dyzopiramid, klofibrat, ketokonazol, preparaty litu, mebendazol, pentamidyna, pirydoksyna, propoksyfen, fenylobutoksynaetazon, preparaty, preparaty wapniowe, tetracykliny. Chlorochina, chinidyna, chinina zmniejszają rozkład insuliny i mogą zwiększać stężenie insuliny we krwi i zwiększać ryzyko hipoglikemii.
Inhibitory anhydrazy węglanowej (zwłaszcza acetazolamid), stymulując komórki β trzustki, sprzyjają wydzielaniu insuliny i zwiększają wrażliwość receptorów i tkanek na insulinę; chociaż jednoczesne stosowanie tych leków z insuliną może nasilać efekt hipoglikemiczny, efekt może być nieprzewidywalny.
Wiele leków powoduje hiperglikemię u zdrowi ludzie i zaostrzać przebieg choroby u pacjentów z cukrzycą. Hipoglikemiczne działanie insuliny osłabiają: leki przeciwretrowirusowe, asparaginaza, doustne hormonalne środki antykoncepcyjne, glikokortykoidy, diuretyki (tiazyd, kwas etakrynowy), heparyna, antagoniści receptorów H2, sulfinpirazon, trójpierścieniowe leki przeciwdepresyjne, dobutinoamidazidazyna, isos diazoksyd, morfina, fenytoina, somatotropina, hormony tarczycy, pochodne fenotiazyny, nikotyna, etanol.
Glukokortykoidy i epinefryna działają odwrotnie niż insulina na tkanki obwodowe. Zatem długotrwałe stosowanie ogólnoustrojowych glikokortykoidów może powodować hiperglikemię, aż do cukrzycy (cukrzyca steroidowa), która może wystąpić u około 14% pacjentów przyjmujących kortykosteroidy ogólnoustrojowe przez kilka tygodni lub długotrwale stosujących kortykosteroidy. Niektóre leki bezpośrednio hamują wydzielanie insuliny (fenytoina, klonidyna, diltiazem) lub poprzez zmniejszenie zapasów potasu (diuretyki). Hormony tarczycy przyspieszają metabolizm insuliny.
Do najważniejszych i często wpływających na działanie insuliny należą beta-blokery, doustne leki hipoglikemizujące, glikokortykoidy, etanol, salicylany.
Etanol hamuje glukoneogenezę w wątrobie. Ten efekt jest widoczny u wszystkich ludzi. W związku z tym należy pamiętać, że nadużywanie napojów alkoholowych na tle insulinoterapii może prowadzić do rozwoju ciężkiego stanu hipoglikemii. Małe ilości alkoholu przyjmowane z jedzeniem zwykle nie powodują problemów.
Beta-adrenolityki mogą hamować wydzielanie insuliny, zmieniać metabolizm węglowodanów i zwiększać insulinooporność obwodową, prowadząc do hiperglikemii. Mogą jednak również hamować wpływ katecholamin na glukoneogenezę i glikogenolizę, co wiąże się z ryzykiem ciężkich reakcji hipoglikemicznych u pacjentów z cukrzycą. Ponadto każdy z beta-blokerów może maskować objawy adrenergiczne spowodowane obniżeniem poziomu glukozy we krwi (w tym drżenie, kołatanie serca), zakłócając w ten sposób wczesne rozpoznanie hipoglikemii przez pacjenta. W mniejszym stopniu wpływają to selektywne beta 1-adrenolityki (m.in. acebutolol, atenolol, betaksolol, bisoprolol, metoprolol).
NLPZ i salicylany w dużych dawkach hamują syntezę prostaglandyny E (która hamuje wydzielanie insuliny endogennej), a tym samym zwiększają wydzielanie insuliny podstawowej, zwiększają wrażliwość komórek β trzustki na glukozę; działanie hipoglikemiczne przy jednoczesnym stosowaniu może wymagać dostosowania dawki NLPZ lub salicylanów i / lub insuliny, zwłaszcza przy długotrwałym stosowaniu łącznie.
Obecnie produkowana jest znaczna liczba preparatów insulinowych, m.in. pozyskiwane z trzustki zwierząt i syntetyzowane metodami inżynierii genetycznej. Leki z wyboru do insulinoterapii to wysoce oczyszczone insuliny ludzkie o minimalnej antygenowości (aktywności immunogennej) wytworzone metodami inżynierii genetycznej, a także analogi insuliny ludzkiej.
Preparaty insulinowe produkowane są w fiolkach szklanych, hermetycznie zamykanych gumowymi korkami z aluminiowym walcem, w specjalnych tzw. strzykawki insulinowe lub pióra strzykawek. W przypadku korzystania ze strzykawek preparaty znajdują się w specjalnych fiolkach z wkładami (penfill).
Opracowywane są insuliny donosowe i doustne preparaty insulinowe. Gdy insulina jest połączona z detergentem i jest podawana w postaci aerozolu na błonę śluzową nosa, efektywny poziom w osoczu osiąga się tak szybko, jak w przypadku podania dożylnego bolusa. Preparaty insulinowe do stosowania donosowego i podanie doustne są w trakcie opracowywania lub przechodzą badania kliniczne.
Aby pozbyć się cukrzycy, w praktyce lekarskiej zwykle stosuje się analogi insuliny.
Z biegiem czasu takie leki stają się coraz bardziej popularne wśród lekarzy i ich pacjentów.
Tendencję tę można wytłumaczyć:
- wystarczająco wysoka wydajność insuliny przemysłowej;
- doskonały wysoki profil bezpieczeństwa;
- łatwość użycia;
- możliwość zsynchronizowania wstrzyknięcia leku z własnym wydzielaniem hormonu.
Pacjenci z cukrzycą drugiego typu po pewnym czasie zmuszeni są do przestawienia się z tabletek obniżających poziom cukru we krwi na zastrzyki z hormonu insuliny. Dlatego kwestia wyboru optymalnego dla nich leku ma pierwszorzędne znaczenie.
Cechy nowoczesnych insulin
Istnieją pewne ograniczenia w stosowaniu insuliny ludzkiej, na przykład powolny początek ekspozycji (diabetyk powinien wykonać wstrzyknięcie 30-40 minut przed posiłkiem) i zbyt długi czas działania (do 12 godzin), który może spowodować warunkiem wstępnym opóźnionej hipoglikemii.
Pod koniec ubiegłego wieku konieczne stało się opracowanie analogów insuliny, które byłyby pozbawione tych wad. Insuliny krótko działające zostały wyprodukowane z maksymalnym okresem półtrwania w fazie eliminacji.
To przybliżyło ich do właściwości natywnej insuliny, którą można dezaktywować w ciągu 4-5 minut po wejściu do krwiobiegu.
Odmiany insuliny bez szczytu mogą być równomiernie i płynnie wchłaniane z tłuszczu podskórnego i nie wywołują nocnej hipoglikemii.
W ostatnich latach nastąpił znaczący przełom w farmakologii, ponieważ zauważono:
- przejście od kwaśnych roztworów do obojętnych;
- produkcja insuliny ludzkiej przy użyciu technologii rekombinacji DNA;
- tworzenie wysokiej jakości substytutów insuliny o nowych właściwościach farmakologicznych.
Analogi insuliny zmieniają czas działania ludzkiego hormonu, zapewniając indywidualne fizjologiczne podejście do terapii i maksymalną wygodę dla diabetyków.
Leki umożliwiają osiągnięcie optymalnej równowagi między ryzykiem spadku poziomu cukru we krwi a osiągnięciem docelowego indeksu glikemicznego.
Współczesne analogi insuliny dzieli się zwykle ze względu na czas ich działania na:
- bardzo krótkie (Humalog, Apidra, Penfill);
- przedłużony (Lantus, Levemir Penfill).
Ponadto istnieją preparaty złożone z substytutów, które są mieszaniną ultrakrótkiego i przedłużonego hormonu w określonym stosunku: Penfill, Humalog mix 25.
Humalog (lispro)
W strukturze tej insuliny zmieniono pozycje proliny i lizyny. Różnica między lekiem a rozpuszczalną insuliną ludzką polega na słabej spontaniczności związków międzycząsteczkowych. W związku z tym lispro może być szybciej wchłaniany do krwiobiegu cukrzyka.
Jeśli wstrzykujesz leki w tej samej dawce i w tym samym czasie, to Humalog osiągnie szczyt 2 razy szybciej. Hormon ten jest eliminowany znacznie szybciej i po 4 godzinach jego stężenie wraca do poziomu wyjściowego. Stężenie ludzkiej insuliny prostej zostanie utrzymane w ciągu 6 godzin.
Porównując lispro z krótkotrwałą insuliną prostą, możemy powiedzieć, że ta pierwsza może znacznie silniej hamować wytwarzanie glukozy przez wątrobę.
Jest jeszcze jedna zaleta leku Humalog - jest bardziej przewidywalny i może ułatwić okres dostosowania dawki do obciążenia pokarmem. Charakteryzuje się brakiem zmian w czasie ekspozycji na skutek wzrostu objętości wstrzykiwanej substancji.
Przy stosowaniu prostej insuliny ludzkiej czas jej działania może się różnić w zależności od dawki. Z tego wynika średni czas trwania od 6 do 12 godzin.
Wraz ze wzrostem dawki insuliny Humalog czas jej działania pozostaje praktycznie taki sam i wyniesie 5 godzin.
Wynika z tego, że ryzyko opóźnionej hipoglikemii nie wzrasta wraz ze wzrostem dawki preparatu Lispro.
Aspart (Novorapid Penfill)
Ten analog insuliny jest w stanie prawie idealnie naśladować odpowiednią odpowiedź insuliny na przyjmowanie pokarmu. Jego krótki czas działania prowadzi do relatywnie słabego działania między posiłkami, co pozwala uzyskać jak najpełniejszą kontrolę nad poziomem cukru we krwi.
Jeśli porównamy wynik leczenia analogami insuliny ze zwykłą insuliną krótkodziałającą ludzką, zauważymy znaczący wzrost jakości kontroli poposiłkowego poziomu cukru we krwi.
Skojarzone leczenie lekami Detemir i Aspart umożliwia:
- prawie 100% normalizuje dzienny profil hormonu insuliny;
- jakościowo poprawić poziom glikozylowanej hemoglobiny;
- znacznie zmniejszyć prawdopodobieństwo wystąpienia warunków hipoglikemii;
- zmniejszyć amplitudę i szczyty stężenia cukru we krwi cukrzyka.
Warto zauważyć, że podczas terapii analogami insuliny basal-bolus średni przyrost masy ciała był istotnie mniejszy niż w całym okresie dynamicznej obserwacji.
Glulizin (Apidra)
Analog ludzkiej insuliny Apidra jest lekiem bardzo krótkotrwałym. Pod względem właściwości farmakokinetycznych, farmakodynamicznych i biodostępności Glulizin jest odpowiednikiem leku Humalog. Pod względem aktywności mitogennej i metabolicznej hormon ten nie różni się od zwykłej insuliny ludzkiej. Dzięki temu można go używać przez długi czas i jest całkowicie bezpieczny.
Generalnie Apidru należy stosować w połączeniu z:
- długoterminowa insulina ludzka;
- analog insuliny bazalnej.
Ponadto lek charakteryzuje się szybszym rozpoczęciem pracy i krótszym czasem trwania niż normalny ludzki hormon. Dzięki temu pacjenci z cukrzycą mogą być bardziej elastyczni w stosowaniu go z jedzeniem niż ludzki hormon. Insulina zaczyna działać natychmiast po podaniu, a poziom cukru we krwi spada 10-20 minut po wstrzyknięciu podskórnym preparatu Apidra.
Aby uniknąć hipoglikemii u pacjentów w podeszłym wieku, lekarze zalecają podawanie leku bezpośrednio po posiłku lub jednocześnie z nim. Skrócony czas działania hormonu pozwala uniknąć tzw. Efektu „nakładania się”, co pozwala zapobiegać hipoglikemii.
Może być skuteczny dla osób z nadwagą, ponieważ jego stosowanie nie powoduje dalszego przybierania na wadze. Lek charakteryzuje się szybkim początkiem maksymalnego stężenia w porównaniu z innymi typami hormonów regularnych i lispro.
Apidra jest idealna dla osób z różnym stopniem nadwagi ze względu na dużą elastyczność stosowania. W przypadku otyłości trzewnej szybkość wchłaniania leku może być różna, co utrudnia kontrolę glikemii po posiłku.
Detemir (Levemir Penfill)
Levemir Penfill jest analogiem insuliny ludzkiej. Ma średni czas działania i nie ma szczytów. Pomaga to w utrzymaniu podstawowej kontroli glikemii przez cały dzień, ale przy dwukrotnym stosowaniu.
Po podaniu podskórnym Detemir tworzy substancje, które wiążą się z albuminą surowicy w płynie śródmiąższowym. Już po przejściu przez ścianę naczyń włosowatych insulina w krwiobiegu ponownie wiąże się z albuminą.
W preparacie tylko wolna frakcja jest biologicznie aktywna. Dlatego wiązanie się z albuminą i jej powolny rozkład zapewnia długą i pozbawioną pików pracę.
Insulina Levemir Penfill działa łagodnie na organizm pacjenta z cukrzycą i uzupełnia jego pełne zapotrzebowanie na insulinę podstawową. Nie przewiduje wstrząsania przed podaniem podskórnym.
Glargin (Lantus)
Substytut insuliny Glargin działa bardzo szybko. Lek ten może być dobrze i całkowicie rozpuszczalny w słabo kwaśnym środowisku i słabo rozpuszczalny w środowisku obojętnym (w tłuszczu podskórnym).
 Natychmiast po podaniu podskórnym Glargin wchodzi w reakcję neutralizacji z utworzeniem mikroprecypitacji, która jest niezbędna do dalszego uwalniania heksamerów leku i ich rozpadu na monomery i dimery hormonu insuliny.
Natychmiast po podaniu podskórnym Glargin wchodzi w reakcję neutralizacji z utworzeniem mikroprecypitacji, która jest niezbędna do dalszego uwalniania heksamerów leku i ich rozpadu na monomery i dimery hormonu insuliny.
Dzięki płynnemu i stopniowemu dopływowi Lantusa do krwiobiegu pacjenta z cukrzycą, jego krążenie w łóżku następuje w ciągu 24 godzin. Dzięki temu możliwe jest wstrzykiwanie analogów insuliny tylko raz dziennie.
Dodanie niewielkiej ilości cynku zapewnia krystalizację insuliny Lantus w warstwie tkanki podskórnej, co dodatkowo wydłuża czas jej wchłaniania. Absolutnie wszystkie wymienione cechy tego leku gwarantują jego gładki i całkowicie pozbawiony daszków profil.
Glargin zaczyna działać już 60 minut po wstrzyknięciu podskórnym. Jego stabilne stężenie w osoczu krwi pacjenta można zaobserwować po 2-4 godzinach od podania pierwszej dawki.
Niezależnie od dokładnej godziny wstrzyknięcia tego ultraszybkiego leku (rano lub wieczorem) i bezpośredniego miejsca wstrzyknięcia (brzuch, ramię, noga), czas działania na organizm będzie:
- średnia - 24 godziny;
- maksymalnie - 29 godzin.
Zastąpienie insuliny Glargin może w pełni odpowiadać fizjologicznemu hormonowi w swojej wysokiej skuteczności, ponieważ lek:
- jakościowo stymuluje spożycie cukru przez insulino-zależne tkanki obwodowe (zwłaszcza tłuszcz i mięśnie);
- hamuje glukoneogenezę (zmniejsza).
Ponadto lek znacząco hamuje rozpad tkanki tłuszczowej (lipoliza), rozpad białek (proteoliza), jednocześnie wzmagając produkcję tkanki mięśniowej.
Badania medyczne farmakokinetyki preparatu Glargin wykazały, że dystrybucja tego leku bez pików umożliwia prawie 100% naśladowanie podstawowej produkcji endogennego hormonu insuliny w ciągu 24 godzin. Jednocześnie znacznie zmniejsza się prawdopodobieństwo wystąpienia warunków hipoglikemii i gwałtownych skoków poziomu cukru we krwi.
Humalog mix 25
Ten lek jest mieszaniną składającą się z:
- 75% protaminowana zawiesina hormonu lispro;
- 25% insuliny Humalog.
Ten i inne analogi insuliny są również łączone zgodnie z mechanizmem ich uwalniania. Doskonały czas działania leku zapewnia działanie protaminowanej zawiesiny hormonu lispro, która umożliwia powtórzenie podstawowej produkcji hormonu.
Pozostałe 25% insuliny lispro to składnik o ultrakrótkim czasie działania, który pozytywnie wpływa na indeks glikemiczny po posiłkach.
Warto zauważyć, że Humalog w składzie mieszanki oddziałuje na organizm znacznie szybciej w porównaniu z krótkim hormonem. Zapewnia maksymalną kontrolę glikemii poporodowej i dlatego ma bardziej fizjologiczny profil w porównaniu z insuliną krótko działającą.
Insuliny złożone są szczególnie polecane osobom z cukrzycą typu 2. Do tej grupy zaliczają się osoby starsze, które z reguły mają problemy z pamięcią. Dlatego wprowadzenie hormonu przed posiłkiem lub bezpośrednio po nim pomaga znacząco poprawić jakość życia takich pacjentów.
Badania zdrowia diabetyków grupa wiekowa w wieku od 60 do 80 lat przy zastosowaniu leku Humalog mix 25 wykazali, że udało się uzyskać doskonałą kompensację metabolizmu węglowodanów. W schemacie podawania hormonów przed i po posiłkach lekarzom udało się uzyskać niewielki przyrost masy ciała i wyjątkowo małą hipoglikemię.
Jaka jest najlepsza insulina?
Jeśli porównamy farmakokinetykę omawianych leków, to ich powołanie przez lekarza prowadzącego jest całkiem uzasadnione w cukrzycy, zarówno typu I, jak i typu II. Istotną różnicą między tymi insulinami jest brak wzrostu masy ciała podczas leczenia i zmniejszenie liczby nocnych spadków stężenia glukozy we krwi.
Ponadto należy zwrócić uwagę na konieczność wykonania tylko jednego wstrzyknięcia w ciągu dnia, co jest znacznie wygodniejsze dla pacjentów. Skuteczność analogu ludzkiej insuliny Glargin w skojarzeniu z metforminą jest szczególnie wysoka u pacjentów z drugim typem cukrzycy. Badania wykazały znaczące zmniejszenie nocnych skoków stężenia cukru. Pomaga to niezawodnie normalizować codzienną glikemię.
Strona 3 z 14
3. OGÓLNE INFORMACJE DOTYCZĄCE ANALOGÓW INSULINY
3.1. UZASADNIENIE ANALOGOWEJ TERAPII INSULINĄ
Powszechnie wiadomo, że właściwa kontrola glikemii opóźnia wystąpienie i spowalnia wystąpienie późnych powikłań cukrzycy u dorosłych i młodzieży z cukrzycą typu 1 i 2. 4 "5" 9. Można to osiągnąć dzięki insulinoterapii, ale rozpuszczalne insuliny ludzkie, w tym dwufazowa insulina ludzka (BIP), należy podawać co najmniej 20-30 minut przed posiłkiem, czego większość pacjentów nie robi. Jednocześnie ultra krótko działające analogi insuliny wchłaniają się znacznie szybciej niż zwykła insulina, można je podawać bezpośrednio przed posiłkiem lub nawet bezpośrednio po posiłku, co pozwala zbliżyć się do norma fizjologiczna dokładniej niż przy stosowaniu tradycyjnych rozpuszczalnych insulin ludzkich.
3.2. NOVORAPID® - ANALOG SZYBKIEJ INSULINY
Analogi insuliny to zmodyfikowane chemicznie warianty naturalnej insuliny. Zostały zaprojektowane, aby skuteczniej utrzymywać poziom insuliny odpowiedni do potrzeb fizjologicznych, zmniejszając w ten sposób niektóre ograniczenia nieodłącznie związane z konwencjonalnymi preparatami insuliny. Insulina aspart (NovoRapid®) jest oryginalnym analogiem insuliny ultrakrótko działającej, która ma strukturę prawie podobną do insuliny naturalnej, różniąc się tylko jedną modyfikacją - resztę proliny w pozycji 28 łańcucha aminokwasowego zastąpiono resztą kwasu asparaginowego (Rys. 1). To podstawienie zmniejsza samoczynną agregację cząsteczek insuliny do dimerów i heksamerów, co przyspiesza jej wchłanianie. Jednocześnie nie zmienia się interakcja insuliny z receptorami (ryc. 2, str. 6) 10 Zmodyfikowana cząsteczka insuliny w pełni zachowuje biologiczne właściwości hipoglikemiczne insuliny naturalnej, jest jednak szybciej wchłaniana i posiada oczekiwaną farmakokinetykę 11.
Postać: 1. NovoRapid® (insulina aspart) - budowa molekularna.

Postać: 2. Schemat procesów zachodzących w tkance podskórnej.
Struktury heksamerowe ultrakrótko działającego analogu insuliny są degradowane do monomerów znacznie szybciej niż heksamery rozpuszczalnej tradycyjnej insuliny, co prowadzi do ich szybszego wchłaniania z miejsc wstrzyknięcia i przedostania się do krwiobiegu.
Ultrakrótko działający analog insuliny NovoRapid® jest wchłaniany szybciej z miejsca wstrzyknięcia niż rozpuszczalna insulina ludzka, osiąga wyższe stężenie maksymalne w krótszym czasie 12 i ma krótszy okres półtrwania (ryc. 3). Dzięki temu początek jej działania następuje szybciej niż 13 (10-20 minut po wstrzyknięciu), a czas działania jest krótszy niż insuliny rozpuszczalnej (3-5 godzin w porównaniu do 6-8 godzin).
Różnice te określają następujące trzy zalety NovoRapid® w porównaniu z rozpuszczalną insuliną:
• można go podawać bezpośrednio przed posiłkiem, a nie 30 minut przed posiłkiem;
• krótki czas działania stwarza wygodę dla pacjenta, który nie musi już przyjmować dodatkowego pokarmu w przerwach między głównymi posiłkami;
• podanie bezpośrednio przed posiłkami, krótki czas działania potencjalnie zmniejsza ryzyko hipoglikemii i nie wymaga kontroli glikemii 13 "14.
W specjalnych badaniach klinicznych wykazano, że przejście 850 dorosłych pacjentów z cukrzycą typu 1 z insuliny rozpuszczalnej na insulinę aspart podawaną przed posiłkami zmniejszyło częstość występowania hipoglikemii nocnej o 50% (p \u003d 0,005), a poziom HbA1c istotnie zmniejszył się o 0,12 0,15%. Ostatnie badania wykazały spadek częstości występowania hipoglikemii o ponad 70% u pacjentów z cukrzycą typu 1 leczonych NovoRapid 15.
Wprowadzenie preparatu NovoRapid® bezpośrednio przed posiłkami zapewnia odpowiednią kontrolę glikemii poposiłkowej i glikemii w ciągu dnia, a także stwarza wygodę dla pacjentów.
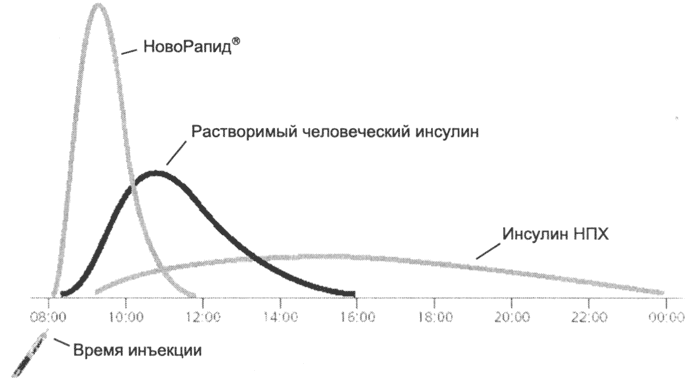
Rys. 3:. Schemat kinetyki różnych insulin.
3.3. NOVOMIX® 30 - ANALOG DWUFAZOWEJ INSULINY
NovoMix® 30 (dwufazowa insulina aspart) składa się w 30% z ultrakrótko działającego analogu insuliny aspart iw 70% z krystalicznej protaminy - insuliny aspart. W preparatach dwufazowych zachowane jest szybkie wchłanianie składnika rozpuszczalnego, co zapewnia szybki początek działania i szybką jego eliminację 16. Powolne wchłanianie formy protaminowanej (podobnie jak insulina NPH) jest składnikiem insulinoterapii bazalnej. W rezultacie dwufazowa insulina zaspokaja zapotrzebowanie na insulinę zarówno podstawowe, jak i związane z pożywieniem (ryc. 4).
3.3.1. Korzyści z dwufazowej insuliny
Insuliny dwufazowe (wstępnie zmieszane) pozwalają pacjentom na utrzymanie harmonogramu insulinowego obejmującego składniki szybko i średnio długo działające (co jest niezbędne do zaspokojenia zapotrzebowania zarówno podstawowego, jak i pokarmowego), jednocześnie zmniejszając liczbę wstrzyknięć w ciągu dnia. Zastosowanie ultrakrótko działających analogów insuliny umożliwia wyraźniejsze rozróżnienie zapotrzebowania na insulinę podstawową i pokarmową (koncepcja „podwójnego zasysania” dwufazowej insuliny aspart). Pozwala to znacznie poprawić poposiłkową kontrolę glikemii, a także ma inne zalety szybko działających analogów, np. Nie ma potrzeby przestrzegania odstępu między iniekcją a posiłkiem. Schemat dwufazowej insuliny jest najprostszy z możliwych. Ponadto zastosowanie dwufazowych insulin umożliwia pacjentowi porzucenie fiolek i strzykawek i przejście na nowoczesne systemy podawanie leków. Stosowanie dwufazowych insulin eliminuje konieczność mieszania różnych leków, co nie tylko upraszcza proces podawania, ale także zapobiega ryzyku możliwe błędy podczas mieszania.
W przypadku stosowania insuliny dwufazowej nie ma takiej potrzeby duża liczba w przypadku jednoczesnego podawania insuliny szybko działającej i leku o średnim działaniu. Chociaż stosowanie dwufazowej insuliny zawęża możliwości indywidualnego doboru dawki, nie ma powodu, aby sądzić, że samodzielne mieszanie jest skuteczniejsze w poprawie kontroli glikemii u chorych dzieci w wieku przedpokwitaniowym 12,17. W dwufazowych preparatach insuliny stosunek szybko działających insulina do insuliny o pośrednim czasie działania jest ustalona. Najczęstszym stosunkiem jest 30% ultrakrótko działającego analogu i 70% średnio działającego jest odpowiedni dla wielu pacjentów.
Insuliny dwufazowe są szeroko stosowane przez chorych na cukrzycę, w tym dzieci i młodzież, na całym świecie. Badanie przeprowadzone na 2873 dzieciach z Europy, Japonii i Ameryki Północnej wykazało, że 60% (n \u003d 1707) otrzymywało dwa zastrzyki dziennie. Z łącznie wśród pacjentów wykonujących dwa lub trzy wstrzyknięcia 37% stosowało wstępnie zmieszaną insulinę samodzielnie lub w połączeniu z inną insuliną 18.
Stosowanie leków dwufazowych jest wskazane u dzieci i młodzieży, dla których priorytetem jest zmniejszenie liczby iniekcji i swobodny tryb życia. Rodzicom i nauczycielom jest dość trudno kontrolować wstrzyknięcie dzieciom w latach szkolnych. Wraz z początkiem okresu dojrzewania, kiedy osobista wolność, autonomia i akceptacja stają się dominującymi czynnikami, potrzeba wykonywania wielu zastrzyków w ciągu dnia może wywołać urazę i urazę, a niektórzy pacjenci po prostu pomijają zastrzyki z insuliną. Jeśli leczenie ogranicza spędzanie czasu wolnego i zakłóca nawyki żywieniowe, należy dokonać pewnych kompromisów. Dzieci młodym wiekułatwość stosowania dwufazowej insuliny powinni docenić pacjenci z trudnościami w uczeniu się, którzy mają trudności z przystosowaniem się do bardziej złożonego schematu leczenia lub ci, których jakość życia jest obniżona w wyniku leczenia.
Dwufazowe preparaty insulinowe, w skład których wchodzi rozpuszczalna insulina ludzka, mają typowe dla insuliny rozpuszczalnej wady: konieczność podawania 30 minut przed posiłkiem, czas działania nieodpowiadający fizjologicznemu wydzielaniu insuliny oraz wysokie ryzyko hipoglikemii. Jednocześnie dwufazowe analogi, na przykład NovoMix® 30, są wolne od tych wad i umożliwiają wielu pacjentom osiągnięcie odpowiedniej kontroli glikemii przy zaledwie dwóch wstrzyknięciach dziennie.
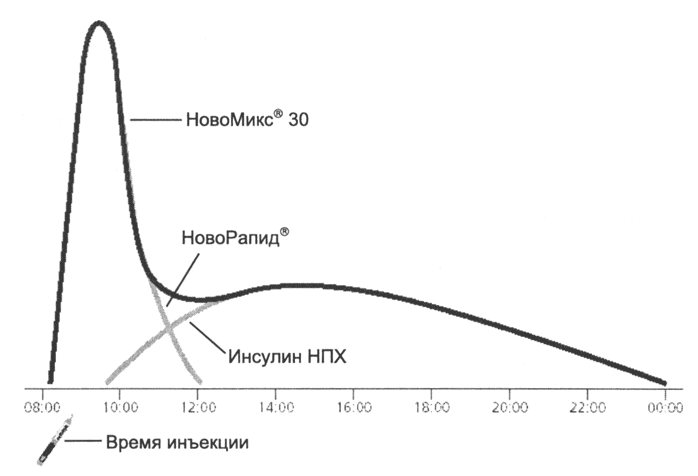
Postać: 4. Podwójny profil stężenia insuliny we krwi po wstrzyknięciu NovoMix® 30.
Rzeczywiście, te proste i wygodne schematy leczenia u wielu pacjentów przyczyniają się do osiągnięcia skutecznej kontroli metabolicznej w porównaniu z bardziej złożonymi (i teoretycznie bardziej skutecznymi) schematami iniekcji. U dorosłych profil podwójnego ssania NovoMix® 30 kompensuje podstawowe i poposiłkowe zapotrzebowanie na insulinę dokładniej niż w dniu 16-19-20. Ponadto NovoMix® 30 zmniejsza zarówno całkowite, jak i poposiłkowe stężenie glukozy we krwi w większym stopniu niż DNI 1 "20 23. Dane dotyczące leczenia dzieci NovoMix® 30, a także innymi dwufazowymi analogami insuliny są ograniczone, ale obecnie przeprowadza się szereg badań dotyczących stosowania NovoMix® 30 w pediatrii. Dwufazowe analogi insuliny mogą być stosowane zamiast konwencjonalnych dwufazowych insulin we wszystkich przypadkach, w których są obecnie stosowane.
NovoMix® 30, dwufazowy analog insuliny, tworzy dwufazowy profil stężenia insuliny, który jest bardziej fizjologiczny niż konwencjonalna insulina dwufazowa, z podziałem na szczyt związany z pożywieniem i składnik podstawowy
3.4. DŁUGOTRWAŁE ANALOGI
Obecnie na rynku jest jeden długo działający analog insuliny (insulina glargine), inne, w tym insulina detemir, są w trakcie opracowywania. Oczekuje się, że w przyszłości przy pomocy długo działających analogów możliwe będzie przezwyciężenie wad konwencjonalnych insulin długo działających, takich jak mniej przewidywalny profil insuliny cynkowej (ultralente, monotard). Obecnie dane dotyczące skuteczności i bezpieczeństwa długo działającego analogu insuliny pozostają ograniczone.
3.5. BEZPIECZEŃSTWO ANALOGÓW IZOLINY
Przed rozpoczęciem leczenia analogami insuliny należy omówić kwestie bezpieczeństwa. Novo Nordisk była pierwszą firmą, która pracowała nad stworzeniem analogów insuliny o określonych właściwościach farmakokinetycznych. Wczesne badania przeprowadzone przez Novo Nordisk w latach 80-tych nad analogami insuliny obejmowały opracowanie B10Asp. Jednak wysokie powinowactwo do receptorów insulinopodobnego czynnika wzrostu 1 (IGF-1) i wysoki potencjał mitogenetyczny B10Asp zmusiły naukowców do skoncentrowania wysiłków na opracowaniu i poszukiwaniu analogów insuliny o bezpieczniejszych właściwościach. Tak powstał ultrakrótko działający analog insuliny aspart (NovoRapid®).
Przedkliniczne i badania kliniczne Analogi insuliny aspart wskazują, że jest on równoważny pod względem skuteczności z insuliną ludzką, przy tym samym niskim prawdopodobieństwie wystąpienia niepożądanych lub niezwykłych skutków biologicznych. Potwierdzają to dane porównawcze przedstawione na rys. pięć.
Postać: 5. Względne powinowactwo do receptorów IGF-1 i potencjał mitogenetyczny niektórych analogów insuliny.


