1. Hematología / O.A. Rukavitsyn, A.D. Pavlov, E.F. Morshakova [etc.] /ed. O.A. Rukavitsina. – San Petersburgo: LLC “DP”, 2007. – 912 p.
2. Cardiología. Hematología / ed. SOBRE EL. Buna, N.R. Universidad y otros - M.: Reed Elsiver LLC, 2009. - 288 p.
3. Hematología visual / Traducción del inglés. Editado por el prof. Y EN. Ershova. – 2ª ed. – M.: GEOTAR-Media, 2008. – 116 p.: enfermo.
4. Papayan A.V., Zhukova L.Yu. Anemia en niños: una guía para médicos. – SPb.: PEDRO. – 2001 – 384 p.
5. Fisiopatología: libro de texto: en 2 volúmenes/ed. V.V. Novitsky, E.D. Goldberg, O.I. Urazova. – 4ª ed. – GEOTAR-Media, 2010. – T.2. – 848 p.: enfermo.
6. Fisiopatología: libro de texto, 3 volúmenes: [A.I. Volozhin y otros]; editado por AI. Volozhina, G.V. Poryadina. – M.: Centro Editorial “Academia”, 2006.- T.2 – 256 págs.: ill.
8. Guía de hematología / Ed. A. I. Vorobyova. - M.: Newdiamed, 2007. - 1275 p.
9. Shiffman F.J. Fisiopatología de la sangre. – M.: Editorial BINOM, 2009. – 448 p.
La anemia hemolítica es un grupo de enfermedades caracterizadas por una destrucción patológicamente intensa de los glóbulos rojos, una mayor formación de sus productos de degradación y un aumento reactivo de la eritropoyesis. Actualmente, todas las anemias hemolíticas se suelen dividir en dos grupos principales: hereditarias y adquiridas.
Las anemias hemolíticas hereditarias, según la etiología y patogénesis, se dividen en:
I. Membranopatía de eritrocitos:
a) “dependiente de proteínas”: microesferocitosis; ovalocitosis; estomatocitosis; piropoiquilocitosis; enfermedad "Rh-cero";
b) “lípidodependientes”: acantocitosis.
II. Enzimopatías de eritrocitos causadas por deficiencia:
a) enzimas del ciclo de las pentosas fosfato;
b) enzimas de glucólisis;
c) glutatión;
d) enzimas involucradas en el uso de ATP;
e) enzimas implicadas en la síntesis de porfirinas.
III. Hemoglobinopatías:
a) asociado con una violación de la estructura primaria de las cadenas de globina;
b) talasemia.
Anemia hemolítica adquirida:
I. Anemia inmunohemolítica:
a) autoinmune;
b) heteroinmune;
c) isoinmune;
d) transinmune.
II. Membranopatías adquiridas:
a) paroxístico hemoglobinuria nocturna(enfermedad de Marchiafava-Micheli);
b) anemia de células estimuladas.
III. Anemia asociada con daños mecanicos las células rojas de la sangre:
a) hemoglobinuria de marcha;
b) derivados de prótesis de vasos sanguíneos o válvulas cardíacas;
c) Enfermedad de Moshkovich (anemia hemolítica microangiopática).
IV. Anemia hemolítica tóxica de diversas etiologías.
Mecanismos de desarrollo y características hematológicas de las enfermedades congénitas. anemias hemolíticas
La clasificación anterior de anemia hemolítica indica de manera convincente que los factores etiopatogenéticos más importantes en el desarrollo de la hemólisis de los eritrocitos son alteraciones en la estructura y función de las membranas de los eritrocitos, su metabolismo, la intensidad de las reacciones glucolíticas, la oxidación de la glucosa con pentosa fosfato, así como la calidad. y cambios cuantitativos en la estructura de la hemoglobina.
I. Características formas separadas membranopatías de eritrocitos
Como ya se indicó, la patología puede estar asociada con un cambio en la estructura de la proteína o con un cambio en la estructura de los lípidos de la membrana de los eritrocitos.
Las membranopatías dependientes de proteínas más comunes incluyen las siguientes anemias hemolíticas: microesferocitosis (enfermedad de Minkowski-Choffard), ovalocitosis, estomatocitosis, formas más raras: piropoiquilocitosis, enfermedad Rh nula. Las membranopatías dependientes de lípidos ocurren en un pequeño porcentaje entre otras membranopatías. Un ejemplo de tal anemia hemolítica es la acantocitosis.
Anemia hemolítica microesferocítica (enfermedad de Minkowski-Choffard). La enfermedad se hereda de forma autosómica dominante. La base de las alteraciones en la microesferocitosis es un contenido reducido de la proteína espectrina similar a la actomiosina en la membrana de los eritrocitos, un cambio en su estructura y una interrupción de la conexión con los microfilamentos de actina y los lípidos de la superficie interna de la membrana de los eritrocitos.
Al mismo tiempo, hay una disminución en la cantidad de colesterol y fosfolípidos, así como un cambio en su proporción en la membrana de los eritrocitos.
Estos trastornos hacen que la membrana citoplasmática sea muy permeable a los iones de sodio. Un aumento compensatorio de la actividad de Na, K-ATPasa no garantiza una eliminación suficiente de los iones de sodio de la célula. Este último conduce a una sobrehidratación de los glóbulos rojos y contribuye a un cambio en su forma. Los glóbulos rojos se convierten en esferocitos, pierden sus propiedades plásticas y, al atravesar los senos y espacios intersinusales del bazo, se lesionan, pierden parte de su membrana y se convierten en microesferocitos.
La vida útil de los microesferocitos es aproximadamente 10 veces más corta que la de los glóbulos rojos normales, la resistencia mecánica es de 4 a 8 veces menor y la resistencia osmótica de los microesferocitos también se ve afectada.
A pesar de la naturaleza congénita de la anemia hemolítica microesferocítica, sus primeras manifestaciones suelen observarse en la niñez, la adolescencia y la edad adulta, rara vez en bebés y ancianos.
Los pacientes con anemia microesferocítica experimentan ictericia. piel y mucosas, agrandamiento del bazo, en el 50% de los pacientes el hígado aumenta de tamaño, hay tendencia a formar cálculos en el vesícula biliar. Algunos pacientes pueden tener anomalías congénitas del esqueleto y de los órganos internos: cráneo en torre, paladar gótico, bradi o polidactilia, estrabismo, malformaciones del corazón y de los vasos sanguíneos (la llamada constitución hemolítica).
Imagen de sangre. Anemia de diversa gravedad. Número reducido de glóbulos rojos en la sangre periférica. El contenido de hemoglobina durante las crisis hemolíticas disminuye a 40-50 g/l, durante el período entre crisis es de aproximadamente 90-110 g/l. El índice de color puede ser normal o ligeramente reducido.
La cantidad de microesferocitos en la sangre periférica varía, desde un pequeño porcentaje hasta un aumento significativo en la cantidad total de glóbulos rojos. El contenido de reticulocitos aumenta persistentemente y oscila entre el 2 y el 5% durante el período entre crisis y el 20% o más (50-60%) después de una crisis hemolítica. Durante una crisis, se pueden detectar eritrocariocitos únicos en la sangre periférica.
La cantidad de leucocitos durante el período entre crisis está dentro del rango normal y, en el contexto de una crisis hemolítica, leucocitosis con un desplazamiento neutrofílico hacia la izquierda. El recuento de plaquetas suele ser normal.
La punción de la médula ósea revela una hiperplasia pronunciada del linaje eritroblástico con un mayor número de mitosis y signos de maduración acelerada.
En la anemia microesferocítica, como en otras anemias hemolíticas, se produce un aumento del nivel de bilirrubina en el suero sanguíneo, principalmente debido a la fracción no conjugada.
Anemia hemolítica ovalocítica (eliptocitosis hereditaria). Los ovalocitos son una forma filogenéticamente más antigua de glóbulos rojos. En sangre gente sana se determinan en un pequeño porcentaje, de 8 a 10. En pacientes con eliptocitosis hereditaria, su número puede alcanzar el 25-75%.
La enfermedad se hereda de forma autosómica dominante. La patogénesis es causada por un defecto en la membrana de los eritrocitos, en el que faltan varias fracciones. proteínas de membrana, incluida la espectrina. Esto se acompaña de una disminución de la resistencia osmótica de los ovalocitos, un aumento de la autohemólisis y un acortamiento de la vida útil de los ovalocitos.
La destrucción de los ovalocitos se produce en el bazo, por lo que la mayoría de los pacientes experimentan su agrandamiento.
Imagen de sangre. Anemia de diversa gravedad, con mayor frecuencia normocrómica. La presencia de ovalocitos en sangre periférica es superior al 10-15%, reticulocitosis moderada. Aumento de la bilirrubina indirecta en el suero sanguíneo. La ovalocitosis a menudo se combina con otras formas de anemia hemolítica, por ejemplo, anemia falciforme y talasemia.
Estomatocitosis hereditaria. El tipo de herencia es autosómica dominante. Esta es una patología rara. El diagnóstico se basa en la detección de un aspecto peculiar de los glóbulos rojos en un frotis de sangre: una zona sin teñir en el centro del glóbulo rojo está rodeada por zonas coloreadas conectadas a los lados, que se asemeja a una boca abierta (estoma griego). . Los cambios en la forma de los eritrocitos están asociados con defectos genéticos en la estructura de las proteínas de la membrana, lo que provoca una mayor permeabilidad de la membrana para los iones Na + y K + (la penetración pasiva del sodio en la célula aumenta aproximadamente 50 veces y la liberación de potasio de los eritrocitos aumenta 5 veces). En la mayoría de los portadores de la anomalía, la enfermedad no se manifiesta clínicamente.
Imagen de sangre. Los pacientes desarrollan anemia, a menudo normocrómica. Durante la crisis hemolítica hay una fuerte caída hemoglobina, reticulocitosis alta. El nivel de bilirrubina indirecta aumenta en el suero sanguíneo.
Se reducen la resistencia osmótica y la vida útil de los glóbulos rojos defectuosos.
La importancia diagnóstica es la determinación de una mayor cantidad de iones de sodio en los glóbulos rojos alterados y una disminución de los iones de potasio.
Anemia hemolítica acantocítica. La enfermedad pertenece a las membranopatías dependientes de lípidos, se hereda de forma autosómica recesiva y se manifiesta en etapas tempranas. infancia. Con esta patología, se encuentran unos glóbulos rojos peculiares en la sangre de los pacientes: acantocitos (del griego akanta, espina, espina). en la superficie de estos glóbulos rojos hay de 5 a 10 proyecciones largas en forma de púas.
Se cree que en las membranas de los acantocitos hay alteraciones en la fracción de fosfolípidos: un aumento en el nivel de esfingomielina y una disminución en la fosfatidilcolina. Estos cambios conducen a la formación de glóbulos rojos defectuosos.
Al mismo tiempo, la cantidad de colesterol, fosfolípidos y triglicéridos en el suero sanguíneo de estos pacientes disminuye y la proteína β está ausente. La enfermedad también se llama abetalipoproteinemia hereditaria.
Imagen de sangre. Anemia, a menudo normocrómica, reticulocitosis, presencia de glóbulos rojos con proyecciones características en forma de púas.
Aumenta el contenido de bilirrubina indirecta en el suero sanguíneo.
II. Anemia hemolítica hereditaria asociada con actividad alterada de las enzimas de los eritrocitos.
Anemia hemolítica asociada con deficiencia de las enzimas del ciclo de las pentosas fosfato. La insuficiencia de la glucosa-6-fosfato deshidrogenasa de los eritrocitos se hereda según el tipo ligado al sexo (tipo cromosómico X). De acuerdo a esto manifestaciones clínicas Las enfermedades se observan principalmente en hombres que heredaron esta patología de su madre con su cromosoma X y en mujeres homocigotas para el cromosoma anormal. En mujeres heterocigotas, las manifestaciones clínicas dependerán de la proporción de glóbulos rojos normales y glóbulos rojos con deficiencia de glucosa-6-fosfato deshidrogenasa.
Actualmente se han descrito más de 250 variantes de la deficiencia de glucosa-6-fosfato deshidrogenasa, de las cuales 23 variantes fueron descubiertas en la URSS.
El papel clave del G-6-FDG es su participación en la reducción de NADP y NADPH2, que aseguran la regeneración del glutatión en los eritrocitos. El glutatión reducido protege a los glóbulos rojos de la descomposición al entrar en contacto con oxidantes. En individuos con deficiencia de glucosa-6-fosfato deshidrogenasa, los oxidantes de origen exógeno y endógeno activan la peroxidación lipídica de las membranas de los eritrocitos, aumentan la permeabilidad de la membrana de los eritrocitos, alteran el equilibrio iónico en las células y reducen la resistencia osmótica de los eritrocitos. Se produce hemólisis intravascular aguda.
Se conocen más de 40 varios tipos sustancias medicinales, que son agentes oxidantes y provocan hemólisis de los glóbulos rojos. Estos incluyen antipalúdicos, muchas sulfonamidas y antibióticos, fármacos antituberculosos, nitroglicerina, analgésicos, antipiréticos, vitaminas C y K, etc.
La hemólisis puede ser inducida por intoxicaciones endógenas, por ejemplo, acidosis diabética, acidosis durante insuficiencia renal. La hemólisis ocurre durante la toxicosis de mujeres embarazadas.
Imagen de sangre. Crisis hemolítica provocada por la toma. producto medicinal, se acompaña del desarrollo de anemia normocrómica, reticulocitosis, leucocitosis neutrofílica y, a veces, el desarrollo de una reacción leucemoide. Se observa eritroblastosis reactiva en la médula ósea.
En los recién nacidos con una deficiencia grave de la actividad de la glucosa-6-fosfato deshidrogenasa, las crisis hemolíticas ocurren inmediatamente después del nacimiento. Se trata de una enfermedad hemolítica de los recién nacidos, no asociada a un conflicto inmunológico. La enfermedad se presenta con síntomas neurológicos graves. La patogénesis de estas crisis no se ha estudiado suficientemente, se supone que la hemólisis es provocada por el consumo por parte de una madre embarazada o lactante. medicamentos con efecto hemolítico.
Anemia hemolítica hereditaria causada por deficiencia de la actividad de la piruvato quinasa de los eritrocitos. La anemia hemolítica congénita ocurre en individuos homocigotos para un gen autosómico recesivo. Los portadores heterocigotos están prácticamente sanos. La enzima piruvato quinasa es una de las enzimas finales de la glucólisis que asegura la formación de ATP. En pacientes con deficiencia de piruvato quinasa, la cantidad de ATP en los eritrocitos disminuye y los productos de la glucólisis de etapas anteriores (fosfofenolpiruvato, 3-fosfoglicerato, 2,3-difosfoglicerato) se acumulan y el contenido de piruvato y lactato disminuye.
Como resultado de una disminución en los niveles de ATP, se interrumpen todos los procesos dependientes de la energía y, en primer lugar, el trabajo de Na+, K+-ATPasa de la membrana de los eritrocitos. Una disminución de la actividad de Na+, K+-ATPasa provoca la pérdida de iones de potasio por parte de la célula, una disminución del contenido de iones monovalentes y la deshidratación de los glóbulos rojos.
La deshidratación de los glóbulos rojos dificulta la oxigenación de la hemoglobina y la liberación de oxígeno de la hemoglobina a los tejidos. Un aumento del 2,3-difosfoglicerato en los eritrocitos compensa parcialmente este defecto, ya que la afinidad de la hemoglobina por el oxígeno disminuye cuando interactúa con el 2,3-difosfoglicerato y, en consecuencia, se facilita la liberación de oxígeno a los tejidos.
Las manifestaciones clínicas de la enfermedad son heterogéneas y pueden manifestarse como crisis hemolíticas y aplásicas y, en algunos pacientes, en forma de leves. anemia severa o incluso asintomáticos.
Imagen de sangre. Anemia moderada, a menudo normocrómica. A veces se detecta macrocitosis; la resistencia osmótica de los eritrocitos se reduce o no cambia, durante las crisis aumenta el contenido de bilirrubina indirecta en el plasma. El número de reticulocitos en la sangre periférica aumenta drásticamente durante una crisis y, en algunos pacientes, aparecen eritrocariocitos en la sangre.
III. Hemoglobinopatías
Este es un grupo de anemias hemolíticas asociadas con una violación de la estructura o síntesis de la hemoglobina.
Hay hemoglobinopatías causadas por una anomalía en la estructura primaria de la hemoglobina, cualitativa (anemia falciforme) y causada por una violación de la síntesis de las cadenas de hemoglobina, o cuantitativa (talasemia).
Anemia falciforme. La enfermedad fue descrita por primera vez en 1910 por Herrick. En 1956, Itano e Ingram establecieron que la enfermedad es una consecuencia mutación genética, como resultado de lo cual se produce una sustitución de aminoácidos en la posición VI de la cadena polipeptídica β de la hemoglobina del ácido glutámico con valina neutra y comienza a sintetizarse hemoglobina S anormal, lo que se acompaña del desarrollo de poiquilocitosis pronunciada y la aparición de falciformes. Formas celulares de eritrocitos.
La razón de la aparición de glóbulos rojos falciformes es que la hemoglobina S en estado desoxigenado tiene 100 veces menos solubilidad que la hemoglobina A, y alta habilidad a la polimerización. Como resultado, se forman cristales oblongos dentro del glóbulo rojo, que le dan una forma de hoz. Estos glóbulos rojos se vuelven rígidos, pierden sus propiedades plásticas y se hemolizan fácilmente.
En el caso de portador homocigoto hablamos de anemia falciforme, y en el caso de portador heterocigoto hablamos de anomalía falciforme. La enfermedad es común en los países del "cinturón de malaria" del mundo (los países del Mediterráneo, el Cercano y Medio Oriente, el Norte y África occidental, India, Georgia, Azerbaiyán, etc.). La presencia de hemoglobina S en portadores heterocigotos les proporciona protección contra la malaria tropical. En los residentes de estos países, la hemoglobina S se presenta hasta en el 40% de la población.
La forma homocigota de la enfermedad se caracteriza por una anemia normocrómica moderada, el contenido total de hemoglobina es de 60-80 g/l. La cantidad de reticulocitos aumenta: 10% o más. La vida media de los glóbulos rojos es de unos 17 días. Un rasgo característico es la presencia en el frotis teñido de eritrocitos falciformes, eritrocitos con punción basófila.
La hemólisis de los glóbulos rojos contribuye al desarrollo de complicaciones trombóticas. Pueden producirse múltiples trombosis de los vasos del bazo, los pulmones, las articulaciones, el hígado y las meninges, seguidas del desarrollo de un infarto en estos tejidos. Dependiendo de la localización de la trombosis en la anemia de células falciformes, se distinguen varios síndromes: torácico, musculoesquelético, abdominal, cerebral, etc. El empeoramiento de la anemia puede estar asociado con una crisis hipoplásica, que ocurre con mayor frecuencia en niños en el contexto de una infección. En este caso, se observa una inhibición de la hematopoyesis de la médula ósea y los reticulocitos desaparecen en la sangre periférica, y disminuye la cantidad de glóbulos rojos, neutrófilos y plaquetas.
La crisis hemolítica puede desencadenarse en pacientes con anemia falciforme enfermedades infecciosas, estrés, hipoxia. Durante estos períodos, la cantidad de glóbulos rojos disminuye drásticamente, el nivel de hemoglobina disminuye, aparece orina negra, aparece una decoloración ictérica de la piel y las membranas mucosas y aumenta la bilirrubina indirecta en la sangre.
Además de las crisis aplásicas y hemolíticas en la anemia falciforme, se observan crisis de secuestro, en las que una parte importante de los glóbulos rojos se deposita en órganos internos, en particular en el bazo. Cuando los glóbulos rojos se depositan en órganos internos, pueden destruirse en los lugares de depósito, aunque en algunos casos los glóbulos rojos no se destruyen durante el depósito.
La forma heterocigota de hemoglobinopatía S (anomalía de células falciformes) es asintomática en la mayoría de los pacientes, ya que el contenido de hemoglobina patológica en los glóbulos rojos es bajo. Un pequeño porcentaje de portadores heterocigotos de hemoglobina anormal durante condiciones hipóxicas (neumonía, ascenso a la altitud) pueden tener orina oscura y diversas complicaciones trombóticas.
Talasemia. Se trata de un grupo de enfermedades con trastorno hereditario de la síntesis de una de las cadenas de globina, hemólisis, hipocromía y eritrocitopoyesis ineficaz.
La talasemia es común en los países del Mediterráneo, Asia Central, Transcaucasia, etc. Los factores ambientales y étnicos, los matrimonios consanguíneos y la incidencia de malaria en un área determinada juegan un papel importante en su propagación.
La enfermedad fue descrita por primera vez por los pediatras estadounidenses Cooley y Lee en 1925 (probablemente una forma homocigótica de α-talasemia).
El factor etiológico de la talasemia son las mutaciones de genes reguladores, la síntesis de ARN mensajero anormalmente inestable o que no funciona, lo que conduce a una interrupción de la formación de las cadenas α, β, γ y δ de la hemoglobina. Es posible que el desarrollo de la talasemia se base en mutaciones graves de genes estructurales, como deleciones, que también pueden ir acompañadas de una disminución en la síntesis de las correspondientes cadenas polipeptídicas de globina. Dependiendo de la alteración en la síntesis de ciertas cadenas polipeptídicas de hemoglobina, se distingue la talasemia α, β, δ y βδ; sin embargo, cada forma se basa en una deficiencia de la fracción principal de hemoglobina, la HbA.
Normalmente, la síntesis de varias cadenas polipeptídicas de hemoglobina está equilibrada. En patología, en caso de deficiencia en la síntesis de una de las cadenas de globina, se produce un exceso de producción de otras cadenas polipeptídicas, lo que conduce a la formación de concentraciones excesivas de hemoglobinas anormales inestables de varios tipos. Estos últimos tienen la capacidad de precipitarse y caer en los eritrocitos en forma de "cuerpos de inclusión", dándoles la forma de dianas.
Clasificación de las talasemias:
1. Talasemia causada por una síntesis alterada de la cadena de globina α (talasemia α y enfermedades causadas por la síntesis de hemoglobina H y Brats).
2. Talasemia causada por una síntesis alterada de las cadenas β y δ de globina (β-talasemia y β-, δ-talasemia).
3. Persistencia hereditaria de la hemoglobina fetal, es decir, un aumento determinado genéticamente de la hemoglobina F en los adultos.
4. Grupo mixto: estados doblemente heterocigotos para el gen de la talasemia y el gen de una de las hemoglobinapatías "cualitativas".
α-talasemia. El gen responsable de la síntesis de la cadena α está codificado por dos pares de genes ubicados en el cromosoma 11. Uno de los pares es manifiesto, el otro es secundario. En el caso del desarrollo de α-talasemia, se produce una deleción genética. Con la disfunción homocigótica de los 4 genes, la cadena α de globina está completamente ausente. Se sintetiza la hemoglobina Brats, que consta de cuatro cadenas γ que no pueden transportar oxígeno.
Los portadores de α-talasemia homocigótica no son viables: el feto muere en el útero debido a la hidropesía.
Una de las formas de α-talasemia es la hemoglobinopatía H. En esta patología, se produce una deleción de tres genes que codifican la síntesis de las cadenas α de hemoglobina. Debido a una deficiencia de cadenas α, se sintetiza hemoglobina H anormal, que consta de 4 cadenas β. La enfermedad se caracteriza por una disminución en el número de eritrocitos, hemoglobina (70-80 g/l), hipocromía severa de los eritrocitos, su apariencia diana y puntuación basófila. El número de reticulocitos aumenta moderadamente.
La deleción en uno o dos genes que codifican la cadena α causa una ligera deficiencia de hemoglobina A y se manifiesta por una anemia hipocrómica leve, la presencia de puntos basófilos y glóbulos rojos diana y un ligero aumento en el recuento de reticulocitos. Al igual que con otras formas de anemia hemolítica, con la α-talasemia heterocigótica, se observa decoloración ictérica de la piel y las membranas mucosas y un aumento de la bilirrubina indirecta en la sangre.
β-talasemia. Es más común que la α-talasemia y se puede encontrar en formas homocigotas y heterocigotas. El gen que codifica la síntesis de la cadena β se encuentra en el cromosoma 16. Cerca se encuentran los genes responsables de la síntesis de las cadenas γ y δ de globina. En la patogénesis de la β-talasemia, además de la deleción genética, hay una violación del empalme, lo que conduce a una disminución de la estabilidad del ARNm.
β-talasemia homocigota (enfermedad de Cooley). La enfermedad se detecta con mayor frecuencia en niños de 2 a 8 años. Aparece ictericia, decoloración de la piel y las membranas mucosas, agrandamiento del bazo, deformaciones del cráneo y el esqueleto y retraso en el crecimiento. En las formas graves de β-talasemia homocigótica, estos síntomas aparecen ya en el primer año de vida del niño. El pronóstico es desfavorable.
Desde el lado de la sangre, se detectan signos de anemia hipocrómica grave (PC alrededor de 0,5), una disminución de la hemoglobina a 20-50 g/l, el número de glóbulos rojos en la sangre periférica es de 1-2 millones por día.
β-talasemia heterocigótica. Se caracteriza por un curso más benigno, los signos de la enfermedad aparecen a una edad más avanzada y son menos pronunciados. La anemia es moderada, el contenido de glóbulos rojos es de aproximadamente 3 millones por micrón, la hemoglobina es de 70-100 g/l. El contenido de reticulocinas en sangre periférica es del 2-5%. A menudo se detectan aniso y poiquilocitosis, eritrocitos en forma de diana; son típicos los eritrocitos basófilos perforados. El contenido de hierro en suero suele ser normal y, con menos frecuencia, ligeramente aumentado. En algunos pacientes, la bilirrubina sérica indirecta puede estar ligeramente aumentada.
A diferencia de la forma homocigótica, con la β-talasemia heterocigótica no hay deformidades esqueléticas ni retraso del crecimiento.
El diagnóstico de β-talasemia (formas homocigotas y heterocigotas) se confirma mediante un aumento en el contenido de hemoglobina fetal (HbF) y HbA2 en los eritrocitos.
Enlace bibliográfico
Chesnokova N.P., Morrison V.V., Nevvazhay T.A. TEMA 5. ANEMIA HEMOLÍTICA, CLASIFICACIÓN. MECANISMOS DE DESARROLLO Y CARACTERÍSTICAS HEMATOLÓGICAS DE LA ANEMIA HEMOLÍTICA CONGÉNITA Y HEREDITARIA // Revista Internacional de Ciencias Aplicadas y investigación básica. – 2015. – N° 6-1. – págs. 162 a 167;URL: https://applied-research.ru/ru/article/view?id=6867 (fecha de acceso: 18/07/2019). Llamamos su atención sobre las revistas publicadas por la editorial "Academia de Ciencias Naturales".
FISIOPATOLOGÍA DEL SISTEMA SANGUÍNEO. ANEMIA DISERITROPOÉTICA.
MINISTERIO DE EDUCACIÓN DE LA REPÚBLICA KIRGUIZUNIVERSIDAD ESLAVA KIRGUIZ-RUSA
DEPARTAMENTO DE FISIOLOGÍA NORMAL Y PATOLÓGICA KRSU
Facultad de Medicina
especialidad "Medicina General"
FISIOPATOLOGÍA
SISTEMAS SANGUÍNEOS.
DISERITROPOÉTICO
ANEMIA.
La conferencia fue preparada por: Candidato de Ciencias Médicas, Profesor Asociado del Departamento de Investigación y Educación Física Pak I.V.
Esquema de la conferencia
Etiología y patogénesis de la anemia ferropénica.Principales manifestaciones clínicas.
Etiopatogenia de la B-12 y la anemia por deficiencia de folato.
Base fisiopatológica de los principales
síndromes clínicos y cambios hematológicos.
Anemia aplásica, etiología y patogénesis.
Principios básicos y métodos de terapia.
anemias diseritropoyéticas.
Diagnóstico diferencial de la anemia.
Anemias diseritropoyéticas Anemias diseritropoyéticas NÓTESE BIEN.!
Eritropoyesis normal
posible si el cuerpo tiene
cantidad suficiente
aminoácidos, hierro,
vitaminas B1, B2, B6, B12, C,
ácido fólico,
microelementos Co, Cu, etc.
sustancias.
Anemias diseritropoyéticas Mantenimiento de la eritropoyesis.
Para una eritropoyesis efectiva especialmente
las siguientes sustancias son importantes:
Vitamina B12
Ácido fólico
Importante para la síntesis
ADN celular
Hierro
parte de la hemoglobina
Anemias diseritropoyéticas
Clasificación
Anemias diseritropoyéticas Anemias diseritropoyéticas Etiopatogeniadeficiencia de hierro
anemia
Anemias diseritropoyéticas Epidemiología
Datos de la OMS, 2004:
Anemia
2.000.000.000
ZhDA
1.800.000.000
(El 90% de los casos de anemia son causados por deficiencia de hierro)
Deficiencia de hierro
3.580.000.000
La anemia por deficiencia de hierro es el primero en
lista de las 38 enfermedades más comunes por
Según la OMS. Información histórica
datos de IA
Histórico
epidemiología de la IDA
ZhDA
epidemiología
Durante siglos, la clorosis o "pálido
enfermedad" se consideraba un signo de amor no correspondido y se atribuía
a enfermedades del período juvenil.
En 1832 Pierr Blaud descubrió la eficacia del sulfato.
hierro en clorosis. Desde entonces, la clorosis comenzó a atribuirse a
enfermedades de la sangre.
La AIF representa del 80 al 90% de todas las anemias.
Prevalencia: 0,2% hombres, 2,6% mujeres.
Rusia:
IDA en 9-13% de las mujeres
Ucrania:
AIF en el 20% de la población
Asia Central: IDA en 50-60% de las mujeres.
Anemias diseritropoyéticas
Metabolismo del hierro
glándulaMetabolismo
comida de hierro
10-20 mg/día
10 %
Pérdida de heces
10-20 %
orina, epitelio
1-2 mg/día
deposito
100-400 mg
succión
en el tracto gastrointestinal 1-2 mg/día
75 %
Otro
procesos
Plasma
transferrina 4 mg
Eritroblastos
Síntesis de Hb
5-15 %
macrófagos
las células rojas de la sangre
destrucción 1/120 día
Anemias diseritropoyéticas
DISTRIBUCIÓN DEL HIERRO EN EL CUERPO
DISTRIBUCIÓN DE HIERROHIERRO B
EN
DISTRIBUCIÓN
ORGANISMO
ORGANISMO
hemo (protoporfirina y Fe++)
hemoglobina - 75% è Transporte de O2
mioglobina - 5-15% è reserva de O2 en los músculos
enzimas - 0,3% и respiración celular
no hemo
transferrina - 0,1% è transferencia de Fe+++ del plasma al tejido
ferritina y hemosiderina – 10-20% è depósito de hierro en
hígado
Anemias diseritropoyéticas El papel del hierro en el cuerpo humano.
almacenamiento y
transporte
oxígeno
energético
intercambio
metabolismo
BAV
división
células
biosintético
procesos
Anemias diseritropoyéticas Falta de hierro en
cuerpo
o La deficiencia de hierro en el cuerpo ocurre cuando
si el suministro de mineral
sustancias menos de 1 mg por día.
La deficiencia de hierro en el cuerpo humano se reduce no sólo a
manifestaciones hematológicas, pero también determina
disfunción de todas las células (especialmente en pacientes con alto nivel de
tejidos aeróbicos), provocando consecuencias negativas
Trastornos del metabolismo del hierro en el cuerpo humano.
Deficiencia de este oligoelemento vital.
conduce inevitablemente a la interrupción de la educación
hemoglobina, el desarrollo de anemia y, como consecuencia, a
Trastornos tróficos en órganos y tejidos.
Anemias diseritropoyéticas
La anemia por deficiencia de hierro
- Este condición patológica, caracterizadauna disminución en la cantidad de hemoglobina y glóbulos rojos debido a:
falta de ingesta de hierro
mayor necesidad de hierro
pérdida excesiva de hierro
Anemias diseritropoyéticas
La anemia por deficiencia de hierro
La anemia por deficiencia de hierro -condición patológica,
caracterizado por una disminución en la cantidad
hemoglobina por unidad de volumen de sangre,
que se debe a un desequilibrio entre
recibo, uso (gasto
o pérdida) de hierro en el cuerpo.
Anemias diseritropoyéticas
pérdida crónica de sangre (uterina,
gástricos, hemorroidales, tumores)
ingesta insuficiente de Fe de los alimentos
Malabsorción de Fe (patología gastrointestinal)
aumento de la ingesta de Fe durante el crecimiento y
desarrollo infantil, durante la lactancia y
embarazo, durante intenso ejercicio físico
cargas
Anemias diseritropoyéticas
Etiología de la anemia por deficiencia de hierro.
Anemias diseritropoyéticasPATOGENIA DE LA AIF
disminución de las reservas de hierro▼
reducción de contenido hierro sérico
▼
aumentar la capacidad total de fijación de hierro del suero con
Disminución de la saturación de transferrina con hierro.
▼
Disminución de la incorporación de hierro en las células eritroides.
▼
disminución de la síntesis de hemo (aumento de protoporfirina en eritroides)
células)
▼
La anemia por deficiencia de hierro
Anemias diseritropoyéticas
Principales manifestaciones clínicas de la anemia ferropénica.
Hematológicosíndrome
hemico
hipoxia
- piel pálida y
membranas mucosas
- taquicardia
- dificultad para respirar
- mareos,
dolor de cabeza
- pérdida de memoria y
atención
- Debilidad general,
fatiga
Sideropénico
síndrome
↓Contenido de Fe(S)
El hierro sérico es normal.
en hombres – 13-30 µmol/l,
en mujeres – 11,5-25 µmol/l
- piel seca
- uñas quebradizas y
cabello
- alteraciones del gusto
- deterioro del sentido del olfato
Anemias diseritropoyéticas Anemias diseritropoyéticas Anemias diseritropoyéticas Anemias diseritropoyéticas
síndrome sideropénico
El “síndrome de hiposiderosis” es causado por una deficiencia de tejido.Hierro, que conduce a una disminución en la actividad de muchas enzimas.
(citocromo oxidasa, peroxidasa, succinato deshidrogenasa, etc.).
Señales:
perversión del gusto (pica chlorótica) - deseo irresistible
comer cualquier cosa inusual y no comestible (tiza,
polvo, carbón, arcilla, arena, hielo), así como masa cruda, carne picada, cereales; este
El síntoma es más común en niños y adolescentes, pero con bastante frecuencia en
mujeres adultas; adicción a alimentos picantes, salados, ácidos y picantes;
perversión del olfato: adicción a los olores que
son percibidos por la mayoría como desagradables (gasolina,
queroseno, acetona, olor a barnices, pinturas, betún, naftaleno, etc.);
debilidad y fatiga muscular severa, atrofia muscular y
Disminución de la fuerza muscular debido a la deficiencia de mioglobina y enzimas.
respiración tisular;
cambios distróficos en la piel y sus apéndices (sequedad,
descamación, tendencia a la rápida formación de grietas en la piel;
embotamiento, fragilidad, caída del cabello, encanecimiento prematuro del cabello; adelgazamiento,
fragilidad, estrías cruzadas, embotamiento de las uñas; síntoma
coiloniquia - concavidad de las uñas en forma de cuchara);
Anemias diseritropoyéticas
síndrome sideropénico
estomatitis angular - grietas; Glositis (en el 10% de los pacientes): caracterizada poruna sensación de dolor e hinchazón en el área de la lengua, enrojecimiento de la punta y en
mayor atrofia de las papilas (lengua lacada); observado a menudo
tendencia a la enfermedad periodontal y caries;
cambios atróficos en la membrana mucosa del tracto gastrointestinal
- esto se manifiesta por sequedad de la mucosa del esófago y dificultades, y
a veces dolor al tragar alimentos, especialmente alimentos secos (disfagia sideropénica);
desarrollo de gastritis atrófica y enteritis.
síntoma de “esclerótica azul” (caracterizada por un color azulado o pronunciada
esclerótica azul. Esto se explica por una violación de la síntesis de colágeno en la esclerótica, esto
se adelgaza y brilla coroides ojos.
necesidad imperiosa de orinar, incapacidad para retener la orina cuando
reír, toser, estornudar y posiblemente incluso mojar la cama, que es causado por
debilidad de los esfínteres de la vejiga;
fiebre baja sideropénica, caracterizada por un aumento prolongado
temperaturas hasta niveles subfebriles,
predisposición pronunciada a infecciones virales respiratorias agudas y
otros procesos infecciosos e inflamatorios, infección crónica, que
causado por una violación de la función fagocítica de los leucocitos y el debilitamiento
sistema inmune;
Reducción de procesos reparadores en la piel y mucosas.
Anemias diseritropoyéticas
COILONIQUIA
Anemias diseritropoyéticas Anemias diseritropoyéticas NÓTESE BIEN.Los sideroblastos son
eritrocariocitos óseos
cerebro que contiene hierro
(normal 20-40%)
Anemias diseritropoyéticas Criterios principales para la AIF
índice de color bajo
hipocromía de eritrocitos
microcitosis
disminución de los niveles séricos de hierro
aumento de la unión total de hierro
habilidades séricas
disminución de los niveles de ferritina sérica
Anemias diseritropoyéticas
Signos diagnósticos de deficiencia de hierro y anemia por deficiencia de hierro.
Etapasdéficit
glándula
ferritina
suero
Hierro
suero
Prelatente
(oculto)
disminuir
Latente
(oculto)
disminuir
disminuir
disminuir
disminuir
Hemoglobina
Explícito
disminuir
Condiciones de deficiencia de hierro
Anemias diseritropoyéticasTRATAMIENTO DE LA AIF
Eliminando las causasdesarrollo de anemia
Administración de suplementos de hierro.
Terapia dietética
La dieta no es
no es
es el presentador
factor principal
factor en la recuperación
restauracion
Dieta
balanza de hierro
planchar en
durante el tratamiento
tratamiento de la anemia!
¡anemia!
balance
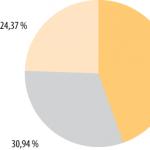
Fuentes de hierro nutricional
Fuentes de nutriciónhierro nutricional
glándula
Fuentes
Quesos
1% pan
frutas
5%
8%
58%
carne
10%
18%
Verduras
papas fritas
Anemias diseritropoyéticas Criterios para una eficacia
terapia efectiva
Terapia IDA
ZhDA
Criterios
Días 5-7: crisis de reticulocitos
de 3 a 4 semanas: normalización de Hb, Ht,
eritrocitos
a partir de 10 semanas:
normalización
ferritina (Fedepo)
Anemias diseritropoyéticas Razones de ineficacia
ineficaz
Causas
tratamiento de anemia
anemia
tratamiento
dosis insuficiente de hierro
absorción deficiente de hierro en el tracto gastrointestinal
rechazo de suplementos de hierro debido a
efectos secundarios
prematuro
cancelar cuando llegue
nivel normal de HB
Anes diseritropoyéticos Duración de la terapia
terapia de deficiencia de hierro
deficiencia de hierro
Duración
anemia (OMS,
(OMS, 2001)
2001)
anemia
Llenar el déficit
hierro, incluyendo
reposición del depósito de hierro,
debería durar hasta las 6
meses
para advertir
recaída
Anemia por deficiencia de hierro. Evaluación, Prevención y Control, OMS, 2001
Anemias diseritropoyéticas Prematuro
Despachador de drogas
glándula - principal
causa de recaída
anemia
Anes diseritropoyéticos
NECESIDAD DE CORRECCIÓN
CORRECCIONESNECESIDAD
niños, adolescentes
Atletas
embarazada, lactante
anciano
mujeres en edad reproductiva,
menstruando mucho
Anemias diseritropoyéticas Etiopatogenia
B y deficiencia de folato
anemia
12
Anemias diseritropoyéticas
Referencia histórica
En 1855 medico ingles Thomas Addison y luego en 1872año con más detalle medico aleman Antón Birmer describió
una enfermedad llamada maligna (perniciosa)
anemia. Pronto el médico francés Armand Trousseau sugirió
llame a esta enfermedad anemia de Addison y anemia
Addison - Cervecero.
En 1926, J. Whipple, J. Minot y W. Murphy informaron:
Qué anemia perniciosa se puede tratar añadiendo a la dieta
Nutrición del hígado crudo y cuál es la base de la enfermedad.
Incapacidad congénita del estómago para secretar una sustancia.
Necesario para la absorción de vitamina B12 en el intestino. Detrás
Recibieron el Premio Nobel por este descubrimiento en 1934.
Anemias diseritropoyéticas Anemia asociada con el trastorno.
Síntesis de ADN y ARN.
NÓTESE BIEN.
Vitamina B y ácido fólico.
participar en las principales etapas
intercambio de purina y pirimidina
Bases en el proceso de síntesis de ADN y ARN.
El cuerpo contiene 4 mg de reserva.
vitamina B12, que es suficiente para 4
del año.
12
Anemias diseritropoyéticas
Metabolismo de la B12 en el cuerpo.
A LAS 12metilcobalamina
síntesis de ADN
división celular
adenosinecobalamina
- regula la síntesis de ácidos grasos
ácidos
- participa en la educación
ácido succínico de
ácido metilmalónico
Anemias diseritropoyéticas
Metabolismo de la vitamina B12 (cianocobalamina)
Metabolismo de la vitamina B (cianocobalamina)12
Ingesta de B12 a través de los alimentos (requerimiento diario 1 mcg) +
factor interno Castla en el estómago (gastromucoproteína)
Absorbido en el íleon
Metilcobalamina
Ácido fólico
ácido tetrahidrofólico
síntesis de ADN
hematopoyesis normal
Vena porta
Hígado (depósito B1212)
En sangre B12 + transcobalamina-2
5-desoxiadenosilcobalamina
Ácido metilmalónico (tóxico)
+ ácido propiónico
ácido succínico
Metabolismo de los ácidos grasos
B12 - anemia por deficiencia de folato
- condición patológica,caracterizado por una disminución
cantidad de hemoglobina y glóbulos rojos en
unidad de volumen de sangre que
debido a la sustitución de normoblásticos
tipo de hematopoyesis en
tipo megaloblástico debido a
trastornos de la síntesis de ácidos nucleicos
en condiciones de deficiencia de vitamina B12 y/o
ácido fólico.
Anemias diseritropoyéticas
Etiología de la anemia por deficiencia de B12
déficitEl factor externo del castillo.
– vitamina B12 con los alimentos
déficit
factor interno
Kastla es una gastromucoproteína sintetizada por parietal.
células del estómago, protege vital. A LAS 12
de la destrucción
Anemias diseritropoyéticas
Causas de la deficiencia de vitamina B12
Causas de la deficiencia de vitamina B1.
2.
3.
12
Contenido insuficiente de B12 en los alimentos (factor Castle externo).
Malabsorción:
a)
violación de la síntesis de gastromucoproteínas (factor Castle interno):
gastritis atrófica del fondo del estómago;
Reacciones autoinmunes con la producción de anticuerpos contra las células parietales.
estómago y gastromucoproteína;
gastrectomía (después de la gastrectomía, la vida media de B12 es de 1 año;
después de la gastrectomía, los signos de deficiencia de B12 aparecen después de 4-5 años);
cáncer de estómago;
deficiencia congénita de gastromucoproteínas;
b)
absorción deficiente de B12 en el intestino delgado;
enfermedades intestino delgado acompañado del síndrome
malabsorción (enteritis crónica, enfermedad celíaca (glutenenteropatía),
SPRU (diarrea tropical), enfermedad de Crohn)
resección ileal;
cáncer de intestino delgado;
ausencia congénita de receptores para el complejo de vitamina B12 +
gastromucoproteína en el intestino delgado;
C)
absorción competitiva de vitamina B12;
amplia infestación por tenia;
disbiosis intestinal pronunciada.
Disminución de la producción de transcobalamina-2 en el hígado y alteración del transporte.
vitamina B12 en la médula ósea (para la cirrosis del hígado).
Anemias diseritropoyéticas
PATOGENIA del MBA
Los principales vínculos patogénicos en el desarrollo de la anemia por deficiencia de B12.
Deterioro de la síntesis de ADN en células hematopoyéticas.principalmente eritroblastos
Trastorno de división celular
Tipo embrionario de hematopoyesis (megaloblástica)
Los megaloblastos rara vez maduran hasta convertirse en megalocitos debido a su hemólisis en
médula ósea y no proporcionan función hematopoyética (aumento
contenido de bilirrubina no conjugada, urobilina, estercobilina, m.b.
aumento de hierro sérico con hemosiderosis de órganos internos)
El núcleo celular madura lentamente, el protoplasma tiene un contenido aumentado.
Нb – hipercromía (cuerpos de Jolly, anillos de Cabot), hipersermonuclearidad
neutrófilos
Anemias diseritropoyéticas
Principales síndromes clínicos de la anemia por deficiencia de B12
síndrome hematológico(manifestado por pancitopenia → hipoxia,
sangrado, inmunodeficiencia)
Gastroenterológico
síndrome (manifestado por atrófico
glositis, gastritis, enteritis → violación
funciones gastrointestinales
síndrome neurológico
(manifestado por mielosis funicular → tembloroso
marcha, alteración sensorial
Anemias diseritropoyéticas
síndrome hematológico
alteración de la proliferación y maduración de FEC
transición de normoblástico a
tipo megaloblástico de hematopoyesis
formación de FEC con baja resistencia,
esperanza de vida corta
anemia, leucopenia, trombocitopenia
Anemias diseritropoyéticas Anemias diseritropoyéticas Anemias diseritropoyéticas
Justificación patogenética de los principales síndromes clínicos de B12: anemia por deficiencia
Síndrome gastroenterológicoalteración de la división y maduración celular en la mucosa
tracto gastrointestinal
atrofia de la mucosa gastrointestinal
Inflamación de varias partes del tracto gastrointestinal (glositis,
estomatitis, enterocolitis, etc.) – disfunción
Anemias diseritropoyéticas
Justificación patogenética de los principales síndromes clínicos de la anemia por deficiencia de B12.
síndrome neurológicoalteración de la síntesis de ácidos grasos
acumulación de ácido metilmalónico
efecto tóxico sobre la mielina
mielosis funicular (degeneración de la región posterior y
columnas laterales de la médula espinal)
Anemias diseritropoyéticas
Principales criterios diferenciales para la anemia por deficiencia de B12
Síndrome hematológico:anemia hipercrómica (CP superior a 1,1-1,3);
anisocitosis (megalocitosis), poiquilocitosis,
granularidad basófila, anillos de Cabot, corpúsculos
Alegre;
citopenia trilineal;
neutrofilosis hipersegmentaria;
tipo megaloblástico de hematopoyesis (según
datos de punción esternal);
la disminución de B12 en sangre es inferior a 200 pg/ml;
Anemias diseritropoyéticas Anemias diseritropoyéticas
Médula ósea en la anemia por deficiencia de B12
Prevalecereritromegaloblastos con
maduración retrasada
granos.
En la preparación hay gigantes
apuñalar y
polisegmental
neutrófilos.
Anemias diseritropoyéticas Anemias diseritropoyéticas
Cuadro de sangre periférica en la anemia por deficiencia de B12
imagen de sangre periféricaAnemia por deficiencia de B
12
Anemias diseritropoyéticas Anemia por deficiencia de folato
Menos común que la deficiencia de B12
La reserva de FA en el cuerpo está diseñada para 2-3 meses.
FC está presente en todos los productos; cuando se calienta,
Esta destruido
Absorbido por todo el yeyuno, tal vez. diarrea
Las proteínas transportadoras no son necesarias para la absorción de AG.
Los defectos de nacimiento del FC se combinan con problemas mentales.
retraso y no se corrigen ingresando FC
Anemias diseritropoyéticas
Causas de la anemia por deficiencia de folato
deficiencia nutricional (frecuentecausa en ancianos);
enteritis con malabsorción;
tomando ciertos medicamentos que deprimen
síntesis de ácido fólico (metotrexato,
triamtereno, anticonvulsivos,
barbitúricos, metformina);
intoxicación crónica por alcohol;
mayor necesidad de ácido fólico
(tumores malignos, hemólisis,
dermatitis exfoliativa, embarazo).
Anemias diseritropoyéticas
Anemia por deficiencia de folato
anemiaDeficiencia de folato
Ingesta profiláctica de ácido fólico.
reduce el riesgo patología congénita hasta 70%
La OMS recomienda su uso obligatorio
ácido fólico durante el embarazo!!!
Anemias diseritropoyéticas
Principales criterios diferenciales para la anemia por deficiencia de folato
Datos históricos:el embarazo,
período neonatal,
alcoholismo crónico,
hemólisis crónica,
enfermedades mieloproliferativas,
tomando medicamentos (antagonistas del ácido fólico,
antituberculosos, anticonvulsivos).
La eritropoyesis sufre.
No hay mielosis funicular ni daño gástrico.
No hay crisis de reticulocitos al tomar B12.
En la médula ósea, sólo los megaloblastos se tiñen con el tinte.
con anemia por deficiencia de B12 y con anemia por deficiencia de folato -
No.
Reducción del ácido fólico en sangre inferior a 3 mg/ml (N – 3-25
mg\ml).
Anemias diseritropoyéticas
Tratamiento de las anemias megaloblásticas.
Vitamina B12 (cianocobalamina): 400-500 mcg por vía intramuscular (4-6 semanas).Para trastornos neurológicos: B12 (1000 mcg) + cobalamida
(500 mcg) hasta que desaparezcan los síntomas neurológicos.
Si es necesario, administración de por vida de B12 (500 mcg) 1 vez cada 2
semanas o tratamiento preventivo: B12 (400 mcg) durante 1015 días 1-2 veces al año.
Transfusión de eritromasa únicamente signos vitales(en
todas las anemias!):
Nevada< 50 г/л,
Nevada< 70 г/л с нарушением гемодинамики,
desarrollo de precoma y coma, preparación urgente para la cirugía y
etc.
Desparasitación: eliminación de la tenia (fenosal,
helecho macho).
Ácido fólico 5-15 mg/día (hasta 30 mg/día); preventivo
dosis – 1-5 mg/día.
Anemias diseritropoyéticas
Criterios de eficacia del tratamiento.
mejora subjetiva enprimeros días de tratamiento;
crisis de reticulocitos a las 5-7
día de tratamiento (para anemia por deficiencia de B);
12
mejora en los recuentos sanguíneos
segunda semana de tratamiento, desde
normalización después de 3-4 semanas.
Anemias diseritropoyéticas Etiopatogenia
aplásico
anemia
Anemias diseritropoyéticas
Anemia aplásica
ANEMIA APLASTICA – hematológicasíndrome causado por un número grande endógeno y
factores exógenos, cualitativos y
cambios cuantitativos en las células madre y sus
microambiente, morfológico cardinal
un signo de lo cual es la pancitopenia en
sangre periférica y degeneración grasa
médula ósea.
P. Ehrlich (1888) describió por primera vez AA.
El término “anemia aplásica” se introdujo en 1904.
Soffar.
La incidencia es de 4 a 5 personas por 1 millón de habitantes por año (en
Europa)
Edad picos de incidencia 20 y 65 años
Anemias diseritropoyéticas
Anemia aplásica
Anemias diseritropoyéticas Factores etiológicos de AA.medicamentos,
sustancias químicas,
virus,
procesos autoinmunes;
en el 50% de los casos la etiología es desconocida (AA idiopática).
Patogénesis de la AA
daño a las células madre sanguíneas pluripotentes
supresión de la hematopoyesis
acción de la inmunidad (celular, humoral)
mecanismos
deficiencia de factores que estimulan la hematopoyesis
hierro, B12, protoporfirina no pueden ser
utilizado por el tejido hematopoyético.
Anemias diseritropoyéticas La anemia aplásica puede ser
1.
Congénito (con síndrome anomalías congénitas o sin él)
2.
Adquirido
AA se libera aguas abajo
3.
Picante
4.
lo afilaré
5.
Crónico
Formularios AA
6.
Inmune
7.
No inmune
Síndromes clínicos de AA
8.
Circulatorio-hipóxico
9.
Séptico-necrótico
10.
Hemorrágico
Anemias diseritropoyéticas
Anemia aplásica
Anemias diseritropoyéticasAplasia de médula ósea
PRINCIPIOS, METAS Y MÉTODOS DE TRATAMIENTOANEMIA DISERITROPOÉTICA
PRINCIPIOS
OBJETIVOS
ETIOTROPICO
Eliminar
disminuir
grado
violaciones
división y
diferenciación
eritrocariocito
V
MÉTODOS
* Terminación
comportamiento
factores,
principal
a la hipoplasia
hueso
cerebro
*Introducción
"escaso"
factores - razones
anemia
(vitaminas B12,
B6, fólico
ácidos,
PATÓGENO
SINTOMÁTICO
Eliminar
disminuir
grado
hipoxia
prevenir,
disminuir
grado
hemosiderosis
Ajustar
kshchr
Eliminar
disminuir
grado
consecuencias
hipoxia
Eliminar
desagradable
Sentir
* Uso
* Corrección de función
cardiovascular
sistema, riñones,
hígado,...
antihipoxantes,
antioxidantes
*Introducción
buffer
soluciones
Anemias diseritropoyéticas
Diagnóstico diferencial de anemia.
Anemias diseritropoyéticasDiagnóstico diferencial de anemia.
SeñalesZhDA
AEA
Georgia
MBA
Automóvil club británico
UPC
<1
<1
norte (talasemia
< 1)
>1
norte
Reticulocitos
norte o ↓
norte o ↓
norte o ↓
↓↓
Syv. fe
↓
Ni
Ni
Ni
Plaquetas
norte
norte
norte o ↓
↓
↓↓↓
Leucocitos
norte
norte
norte
↓
↓↓↓
Bazo
norte
norte
a menudo
megabyte
norte
Hígado
norte
a menudo
a menudo
a menudo
norte
Médula ósea
moderado
hiperplasia
germen de eritrocitos,
sideroblastos
↓↓.
moderado
hiperplasia
germen de eritrocitos,
sideroblastos
pronunciado
hiperplasia
germen de eritrocitos.
megaloblasto
tipo largo
hematopoyesis
nia
opresión
Anemias diseritropoyéticas ¡Gracias por su atención!
Anemia poshemorrágica. Anemia hemolítica. Anemia (anemia)- una disminución en el nivel total de hemoglobina (Hb), que a menudo se manifiesta en una disminución por unidad de volumen de sangre; en niños menores de 6 años es inferior a 110 g/l, en mujeres adultas es inferior a 120 g/l, en hombres es inferior a 130 g/l. La verdadera anemia se diferencia de la pseudoanemia en el tamaño del hematocrito (en adultos es del 36 al 48%).
◊ En la mayoría de los casos, a excepción de la anemia ferropénica y la talasemia, la anemia se acompaña de una disminución del contenido de glóbulos rojos (por debajo de 3,9 · 10 · 12 / l).
La anemia se clasifica según varios principios.
A. Por indicador de color.
1. Normocrómico - 0,85-1,05
2. Hipercrómico: por encima de 1,05, pero no más de 1,60.
3. Hipocrómico: por debajo de 0,85.
B. Por el diámetro promedio de los glóbulos rojos.
1. Normocítico - 7-8 µm
2. Microcítico: menos de 6,5 micrones
3. Macrocítico: 8-12 micrones.
4. Megalocítico: más de 12 micrones.
B. Por la capacidad de regeneración de la médula ósea (por el contenido de reticulocitos).
1. Regenerativo - 1-5%.
2. Hiporegenerativo 0,5-1%.
3. Regenerativo: menos del 0,5%.
4. Hiperregenerativo: más del 5%.
D. Según el tipo de hematopoyesis.
1. Normoblástico.
2. Megaloblástico.
D. Según el principio etiopatogenético.
1. Anemia por pérdida de sangre (posthemorrágica):
a) agudo;
b) crónico.
2. Anemia por alteración de la hematopoyesis:
a) anemia por deficiencia (deficiencia de vitaminas, deficiencia de hierro)
deficiente en proteínas);
b) hipo y aplásico;
c) metaplásico;
d) desregulación.
3. Anemia por aumento de la destrucción de la sangre (hemolítica):
a) hereditario;
b) comprado.
ANEMIA POSTEMORRÁGICA AGUDA
Una condición asociada con la pérdida rápida de un volumen significativo de sangre (20-25% de la sangre en aproximadamente 1 hora). El factor que determina el grado de disfunción y su compensación es la hipovolemia incorregible.ETAPAS DE COMPENSACIÓN POR PÉRDIDA AGUDA DE SANGRE
Fase refleja de compensación. Ocurre el primer día después de una pérdida aguda de sangre debido a la activación del sistema simpatoadrenal: aumenta la resistencia vascular periférica, se produce una redistribución sanguínea (centralización de la circulación sanguínea). Sin embargo, la presión arterial disminuye, el retorno de sangre al corazón disminuye y, en consecuencia, el gasto cardíaco.Fase hidrémica de compensación. Ocurre entre el día 2 y 4 y consiste en el movimiento de líquido desde el espacio extracelular hacia los vasos. Uno de los mecanismos de la fase hidrémica es la hiperglucemia inducida por catecolaminas debido a la glucogenólisis en el hígado; el contenido de electrolitos básicos en el plasma permanece prácticamente sin cambios.
Fase de compensación de la médula ósea. En esta fase (5-7 días después de la pérdida aguda de sangre), es importante la activación de la formación de eritropoyetinas en los riñones en el contexto de una hipoxia grave.
En la primera vez después de la pérdida de sangre, debido a una disminución en el volumen del lecho vascular, una disminución en el contenido de hemo-
globina y glóbulos rojos, el indicador de hematocrito tampoco cambia.
Debido a la hidremia, comienza una caída gradual en los niveles de hemoglobina y glóbulos rojos: se forma una anemia normocrómica, que posteriormente se vuelve hipocrómica debido a la falta de hierro.
ANEMIA POSTEMORRÁGICA CRÓNICA
Anemia que se desarrolla como resultado de pérdidas repetidas de pequeños volúmenes de sangre durante el sangrado del tracto gastrointestinal, con sangrado renal, uterino, nasal y hemorroidal.La sangre periférica se caracteriza por una disminución del índice de color a 0,4-0,6, microcitosis, leucocitosis moderada con un desplazamiento neutrofílico hacia la izquierda. Con un curso prolongado de la enfermedad, la anemia adquiere un carácter hiporegenerativo.
ANEMIA ASOCIADA CON DETERIORO DE LA FORMACIÓN DE SANGRE
1. Desregulación- causado por una violación de la regulación de la hematopoyesis con una disminución en la producción de eritropoyetinas o un aumento en el número de sus inhibidores (enfermedad renal crónica, hipofunción de la glándula pituitaria, glándulas suprarrenales, glándula tiroides).2. Escaso- ocurre cuando faltan sustancias necesarias para la eritropoyesis (hierro, vitaminas, proteínas).
La anemia por deficiencia de hierro Representa hasta el 80% de toda la anemia y se desarrolla como resultado de un desequilibrio entre la ingesta de hierro en el organismo, su uso y su pérdida.
Se observan pérdidas de hierro con hemorragias repetidas y prolongadas: uterina, gastrointestinal, renal, pulmonar y con diátesis hemorrágica.
En algunos casos, la deficiencia nutricional de hierro (menos de 2 mg por día) es posible, por ejemplo, con una pequeña cantidad de consumo de carne, con alimentación artificial o con alimentación complementaria tardía en la infancia.
Se observa una absorción reducida de hierro en la gastritis hipoácida, la enteritis crónica o la resección de partes del tracto gastrointestinal.
La alteración del transporte de hierro es posible con hipotransferrinemia hereditaria o adquirida.
El aumento del consumo de hierro se desarrolla durante los períodos de crecimiento y maduración, durante el embarazo y la lactancia y en enfermedades inflamatorias crónicas.
La deficiencia de hierro se acompaña de un aumento de la eritropoyesis ineficaz y una disminución de la vida útil de los eritrocitos.
El cuadro sanguíneo se caracteriza por una disminución del contenido de hemoglobina (de 100 a 20 g/l), el contenido de eritrocitos puede ser normal o significativamente reducido y se detecta hipocromía. También son típicas la tendencia a la microcitosis, la poiquilocitosis y el carácter regenerativo o hiporegenerativo de la anemia.
En sangre periférica se encuentran: niveles séricos de hierro inferiores a 30 mcg/l; la capacidad total de fijación del hierro del suero sanguíneo es superior a 64,4 µmol/l; El contenido de ferritina en sangre es inferior a 40 mcg/l.
La deficiencia de hierro sérico se manifiesta por aumento de la fatiga, distorsión del gusto y el olfato, debilidad general y dolores de cabeza. La deficiencia de hierro también conduce a una disminución del nivel de mioglobina y de la actividad de las enzimas respiratorias de los tejidos. La consecuencia de la hipoxia son procesos degenerativos en órganos y tejidos. Son frecuentes las uñas estratificadas y quebradizas, estomatitis, caries, gastritis atrófica, etc.
ANEMIA POR DEFICIENCIA DE VITAMINA B12 (PERNICIOSA)
La deficiencia de vitamina B 12 puede desarrollarse debido a una violación de su suministro, absorción, transporte, depósito y asimilación a nivel de la médula ósea.La malabsorción es probable en ausencia del factor Castle interno (transcorrina), en procesos atróficos de la mucosa gástrica, en un trastorno selectivo hereditario de la producción de vitaminas, en la destrucción autoinmune y en la forma de deficiencia agástrica.
La absorción de vitamina B 12 está muy limitada en caso de daño generalizado al intestino delgado, en caso de enteritis, enfermedad celíaca y también durante su resección.
El papel patogénico del consumo competitivo de vitaminas se muestra en la invasión de la tenia ancha, así como en el síndrome del “intestino cecal” (cuando se realizan anastomosis, quedan áreas del intestino delgado a través de las cuales no pasa la comida), así como en diverticulosis múltiples del intestino delgado.
En algunos casos, la deficiencia de vitamina B12 se debe a la falta de transcobalamina.
La deficiencia de vitamina B12 provoca una alteración en la formación del ADN y, además, un trastorno en la división de las células hematopoyéticas, es decir, ralentizando el proceso mitótico y reduciendo el número de mitosis. En tales condiciones, se forma un tipo de hematopoyesis megaloblástica, similar a la embrionaria. El desarrollo de anemia está asociado con los siguientes mecanismos.
1. Disminución de la actividad mitótica.
2. Eritropoyesis ineficaz por destrucción intramedular de megaloblastos.
3. Hemólisis extravascular en el bazo debido al aumento de tamaño de los megalocitos.
4. Hemólisis intravascular por disminución de la resistencia osmótica de la membrana de los megalocitos.
En la sangre periférica se detecta anemia grave, predominantemente hipercrómica (índice de color - 1,3-1,5), hiporegenerativa. Son típicas la presencia de residuos nucleares, anisocitosis y poiquilocitosis. También se observan neutropenia y trombocitopenia.
La anemia por deficiencia de folato se acerca a la deficiencia de vitamina B 12 en su mecanismo de desarrollo y en su cuadro sanguíneo.
ANEMIA ASOCIADA CON DETERIORO DE LA SÍNTESIS O UTILIZACIÓN DE PORFIRINAS
Causadas por una deficiencia hereditaria o adquirida de enzimas involucradas en la síntesis de porfirinas o hemo, estas anemias suelen ser hipocrómicas, con un alto contenido de hierro en el cuerpo y, a menudo, se caracterizan por hemosiderosis de órganos.Se ha descrito una deficiencia hereditaria de coproporfirinógeno descarboxilasa, que sintetiza protoporfirina. Aparentemente, la enfermedad más a menudo se asocia con una violación de la síntesis de ácido aminolevulínico. Debido a trastornos en la síntesis de protoporfirina, la unión del hierro se vuelve imposible y se desarrolla anemia sideroacréstica.
La anemia adquirida de este tipo suele ocurrir con intoxicación por plomo. El plomo bloquea los grupos sulfhidrilo en los sitios activos de dos enzimas involucradas en la síntesis del hemo: la deshidrasa del ácido aminolevulénico y la hemo sintetasa. Como resultado-
El ácido aminolevulénico se acumula en la orina y en el eritrocito.
citah - protoporfirina.
También se detectó una disminución en la tasa de biosíntesis de globina (cadena-) y un aumento de la hemólisis. El plomo también es capaz de debilitar la actividad de las bombas de iones en la membrana de los glóbulos rojos, lo que reduce el nivel de iones de potasio y la vida útil de las células.
ANEMIA HIPO Y APLASTICA
Estas anemias son un conjunto de síndromes en los que, junto con la pancitopenia, se detecta inhibición de la hematopoyesis en la médula ósea.Según la etiología, la anemia aplásica se divide de la siguiente manera:
1. Genuino (idiopático), constitucional-hereditario, causado por alteración de la reactividad del cuerpo o insuficiencia endocrina.
2. Anemia aplásica asociada a la acción de factores dañinos: radiaciones, factores tóxicos (benceno, mercurio), citotóxicos (cloroetilamina, tioTEP, colchicina, 6-mercaptopurina, etc.), medicinales (amidopirina, barbitúricos, sulfonamidas, clorpromazina), infecciosos. ( hepatitis viral A, B, formas generalizadas de tuberculosis, fiebre tifoidea, salmonelosis, afecciones sépticas).
Los siguientes mecanismos son importantes en la patogénesis:
1. Número reducido de células madre o sus defectos.
2. Alteración del microambiente, que provoca cambios en las células madre.
3. Influencias inmunitarias que provocan trastornos del funcionamiento de las células madre. El cuadro sanguíneo se caracteriza por una anemia pronunciada, a menudo normocrómica, macrocítica e hiporegenerativa. Hay granulocitopenia y trombocitopenia significativas. La cantidad de mielcariocitos en la médula ósea disminuye. El cuadro clínico depende del grado de alteración de los gérmenes hematopoyéticos individuales y de sus combinaciones; incluye síndromes anémicos, trombocitopénicos y granulocitopénicos.
ANEMIA HEMOLÍTICA
Este grupo incluye diversas anemias asociadas con una mayor destrucción hereditaria de glóbulos rojos o con la acción de factores hemolíticos de origen exógeno.ANEMIA HEMOLÍTICA HEREDITARIA
1. Anemia asociada con alteración de la membrana de los eritrocitos (membranopatía). La microesferocitosis hereditaria (enfermedad de Minkowski-Choffard) es un tipo de herencia autosómica dominante, caracterizada por una mayor permeabilidad de la membrana de los eritrocitos y una ingesta excesiva de iones de sodio en la célula. Hay hinchazón de los glóbulos rojos, alteración de la capacidad de deformarse y disminución de su esperanza de vida, destrucción del bazo por los macrófagos.En la microesferocitosis, se reveló la ausencia o alteración de la unión de la proteína de membrana espectrina a la proteína 4.1. Se supone que se altera la formación de la forma tetramérica de espectrina a partir de la forma dimérica, así como la ausencia de proteínas de la membrana de los eritrocitos, denominadas 4.2.
Generalmente la anemia es normocrómica, regenerativa. Según el cuadro sanguíneo, difiere en diversos grados de gravedad, durante una crisis hemolítica es más grave, pero al mismo tiempo se desarrolla una reticulocitosis alta.
Las membranopatías también incluyen eliptocitosis (ovalocitosis), estomatocitosis (glóbulos rojos en forma de boca).
La acantocitosis es causada por una violación de la estructura lipídica de la membrana de los eritrocitos.
2. Anemia asociada con alteración de la actividad de las enzimas de los eritrocitos (enzimopatías). La deficiencia de las enzimas implicadas en la producción de energía en los glóbulos rojos puede provocar una alteración de la composición iónica, una menor resistencia a los agentes oxidantes y una disminución de la vida útil de estas células.
Se ha descrito una deficiencia hereditaria de las enzimas de la licólisis y del metabolismo del ATP (hexoquinasa, hexofosfato isomerasa, fosfofructoquinasa, piruvato quinasa, ATPasa).
La deficiencia de las enzimas del ciclo de las pentosas fosfato (glucosa-6-fosfato deshidrogenasa) conduce a una falta de NADP H2, necesario para la reducción del glutatión, un factor que resiste la acción de los agentes oxidantes. Esto sucede cuando hay una deficiencia de las enzimas de síntesis de glutatión: glutatión sintetasa, glutatión reductasa, glutatión peroxidasa.
En tales casos, se forma anemia de diversa gravedad. Generalmente normocrómico, con síntomas de anisocitosis, poiquilocitosis y policromasia. El contenido de reticulocitos aumenta, especialmente durante las exacerbaciones.
3. Anemia asociada con alteración de la estructura y síntesis de la hemoglobina (hemoglobinopatías). talasemia- un grupo de enfermedades hereditarias asociadas con una violación de la síntesis de una de las cadenas de hemoglobina (¸ ¸ ¸), lo que provoca un desequilibrio en su equilibrio. En este caso, la cadena excesivamente formada se agrega y se deposita en los eritrocariocitos.
La talasemia está determinada por la deleción de genes estructurales responsables de la síntesis de la cadena correspondiente. La síntesis de la cadena α está codificada por dos pares de genes ubicados en el par del cromosoma 11. La ausencia de la cadena β en el embrión provoca la muerte intrauterina.
La eliminación de 1 de 4 genes que codifican la síntesis de cadenas provoca una deficiencia leve, mientras que la eliminación de 2 genes provoca una deficiencia más grave. Si faltan 3 genes, se desarrolla la hemoglobinopatía H. La hemoglobina H consta de 4 cadenas, es inestable, se agrega fácilmente y el bazo la elimina fácilmente de la circulación.
La talasemia se caracteriza por anemia hipocrómica moderada con síntomas de eritrocitos en diana y puntuación basófila, reticulocitosis moderada.
La patogénesis de la talasemia es más compleja. El gen que codifica la síntesis de la cadena - se encuentra en el cromosoma 16, junto a él están los genes responsables de la síntesis de las cadenas - y -.
Algunas talasemias son causadas por trastornos de empalme (es decir, cambios que sufre el ARNm en su camino desde el núcleo, donde se sintetiza, hasta el citoplasma). Esto último puede provocar la desestabilización de la estructura. Debido a un trastorno en la síntesis de la cadena β, aparecen muchas cadenas β libres, lo que provoca una eritropoyesis ineficaz con una mayor destrucción de los eritrocariocitos en la médula ósea.
Anemia asociada con alteración de la estructura de las cadenas de globina. Están provocadas por la sustitución de uno o más aminoácidos en la cadena de globina, la ausencia de un tramo de la cadena o su alargamiento.
La anomalía más común de la estructura de la hemoglobina es la hemoglobinopatía S. En el caso de portador homocigótico, se dice anemia falciforme, y en caso de heterocigosidad, anomalía falciforme. La hoz es el resultado de la solubilidad reducida de la hemoglobina, que cede oxígeno para formar un gel.
La microscopía revela cristales que miden 1,5 micrones. Se supone que la sustitución del ácido glutámico por valina en la sexta posición conduce a una mayor unión de una molécula de globina a otra.
El cuadro sanguíneo se caracteriza por una disminución moderada en los niveles de hemoglobina y glóbulos rojos, el índice de color es cercano a uno. El frotis teñido muestra puntuación basófila, apariencia de diana y, a veces, glóbulos rojos con forma de hoz. La hoz es más pronunciada cuando se prueba con metabisulfito de sodio o después de aplicar un torniquete en la base del dedo. El contenido de reticulocitos aumenta significativamente.
ANEMIA HEMOLÍTICA ADQUIRIDA
ANEMIA HEMOLÍTICA INMUNE
Grupo heterogéneo de enfermedades., combinado por la participación de anticuerpos o linfocitos inmunes en el daño y muerte de los glóbulos rojos o eritrocariocitos.Anemias iso o aloinmunes puede desarrollarse con enfermedad hemolítica del recién nacido o con transfusión de sangre, no
compatible según el sistema AB0, Rhesus u otro sistema contra el cual el paciente tenga anticuerpos.
Anemias transinmunes Ocurre cuando los anticuerpos de una madre que sufre anemia hemolítica autoinmune atraviesan la placenta y causan anemia hemolítica en el feto.
Anemia heteroinmune (hapténica) asociado con la aparición de nuevos antígenos en la superficie de los eritrocitos (por ejemplo, como resultado de la fijación de medicamentos en los eritrocitos: penicilina, sulfonamidas). El hapteno a veces se convierte en virus, también fijado en la superficie del eritrocito.
Anemias hemolíticas autoinmunes- un grupo de enfermedades causadas por la formación de anticuerpos contra autoantígenos de eritrocitos o eritrocariocitos.
Además de las idiopáticas, también existen anemias autoinmunes sintomáticas; en ellos, la hemólisis se desarrolla en el contexto de otras enfermedades (tumores malignos de diversas localizaciones y hemoblastosis, lupus eritematoso sistémico, poliartritis reumatoide, estados de inmunodeficiencia).
La base patogénica más probable de la anemia hemolítica autoinmune es una alteración de la tolerancia inmunológica.
El cuadro sanguíneo muestra anemia leve, a menudo normocrómica, con un mayor contenido de reticulocitos. Durante las crisis hemolíticas, los recuentos sanguíneos se alteran en mayor medida, las crisis de reticulocitos son posibles con un aumento en el contenido de reticulocitos al 80-90%.
La anemia hipoplásica es una enfermedad del sistema sanguíneo, caracterizada por la inhibición de la función hematopoyética de la médula ósea y que se manifiesta por una formación insuficiente de glóbulos rojos, leucocitos y plaquetas (panhemocitopenia) o solo de glóbulos rojos (anemia hipoplásica parcial, eritroblastoptisis). La base del proceso patológico es una violación de la proliferación y diferenciación de las células de la médula ósea. Un signo característico de esta enfermedad del sistema sanguíneo es el agotamiento completo (aplasia) de la médula ósea y un deterioro profundo de su función, que se acompaña de anemia grave, leucopenia y trombocitopenia. La producción insuficiente de células por parte de la médula ósea determina los principales mecanismos de desarrollo de la enfermedad: síndrome anémico, complicaciones infecciosas por granulocitopenia y síndrome hemorrágico.
Los principales factores etiológicos de la anemia hipoplásica son: radiaciones ionizantes; insecticidas; fármacos citostáticos; otros medicamentos; anticuerpos contra las células de la médula ósea; infecciones virales (hepatitis viral); factores hereditarios; Anemia hipo y aplásica idiopática.
imagen de sangre
Al examinar la sangre periférica, se observan pancitopenia, anemia grave con reticulocitosis baja y anisopoicilocitosis pronunciada. El contenido de hemoglobina desciende a 15-20 g/l. Leucopenia, trombocitopenia de diversos grados. Aceleración brusca de la VSG: hasta 60-80 min/h. Un estudio de la hematopoyesis de la médula ósea en la anemia aplásica revela un cuadro de agotamiento casi completo de la médula ósea
Patogénesis
Actualmente, los principales factores patogénicos de la anemia aplásica son:
- · daño a las células madre hematopoyéticas pluripotentes;
- · daño al microambiente celular de la célula madre hematopoyética y alteración indirecta de su función;
- · inmunodepresión de la hematopoyesis y apoptosis de las células madre hematopoyéticas;
- acortar la vida de los glóbulos rojos;
- · trastorno metabólico de las células hematopoyéticas.
Daño a las células madre hematopoyéticas pluripotentes.-- el factor patogénico más importante de la anemia aplásica. La célula madre es el antepasado de todas las células hematopoyéticas. Con la anemia aplásica, la capacidad de la médula ósea para formar colonias se reduce significativamente, se altera la proliferación de células hematopoyéticas y, en última instancia, se forma el síndrome de pancitopenia: leucopenia, anemia, trombocitopenia. El mecanismo de inhibición de la actividad de las células madre hematopoyéticas pluripotentes no se ha dilucidado por completo.
Cuadro clinico
Los principales síntomas clínicos y de laboratorio de la anemia hipo y aplásica adquirida con daño a los tres brotes hematopoyéticos de la médula ósea son causados por la inhibición total de la hematopoyesis, así como por la hipoxia de órganos y tejidos y el síndrome hemorrágico. La gravedad de los síntomas depende de la gravedad y el curso de la anemia.
Los pacientes presentan quejas características del síndrome anémico. Se caracteriza por hemorragias (gingivales, nasales, gastrointestinales, renales, uterinas) y frecuentes enfermedades infecciosas e inflamatorias. En la forma aguda, los síntomas se desarrollan rápidamente y el curso de la enfermedad es grave desde el principio. Pero en la mayoría de los pacientes la enfermedad se desarrolla de forma bastante lenta, gradual y, hasta cierto punto, los pacientes se adaptan a la anemia. La enfermedad suele reconocerse cuando los síntomas son graves.
Al examinar a los pacientes, se llama la atención sobre la pronunciada palidez de la piel y las membranas mucosas visibles, a menudo con un tinte ictérico; erupciones hemorrágicas en la piel, a menudo en forma de hematomas de diferentes tamaños. A menudo, se forman hematomas extensos en el lugar de la inyección (intramuscular, intravenosa, subcutánea). La erupción hemorrágica se localiza principalmente en la zona de las piernas, muslos, abdomen y, a veces, en la cara. Se pueden observar hemorragias en la conjuntiva y en las membranas mucosas visibles: labios, mucosa oral. Puede haber hemorragia nasal, gastrointestinal, renal, pulmonar, uterina e intracerebral grave. Los ganglios linfáticos periféricos no están agrandados.
Al examinar los órganos internos, se pueden detectar los siguientes cambios:
- · Sistema respiratorio: bronquitis frecuente, neumonía.
- · Sistema cardiovascular - síndrome de distrofia miocárdica.
- · Sistema digestivo: en el síndrome hemorrágico grave, se pueden detectar erosiones en la membrana mucosa del estómago y el duodeno.
La hemosiderosis de los órganos internos a menudo se desarrolla debido a una mayor destrucción de glóbulos rojos defectuosos, una menor utilización de hierro por la médula ósea, una síntesis de hemo alterada y transfusiones frecuentes de glóbulos rojos.
Datos de laboratorio y estudios instrumentales.
análisis de sangre generales- marcada disminución del número de glóbulos rojos y de hemoglobina; la anemia en la mayoría de los pacientes es normocrómica, normocítica; caracterizado por la ausencia o una fuerte disminución en el número de reticulocitos (anemia regenerativa); se observa leucopenia debida a granulocitopenia con linfocitosis relativa; La trombocitopenia es típica. Por tanto, la manifestación de laboratorio más importante de la anemia hipo y aplásica es la pancitopenia. La VSG aumenta.
Química de la sangre-- El contenido de hierro sérico aumenta, el porcentaje de saturación de hierro de la transferrina aumenta significativamente.
Estudio de punción esternal (mielograma)-- una disminución pronunciada del número de células de la serie eritrocítica y granulocítica, de linfocitos y una reducción significativa del linaje megacariocítico. En casos graves, la médula ósea parece "vacía"; en la punción del esternón sólo se pueden encontrar células individuales. En la médula ósea, el contenido de hierro, ubicado tanto a nivel extracelular como intracelular, aumenta significativamente.
Criterios de diagnóstico
- · Anemia aregeneradora normocítica normocrómica con una fuerte disminución o ausencia total de reticulocitos, un aumento de la VSG.
- · Leucocitopenia, granulocitopenia absoluta, linfocitosis relativa.
- · Trombocitopenia.
- · Una deficiencia absoluta marcadamente expresada en el mielograma de las células eritro, leuco y trombocitopoyesis, un retraso en su maduración.
- * Aumento del contenido de hierro en el interior de los eritrocariocitos y extracelularmente.
- · Una fuerte disminución en el número o la desaparición completa de las células hematopoyéticas y el reemplazo de la médula ósea hematopoyética con tejido adiposo en la muestra de biopsia trépana del ilion es el método principal para verificar el diagnóstico de anemia hipo y aplásica).
- · Aumento de los niveles séricos de hierro.
Muy a menudo, la deficiencia de hierro en el cuerpo es causada por la pérdida de sangre, lo que resulta en una discrepancia entre la ingesta de hierro en el cuerpo a través de los alimentos y el nivel de su utilización durante la formación de glóbulos rojos.
En particular, la anemia por deficiencia de hierro puede ser causada por: hemorragias de vasos dañados durante la formación de úlceras pépticas del estómago y el duodeno, pérdida de sangre menstrual. En ocasiones, en recién nacidos y niños, la intensidad de la eritropoyesis prevalece sobre la ingesta de hierro, lo que provoca anemia sin pérdida de sangre.
Anemia por inflamación crónica.
En pacientes con enfermedades inflamatorias prolongadas (más de un mes), a menudo se produce anemia. Además, la gravedad de la anemia está directamente relacionada con la duración y la gravedad de la inflamación. Las enfermedades que con mayor frecuencia provocan anemia de este origen son la endocarditis bacteriana subaguda, la osteomielitis, los abscesos pulmonares, la tuberculosis y la pielonefritis.
Las enfermedades autoinmunes (artritis reumatoide, etc.) también se caracterizan por inflamación crónica y anemia.
Una de las causas de la anemia en pacientes con neoplasias malignas es la inflamación crónica asociada.
La anemia causada por inflamación crónica es causada por:
1. Inhibición de la eritropoyesis debido a su estimulación prolongada por citocinas (factores estimulantes de colonias) formadas y liberadas por efectores celulares activados de la inflamación crónica.
2. No compensar la disminución de la esperanza de vida de los glóbulos rojos.
En la anemia debida a inflamación crónica, una disminución del contenido de hierro en los eritroblastos es consecuencia de un suministro deficiente a las células en desarrollo del germen eritroide de la médula ósea. La deficiencia de hierro provoca hipocromía y microcitosis de los glóbulos rojos. Una deficiencia de hierro disponible para la síntesis de hemoglobina conduce a un aumento del contenido de protoporfirina en los eritrocitos. La cantidad de hierro disponible para la eritropoyesis, a pesar de su contenido normal en el organismo, se reduce por la activación sistémica excesiva de los fagocitos mononucleares, así como por su hiperplasia.
Como resultado de la hiperplasia y la hiperactivación en el sistema de fagocitos mononucleares, el exceso de hierro es capturado por células mononucleares activadas, que tienen una mayor capacidad para absorber este microelemento. La mayor capacidad de las células mononucleares para absorber hierro se debe en gran medida a la alta concentración de interleucina-1 en la sangre circulante, que aumenta con la inflamación crónica. Bajo la influencia de la interleucina-1, que circula en la sangre en concentraciones elevadas, los neutrófilos de todo el cuerpo liberan intensamente lactoferrina. Esta proteína se une al hierro libre, liberado durante la destrucción de los glóbulos rojos moribundos, y lo transporta en mayores cantidades a las células mononucleares, que capturan y retienen este microelemento. Como resultado, se inhibe la eritropoyesis, lo que se debe a una disminución en la disponibilidad de hierro para la formación de células eritroides.
Presumiblemente, uno de los vínculos en la patogénesis de la anemia debido a la inflamación crónica puede considerarse la destrucción excesiva de los eritrocitos como resultado de la hiperactivación y la hiperplasia en el sistema de fagocitos mononucleares.
Se evidencia por un acortamiento de la vida de los eritrocitos casi normales, cuyos cambios patológicos se reducen a una reducción del contenido de hierro y un aumento del contenido de protoporfirina.
Anemias sideroblásticas
Estas anemias están asociadas con una síntesis alterada del hemo como componente de la hemoglobina. Las alteraciones en la síntesis de hemoglobina en la anemia sideroblástica se caracterizan por la acumulación de hierro en las mitocondrias ubicadas alrededor del núcleo de las células eritroides patológicas (sideroblastos). Estas células forman un contorno en forma de anillo alrededor del núcleo celular. Las alteraciones en la síntesis del hemo en pacientes con anemia sideroblástica causan hipocromía y microcitosis.
Hay dos tipos de anemia sideroblástica:
1. Anemia sideroblástica hereditaria, que es una enfermedad monogénica cuya transmisión de padres al paciente está asociada al cromosoma X o se hereda de forma autosómica recesiva. Presumiblemente, la anemia sideroblástica hereditaria es causada por una deficiencia congénita en la actividad de la enzima ácido gamma-aminolevulínico sintetasa (la enzima clave de la primera etapa de la síntesis de porfirina).
La inhibición de la actividad enzimática puede ser primaria o deberse a un error congénito en el metabolismo de su cofactor esencial, el piridoxal-5-fosfato.
2. Las anemias sideroblásticas adquiridas ocurren con más frecuencia que las hereditarias. La anemia sideroblástica adquirida puede ser el resultado de los efectos secundarios de los fármacos (isoniazida, etc.). Además, pueden ser idiopáticos.
La utilización deficiente del hierro para la formación de hemo en la anemia sideroblástica se manifiesta por un aumento en el contenido de cationes de hierro libres en el suero, así como un aumento en la concentración de ferritina en el mismo.
La talasemia es una enfermedad monogénica, que se basa en la inhibición de la síntesis de una de las cadenas poliméricas que forman la molécula de globina. Dependiendo del tipo de cadena cuya síntesis sea insuficiente, la talasemia se clasifica en uno de dos grupos principales:
1. Alfa talasemia. Estas enfermedades son causadas por la deleción (eliminación) de genes de alfa-globina del genoma. Hay cuatro de esos genes. Dependiendo de qué gen se pierda en el genoma, la anemia sideroblástica varía en gravedad de menor a grave, lo que provoca la muerte del feto en el útero.
2. Beta talasemia, que se produce por la ausencia o disfunción del gen correspondiente. Cuando un gen es disfuncional, se produce la transcripción pero da como resultado la formación de ácido ribonucleico (ARN) anormal. Además, la disfunción genética también puede consistir en una formación reducida de ARN normal. El genoma contiene dos genes de beta globina diferentes. Por tanto, existen dos tipos de beta talasemias. En la forma más grave de beta talasemia (anemia de Kulei), sus síntomas se vuelven evidentes en la infancia. Por lo general, a los treinta años, a pesar de las transfusiones de sangre, se produce la muerte. En la beta talasemia menos grave, no hay indicación de transfusiones de sangre y la anemia no limita la esperanza de vida.
Al examinar un frotis de sangre en pacientes con talasemia, se revela poiquilocitosis, es decir, variabilidad patológica en la forma de los glóbulos rojos.