Pre citáciu: Schwartz G.Ya. Nedostatok vitamínu D a jeho farmakologická korekcia // BC. 2009. Číslo 7. S. 477
Porušenie tvorby hormónov a ich nedostatok sú dôležitými príčinami mnohých ľudských chorôb. Nedostatok jedného z nich - D-hormónu (častejšie označovaného ako nedostatok vitamínu D), ktorý má široké spektrum biologických vlastností a podieľa sa na regulácii mnohých dôležitých fyziologických funkcií, má tiež negatívne dôsledky a je základom mnohých typov patologických stavov a chorôb. Ďalej uvádzame charakteristiku vitamínu D, jeho nedostatok, jeho úlohu pri výskyte a rozvoji mnohých bežných ochorení, ako aj moderné možnosti farmakologickej korekcie stavov s deficitom D.
Charakteristika vitamínu D, D-hormónu a D-endokrinného systému
Termín „vitamín D“ spája skupinu podobnej chemickej štruktúry (sekosteroidy) a niekoľko foriem vitamínu D, ktoré existujú v prírode:
- vitamín D1 (takto sa nazývala látka objavená v roku 1913 E.V. McCollumom v oleji z tresčej pečene, čo je zlúčenina ergokalciferolu a lumisterolu v pomere 1:1);
- Vitamín D2 - ergokalciferol, vznikajúci z ergosterolu pôsobením slnečného žiarenia, hlavne v rastlinách; predstavuje spolu s vitamínom D3 jednu z dvoch najbežnejších prírodných foriem vitamínu D;
- Vitamín D3 - cholekalciferol, vznikajúci v tele zvierat a ľudí pôsobením slnečného žiarenia zo 7-dehydrocholesterolu; práve on je považovaný za „pravý“ vitamín D, zatiaľ čo iní predstavitelia tejto skupiny považujú za modifikované deriváty vitamínu D;
- vitamín D4 - dihydrotachysterol alebo 22,23-dihydroergokalciferol;
- Vitamín D5 - sitokalciferol (vzniká zo 7-dehydrositosterolu).
Vitamín D je tradične klasifikovaný ako vitamín rozpustný v tukoch. Na rozdiel od všetkých ostatných vitamínov však vitamín D v skutočnosti nie je vitamínom v klasickom zmysle slova, pretože: a) nie je biologicky aktívny; b) dvojstupňovým metabolizmom v organizme prechádza do aktívnej - hormonálnej formy a c) má rôznorodé biologické účinky vďaka interakcii so špecifickými receptormi lokalizovanými v jadrách buniek mnohých tkanív a orgánov. V tomto ohľade sa aktívny metabolit vitamínu D správa ako skutočný hormón, preto názov D-hormón. Zároveň sa v súlade s historickou tradíciou v odbornej literatúre nazýva vitamín D.
Vitamín D2 vstupuje do ľudského tela v relatívne malých množstvách - nie viac ako 20-30% potreby. Jej hlavnými dodávateľmi sú cereálne produkty, rybí tuk, maslo, margarín, mlieko, vaječný žĺtok atď. (Tabuľka 1). Vitamín D2 sa metabolizuje za vzniku derivátov, ktoré majú podobné účinky ako metabolity vitamínu D3.
Druhá prirodzená forma vitamínu D - vitamín D3, alebo cholekalciferol, je najbližším analógom vitamínu D2, ktorý je málo závislý od vonkajšieho príjmu. Cholekalciferol sa tvorí v tele stavovcov vrátane obojživelníkov, plazov, vtákov a cicavcov, a preto hrá v životných procesoch človeka oveľa väčšiu úlohu ako vitamín D2 dodávaný v malých množstvách s potravou. V organizme sa vitamín D3 tvorí z prekurzora nachádzajúceho sa v dermálnej vrstve kože - provitamínu D3 (7-dehydrocholesterol) vplyvom krátkovlnného ultrafialového žiarenia B spektra (UV-B / slnečné svetlo, vlnová dĺžka 290-315 nm ) pri telesnej teplote v dôsledku fotochemickej otváracej reakcie v kruhoch jadra steroidu a tepelnej izomerizácie charakteristickej pre sekosteroidy.
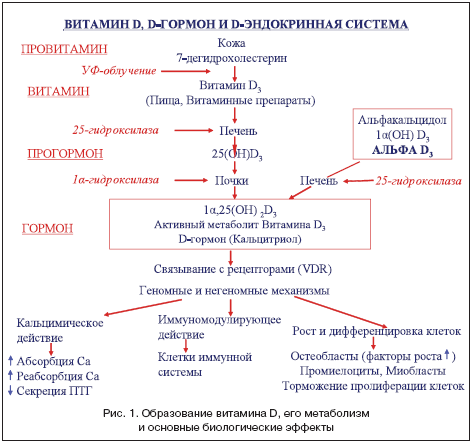
Vitamín D (prichádza s jedlom alebo sa tvorí v tele v procese endogénnej syntézy) sa v dôsledku dvoch po sebe nasledujúcich reakcií hydroxylácie biologicky neaktívnych prehormonálnych foriem premieňa na aktívne hormonálne formy: najdôležitejšia, kvalitatívne a kvantitatívne významná - 1a, 25-dihydroxyvitamín D3 (1a,25 (OH)2D3; tiež nazývaný D-hormón, kalcitriol) a minoritný - 24,25(OH)2D3 (obr. 1).
Úroveň tvorby D-hormónu v tele dospelého zdravého človeka je asi 0,3-1,0 mcg / deň. Prvá hydroxylačná reakcia prebieha hlavne v pečeni (až 90%) a asi 10% - extrahepatálna za účasti mikrozomálneho enzýmu 25-hydroxylázy s tvorbou intermediárnej biologicky neaktívnej transportnej formy - 25 (OH) D ( kalcidol).
Hydroxylácia vitamínu D3 v pečeni nepodlieha žiadnym extrahepatálnym regulačným vplyvom a je to proces úplne závislý od substrátu. 25-hydroxylačná reakcia prebieha veľmi rýchlo a vedie k zvýšeniu hladiny 25 (OH) D v krvnom sére. Hladina tejto látky odráža ako tvorbu vitamínu D v koži, tak aj jeho príjem potravou, a preto môže byť použitá ako marker stavu vitamínu D. Transportná forma 25(OH)D čiastočne vstupuje do tukových a svalových tkanív, kde môže vytvoriť tkanivový sklad s neobmedzenou životnosťou. Následná reakcia la-hydroxylácie 25(OH)D prebieha najmä v bunkách proximálnych tubulov kôry obličiek za účasti enzýmu 1a-hydroxylázy (25-hydroxyvitamín D-1-a-hydroxyláza, CYP27B1). V menšom objeme ako v obličkách sa la-hydroxylácia uskutočňuje aj bunkami lymfohemopoetického systému v kostnom tkanive a, ako sa nedávno zistilo, aj bunkami niektorých iných tkanív obsahujúcich 25(OH)D aj la -hydroxyláza. 25-hydroxyláza (CYP27B1 a jej ďalšie izoformy) aj 1a-hydroxyláza sú klasické mitochondriálne a mikrozomálne oxidázy so zmiešanými funkciami a podieľajú sa na prenose elektrónov z NADP cez flavoproteíny a ferodoxín do cytochrómu P450. Tvorba 1,25-dihydroxyvitamínu D3 v obličkách je prísne regulovaná množstvom endogénnych a exogénnych faktorov.
Predovšetkým regulácia syntézy 1a,25(OH)2D3 v obličkách je priamou funkciou parathormónu (PTH), ktorého koncentrácia v krvi je zasa ovplyvnená mechanizmom spätnej väzby ako hladina najaktívnejšieho metabolitu vitamínu D3 a koncentrácie vápnika a fosforu v krvnej plazme. Okrem toho na la-hydroxylázu a proces 1a-hydroxylácie majú aktivačný účinok ďalšie faktory, vrátane pohlavných hormónov (estrogénov a androgénov), kalcitonínu, prolaktínu, rastového hormónu (prostredníctvom IPFR-1) atď.; Inhibítory 1a-hydroxylázy sú 1a,25(OH)2D3 a množstvo jeho syntetických analógov, glukokortikosteroidné (GCS) hormóny atď. Fibroblastový rastový faktor (FGF23), vylučovaný v kostných bunkách, spôsobuje tvorbu kotransportéra fosforečnanu sodného, ktorý pôsobí v bunkách obličiek a tenkého čreva, má inhibičný účinok na syntézu 1,25-dihydroxyvitamínu D3. Metabolizmus vitamínu D ovplyvňujú aj niektoré lieky (lieky, napr. antiepileptiká).
1α,25-dihydroxyvitamín D3 zvyšuje expresiu 25-hydroxyvitamínu D-24-hydroxylázy (24-OHázy) - enzýmu, ktorý katalyzuje jeho ďalší metabolizmus, čo vedie k tvorbe vo vode rozpustnej biologicky neaktívnej kyseliny kalcitroovej, ktorá sa vylučuje v žlč.
Všetky uvedené zložky metabolizmu vitamínu D, ako aj tkanivové jadrové receptory pre 1α,25-dihydroxyvitamín D3 (D-hormón), nazývané receptory vitamínu D (RVD), sú spojené do endokrinného systému vitamínu D, ktorého funkcie sú schopnosťou generovať biologické reakcie vo viac ako 40 cieľových tkanivách vďaka regulácii génovej transkripcie pomocou PBD (genomický mechanizmus) a rýchlych extragenomických reakcií uskutočňovaných interakciou s PBD lokalizovanými na povrchu množstva buniek. V dôsledku genómových a extragenomických mechanizmov D-endokrinný systém uskutočňuje reakcie udržiavania minerálnej homeostázy (predovšetkým v rámci metabolizmu vápnika a fosforu), koncentrácie elektrolytov a výmeny energie. Okrem toho sa podieľa na udržiavaní primeranej kostnej minerálnej hustoty, metabolizme lipidov, regulácii krvného tlaku, rastu vlasov, stimulácii bunkovej diferenciácie, inhibícii bunkovej proliferácie a realizácii imunologických reakcií (imunosupresívny účinok).
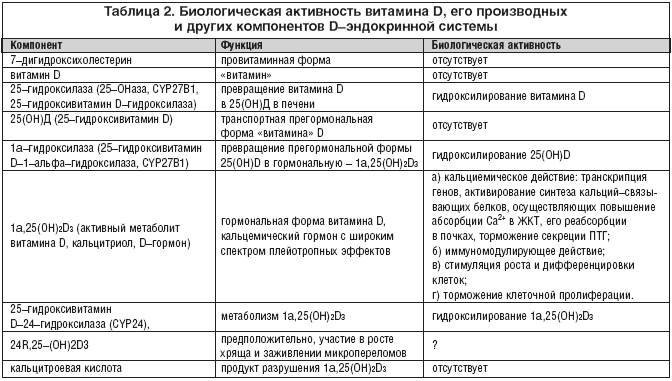
Avšak len samotný D-hormón a hydroxylačné enzýmy sú aktívnymi zložkami D-endokrinného systému (tabuľka 2).
Najdôležitejšími reakciami, na ktorých sa podieľa 1α,25(OH)2D3 ako kalcemický hormón, je absorpcia vápnika v gastrointestinálnom trakte a jeho reabsorpcia v obličkách. D-hormón zvyšuje črevnú absorpciu vápnika v tenkom čreve interakciou so špecifickým RBD - reprezentujúcim X-receptorový komplex kyseliny retinovej (RBD-CRC), čo vedie k expresii vápnikových kanálov v črevnom epiteli. Tieto prechodné (tj nestále) napäťovo riadené katiónové kanály patria do 6. člena podrodiny V (TRPV6). V črevných enterocytoch je aktivácia RVD sprevádzaná anabolickým efektom - zvýšením syntézy kalbidínu 9K, proteínu viažuceho vápnik (CaBP), ktorý vstupuje do lúmenu čreva, viaže Ca2+ a transportuje ich cez črevnú stenu do do lymfatických ciev a potom do cievneho systému. O účinnosti tohto mechanizmu svedčí skutočnosť, že bez účasti vitamínu D sa v čreve absorbuje len 10–15 % vápnika z potravy a 60 % fosforu. Interakcia medzi 1α,25-dihydroxyvitamínom D3 a PBD zvyšuje účinnosť črevnej absorpcie Ca2+ až na 30-40%, t.j. 2-4 krát a fosfor - až 80%. Podobné mechanizmy účinku D-hormónu sú základom reabsorpcie Ca2+ v obličkách pod jeho vplyvom.
V kostiach sa la,25(OH)2D3 viaže na receptory buniek tvoriacich kosť, osteoblasty (OB), čo spôsobuje, že zvyšujú expresiu ligandu receptora aktivátora jadrového faktora kB (RANKL). Aktivátorový receptor jadrového faktora kB (RANK), čo je preosteoklast-lokalizovaný receptor pre RANKL (preOK), viaže RANKL, čo spôsobuje rýchle dozrievanie preOK a ich transformáciu na zrelé TK. V procesoch kostnej remodelácie zrelé OC resorbujú kosť, čo je sprevádzané uvoľňovaním vápnika a fosforu z minerálnej zložky (hydroxyapatitu) a udržiava hladinu vápnika a fosforu v krvi. Adekvátna hladina vápnika (Ca2+) a fosforu (vo forme fosfátu (HPO42–) je nevyhnutná pre normálnu mineralizáciu kostry).
D-nedostatok
Za fyziologických podmienok sa potreba vitamínu D pohybuje od 200 IU (u dospelých) do 400 IU (u detí) denne. Predpokladá sa, že krátkodobé (10–30 minút) slnenie tváre a holých rúk zodpovedá približne 200 IU vitamínu D, zatiaľ čo opakované vystavovanie sa slnku nahých osôb so stredne závažným erytémom kože spôsobuje zvýšenie 25( Hladiny OH)D vyššie, ako sa pozorovalo pri opakovanom podávaní v dávke 10 000 IU (250 mcg) denne.
Hoci neexistuje konsenzus o optimálnej hladine 25(OH)D meranej v sére, väčšina odborníkov považuje nedostatok vitamínu D (VDD) za výskyt, keď je 25(OH)D pod 20 ng/ml (t.j. pod 50 nmol). /l). Hladina 25(OH)D je nepriamo úmerná hladine PTH v rozmedzí, keď hladina PTH (PTH) dosahuje interval medzi 30 a 40 ng/ml (tj od 75 do 100 nmol/l), pri uvedených hodnôt, začne koncentrácia PTH klesať (z maxima). Okrem toho sa črevný transport Ca2+ u žien zvýšil až o 45–65 %, keď sa hladiny 25(OH)D zvýšili z priemerných 20 na 32 ng/ml (50 až 80 nmol/l). Na základe týchto údajov možno hladinu 25(OH)D 21 až 29 ng/ml (tj 52 až 72 nmol/l) považovať za indikátor relatívneho nedostatku vitamínu D a hladinu 30 ng/ml resp. vyššie je postačujúce (t. j. takmer normálne). K toxicite vitamínu D dochádza, keď sú hladiny 25(OH)D vyššie ako 150 ng/ml (374 nmol/l).
Na základe výsledkov zistení 25(OH)D získaných v početných štúdiách a ich extrapolácii možno povedať, že podľa dostupných prepočtov má asi 1 miliarda ľudí na Zemi nedostatok VDD alebo vitamínu D, čo odráža aj demografické (starnutie populácie ) a environmentálnych (zmena podnebia, pokles slnečného žiarenia) zmeny, ktoré prebiehajú na planéte v posledných rokoch. Podľa niekoľkých štúdií má VDD 40 až 100 % starších ľudí v USA a Európe, ktorí žijú v normálnych podmienkach (nie v domovoch dôchodcov). Viac ako 50 % žien po menopauze užívajúcich lieky na liečbu OP má suboptimálnu (nedostatočnú) hladinu 25(OH)D, t.j. pod 30 ng/ml (75 nmol/l).
Potenciálne riziko VDD má aj značný počet detí a mladých dospelých. Napríklad 52 % hispánskych a černošských (afroamerických) dospievajúcich v štúdii Boston (USA) a 48 % bielych dospievajúcich dievčat v štúdii Maine (USA) malo hladiny 25(OH)D pod 20 ng/ml. V iných štúdiách na konci zimy malo 42 % amerických čiernych dievčat a žien vo veku 15 až 49 rokov hladiny 25(OH)D nižšie ako 20 ng/ml a 32 % zdravých študentov a lekárov v Bostonskej nemocnici bolo zistené VDD napriek ich dennému príjmu. 1 pohára mlieka a multivitamínových prípravkov, ako aj zaradenie lososa do stravy aspoň 1-krát týždenne.
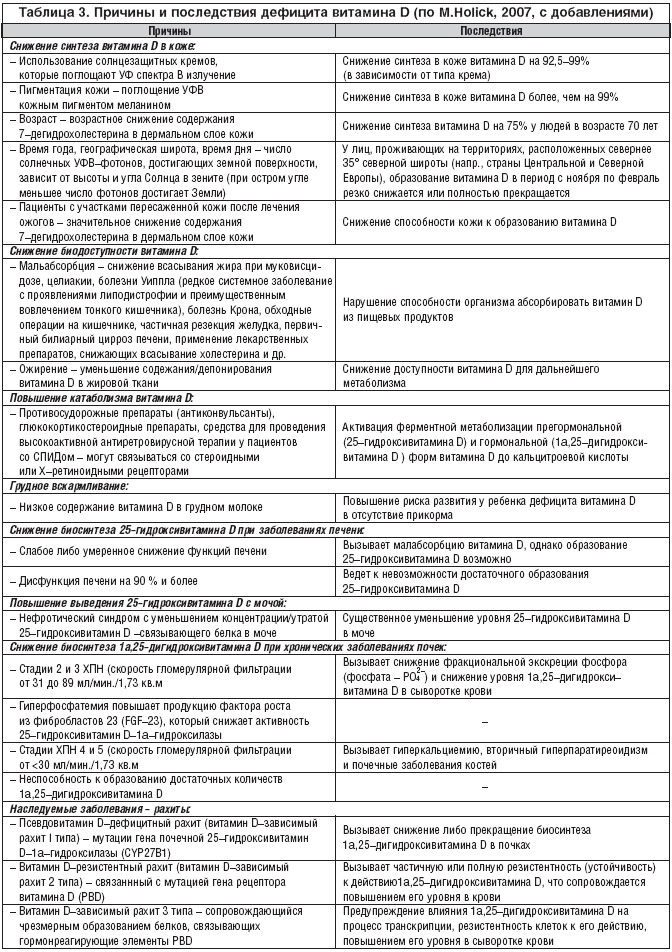
V Európe, kde sú veľmi zriedkavé potraviny umelo obohatené vitamínom D, sú deti a dospelí vystavení obzvlášť vysokému riziku VDD. Ľudia žijúci v rovníkovej oblasti s vysokou úrovňou prirodzeného slnečného žiarenia majú hladiny 25(OH)D blízke normálu – nad 30 ng/ml. V najslnečnejších oblastiach Zeme však DDD nie je nezvyčajné kvôli noseniu celotelového oblečenia. V štúdiách uskutočnených v Saudskej Arábii, Spojených arabských emirátoch, Austrálii, Turecku, Indii a Libanone má 30 až 50 % detí a dospelých hladiny 25(OH)D pod 20 ng/ml. Tabuľka 3 sumarizuje hlavné príčiny a dôsledky VDD.
Deficit D-hormónu (často reprezentovaný D-hypovitaminózou alebo nedostatkom D-vitamínu, keďže na rozdiel od dramatického poklesu postmenopauzálnych hladín estrogénu sa pod týmto pojmom rozumie najmä zníženie úrovne tvorby 25 (OH) D a 1a,25 (OH) 2D3), ako aj poruchy jeho recepcie, zohrávajú významnú úlohu v patogenéze nielen ochorení skeletu (rachitída, osteomalácia, osteoporóza), ale aj značného počtu bežných extraskeletálnych ochorení (kardiovaskulárna patológia, nádory, autoimunitné ochorenia atď.).
Existujú dva hlavné typy nedostatku D-hormónu, niekedy tiež nazývaný "syndróm D-deficiencie". Prvý z nich je spôsobený nedostatkom / nedostatočnosťou vitamínu D3 - prirodzenej prohormonálnej formy, z ktorej sa tvorí aktívny (e) metabolit(y). Tento typ nedostatku vitamínu D súvisí s nedostatočným pobytom na slnku, ako aj s nedostatočným príjmom tohto vitamínu z potravy, neustálym nosením oblečenia, ktoré pokrýva telo, čo znižuje tvorbu prirodzeného vitamínu v pokožke a vedie k zníženie hladiny 25 (OH) D v krvnom sére. Podobná situácia bola pozorovaná skôr, hlavne u detí, a bola vlastne synonymom pre rachitu. V súčasnosti je vo väčšine priemyselných krajín sveta v dôsledku umelého obohacovania detskej výživy vitamínom D jeho nedostatok / nedostatok u detí pomerne zriedkavý. V dôsledku demografickej situácie, ktorá sa zmenila v druhej polovici 20. storočia, sa však nedostatok vitamínu D často vyskytuje u starších ľudí, najmä u tých, ktorí žijú v krajinách a územiach s nízkou prirodzenou slnečnou slnečnosťou (severne alebo južne od 40° zemepisnej dĺžky v severnej, resp. južných hemisfér), ktorí majú nedostatočnú alebo nevyváženú stravu a nízku fyzickú aktivitu. Ukázalo sa, že u ľudí vo veku 65 rokov a starších dochádza k 4-násobnému zníženiu schopnosti tvoriť vitamín D v koži. Vzhľadom na to, že 25(OH)D je substrátom pre enzým 1a-hydroxylázu a rýchlosť jeho premeny na aktívny metabolit je úmerná hladine substrátu v krvnom sére, pokles tohto ukazovateľa<30 нг/мл нарушает образование адекватных количеств 1a,25(ОН)2D3. Именно такой уровень снижения 25(ОН)D в сыворотке крови был выявлен у 36% мужчин и 47% женщин пожилого возраста в ходе исследования (Euronut Seneca Program), проведенного в 11 странах Западной Европы. И хотя нижний предел концентрации 25(ОН)D в сыворотке крови, необходимый для поддержания нормального уровня образования 1a,25(ОН)2D3, неизвестен, его пороговые значения, по–видимому, составляют от 12 до 15 нг/мл (30–35 нмол/л).
Spolu s vyššie uvedenými údajmi sa v posledných rokoch objavili presnejšie kvantitatívne kritériá pre nedostatok D. Hypovitaminóza D je podľa autorov definovaná ako hladina 25(OH)D v sére 100 nmol/l (40 ng/ml), deficit vitamínu D pri 50 nmol/l a deficit D pri<25 нмол/л (10 нг/мл). Последствием этого типа дефицита витамина D являются снижение абсорбции и уровня Са2+, а также повышение уровня ПТГ в сыворотке крови (вторичный гиперпаратиреоидизм), нарушение процессов ремоделирования и минерализации костной ткани. Дефицит 25(ОН)D рассматривают в тесной связи с нарушениями функций почек и возрастом, в том числе с количеством лет, прожитых после наступления менопаузы. При этом отмечены как географические и возрастные различия в уровне этого показателя, так и его зависимость от времени года, т.е. от уровня солнечной инсоляции/количества солнечных дней (УФ), что необходимо принимать во внимание при проведении соответствующих исследований и анализе полученных данных.
Deficit 25(OH)D sa zistil aj pri malabsorpčnom syndróme, Crohnovej chorobe, stavoch po subtotálnej gastrektómii alebo bypassových operáciách na črevách, nedostatočnej sekrécii pankreatickej šťavy, cirhóze pečene, vrodenej atrézii žlčových ciest, dlhodobom užívaní tzv. antikonvulzíva (antiepileptiká), nefróza.
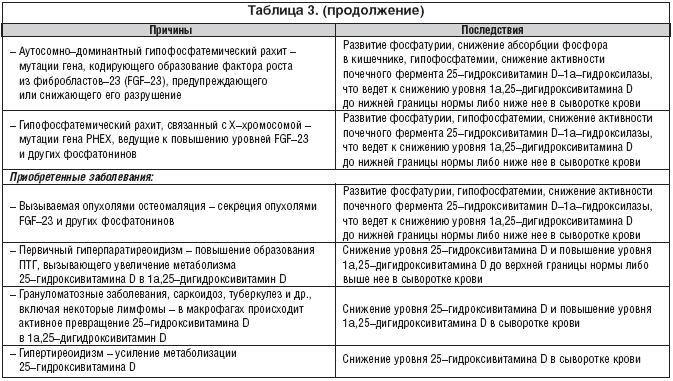
Iný typ nedostatku vitamínu D nie je vždy definovaný znížením produkcie D-hormónu v obličkách (pri tomto type nedostatku možno pozorovať normálne alebo mierne zvýšené sérové hladiny), ale je charakterizovaný znížením jeho príjem v tkanivách (hormonálna rezistencia), ktorá sa považuje za funkciu veku. Napriek tomu mnohí autori zaznamenali pokles hladiny 1a,25(OH)2D3 v krvnej plazme počas starnutia, najmä vo vekovej skupine nad 65 rokov. Znížená renálna produkcia 1a,25(OH)2D3 sa často pozoruje pri AP, ochoreniach obličiek (CKD atď.), u starších ľudí (>65 rokov), s deficitom pohlavných hormónov, hypofosfatemickej osteomalácii nádorového pôvodu, s PTH -deficientná a PTH rezistentná hypoparatyreóza, diabetes mellitus, pod vplyvom užívania kortikosteroidov a pod. Predpokladá sa, že vývoj rezistencie na 1a,25(OH)2D3 je spôsobený znížením počtu PBD v cieľových tkanivách, a predovšetkým v črevách, obličkách a kostrových svaloch. Obidva varianty deficitu vitamínu D sú základnými článkami v patogenéze OP, pádov a zlomenín.
Rozsiahle štúdie uskutočnené v posledných rokoch odhalili štatisticky významnú koreláciu medzi VDD a prevalenciou mnohých chorôb. Zároveň sa získali dôležité informácie najmä pri štúdiu súvislostí medzi VDD a kardiovaskulárnymi a onkologickými ochoreniami.
Dve prospektívne kohortové štúdie zahŕňali 613 mužov zo štúdie Health Professionals Follow-Up Study a 1198 žien zo štúdie Nurses Health Study s hladinami 25(OH)D nameranými a sledovanými počas 4 až 8 rokov. Okrem toho 2 prospektívne kohortové štúdie zahŕňali 38 338 mužov a 77 531 žien s predpokladanými hladinami 25(OH)D počas obdobia 16 až 18 rokov. Počas 4 rokov sledovania bolo multivariačné relatívne riziko hypertenzie u mužov s nameranými hladinami 25(OH)D<15 нг/мл (т.е. состояние D–дефицита), в сравнении с теми, у кого этот уровень составлял ³30 нг/мл был определен в 6,13 (!) (95% ДИ 1,00 до 37,8). Среди женщин такое же сравнение выявило показатель относительного риска, равный 2,67 (95% ДИ от 1,05 до 6,79). Группировка данных, касающихся общего относительного риска у мужчин и у женщин, у которых был измерен уровень 25(ОН)D, проведенная с использованием модели дисперсии случайных процессов, позволила получить значение этого риска, близкое к 3,18 (95% ДИ от 1,39 до 7,29). Используя данные об уровне 25(ОН)D в больших когортах, многовариантный и относительные риски сравнивали по наиболее низким и наиболее высоким децилям среди мужчин, где он составил 2,31 (95% ДИ от 2,03 до 2,63) и среди женщин – 1,57 (95% ДИ 1,44 до 1,72). Таким ообразом, уровень 25(ОН)D в плазме крови обратно пропорционален риску развития артериальной гипертензии.
Bolo popísaných 16 rôznych typov malígnych nádorov, ktorých vznik koreluje s nízkou insoláciou / UV žiarením a ich prevalencia stúpa s D-deficienciou / insuficienciou. Medzi nimi: rakovina prsníka, hrubého čreva a konečníka, maternice, pažeráka, vaječníkov, Hodgkinov a non-Hodgkinov lymfóm, rakovina močového mechúra, žlčníka, žalúdka, pankreasu a prostaty, obličiek, semenníkov a vagíny. Údaje týkajúce sa vzťahu medzi D-deficienciou/nedostatočnosťou a určitými typmi onkologických patológií boli získané v množstve kohortových štúdií alebo pomocou prípadovej kontrolnej metodológie.
Tieto štúdie potvrdili existenciu korelácie medzi prevalenciou a úmrtnosťou na zhubné nádory prsníka, hrubého čreva, vaječníkov a prostaty a intenzitou slnečného žiarenia v mieste trvalého bydliska pacientov, dĺžkou ich pobytu na slnku a hladina vitamínu D v krvnom sére.
Americká štúdia merala hladiny 25(OH)D v plazme u 1095 mužov ako súčasť Health Professionals Follow-Up Study a použila lineárny regresný model na posúdenie 6 individuálnych charakteristík (príjem vitamínu D z potravy a doplnkov vitamínu D, rasa, telesná hmotnosť index, geografická poloha, fyzická aktivita) ako prediktory hladín 25(OH)D v plazme. Pri analýze výsledkov bol použitý počítačový štatistický model s výpočtom hladiny 25(OH)D u 47 800 mužov v súbore a jej vzťahu k riziku rakoviny akejkoľvek lokalizácie. Zistilo sa, že zvýšenie alebo zvýšenie vypočítaného 25(OH)D o 25 nmol/l (10 ng/ml) súvisí so 17 % znížením celkového počtu rakovín (RR=0,83, 95 % CI=0,73 až 0,94) a 29 % zníženie celkovej mortality v dôsledku malígnych nádorov (RR = 0,71, 95 % CI 0,60 až 0,83) s prevládajúcim účinkom na gastrointestinálne karcinómy. Podobné údaje boli získané v mnohých ďalších štúdiách, ktoré preukázali koreláciu medzi VDD a rizikom rozvoja diabetes mellitus I. typu, inými autoimunitnými ochoreniami (skleróza multiplex, reumatoidná artritída), úmrtnosťou na CRF atď., ochoreniami CNS (epilepsia, Parkinsonova choroba). choroba, Alzheimerova choroba atď.), tuberkulóza.
Všetky tieto údaje, ako špecialisti, tak aj zdravotnícke orgány v Spojených štátoch a západnej Európe, sú považované za „epidémiu VDD“, ktorá má vážne medicínske, medicínske a sociálne dôsledky.
Farmakologická korekcia D-deficitu
Ako je uvedené vyššie, VDD je jedným z významných rizikových faktorov mnohých chronických ľudských chorôb. Doplnenie tohto nedostatku primeraným slnečným žiarením alebo umelým vystavením UV žiareniu je dôležitým prvkom v prevencii týchto ochorení. Použitie prípravkov vitamínu D, najmä jeho aktívnych metabolitov, je sľubným smerom v liečbe bežných typov patológií: spolu s tradičnými metódami terapie otvárajú nové možnosti pre praktickú medicínu.
Podľa farmakologickej aktivity sa prípravky vitamínu D delia do dvoch skupín. Prvý z nich kombinuje stredne aktívne natívne vitamíny D2 (ergokalciferol) a D3 (cholekalciferol), ako aj štruktúrny analóg vitamínu D3, dihydrotachysterol. Vitamín D2 sa najčastejšie používa v multivitamínových prípravkoch pre deti a dospelých. Pokiaľ ide o aktivitu, 1 mg vitamínu D2 zodpovedá 40 000 IU vitamínu D. Zvyčajne je vitamín D2 dostupný v kapsulách alebo tabletách s obsahom 50 000 IU (1,25 mg) alebo v olejovom injekčnom roztoku v množstve 500 000 IU/ml (12,5 mg ) v ampulkách. OTC perorálne prípravky (roztoky) obsahujú 8 000 IU/ml (0,2 mg) vitamínu D2. Prípravky tejto skupiny sú podľa obsahu účinných látok klasifikované ako mikroživiny (potravinárske prísady).
Do druhej skupiny patrí aktívny metabolit vitamínu D3 a jeho analógy: kalcitriol, alfakalcidol atď.
Mechanizmus účinku liečiv oboch skupín je podobný ako u prírodného vitamínu D a spočíva vo väzbe na RBD v cieľových orgánoch a vo farmakologických účinkoch v dôsledku ich aktivácie (zvýšené vstrebávanie vápnika v čreve a pod.). Rozdiely v pôsobení jednotlivých liečiv sú prevažne kvantitatívneho charakteru a sú dané zvláštnosťami ich farmakokinetiky a metabolizmu. Prípravky natívnych vitamínov D2 a D3 teda podliehajú 25-hydroxylácii v pečeni, po ktorej nasleduje konverzia v obličkách na aktívne metabolity, ktoré majú zodpovedajúce farmakologické účinky. V tomto ohľade a v súlade s vyššie uvedenými dôvodmi sa procesy metabolizmu týchto liekov spravidla znižujú u starších ľudí s rôznymi typmi a formami primárnej a sekundárnej AP, u pacientov trpiacich chorobami gastrointestinálneho traktu, pečeň, pankreas a obličky (CRF), ako aj na pozadí užívania napríklad antikonvulzív a iných liekov, ktoré zvyšujú metabolizmus 25 (OH) D na neaktívne deriváty. Okrem toho dávky vitamínov D2 a D3 a ich analógov v liekových formách (zvyčajne blízke fyziologickým požiadavkám na vitamín D – 200–800 IU/deň) sú schopné za fyziologických podmienok zvýšiť vstrebávanie vápnika v čreve, ale neumožňujú na prekonanie jeho malabsorpcie.pri rôznych formách OP spôsobujúce potlačenie sekrécie PTH a nemajú jednoznačný pozitívny vplyv na kostné tkanivo.
Tieto nedostatky sú zbavené prípravkov obsahujúcich aktívne metabolity vitamínu D3 (v posledných rokoch sa využívajú na terapeutické účely oveľa širšie ako natívne vitamínové prípravky): 1a derivát - 1a (OH) D3 (INN - alfakalcidol). Obidve liečivá sú podobné v spektre farmakologických vlastností a mechanizmu účinku, líšia sa však farmakokinetickými parametrami, znášanlivosťou a niektorými ďalšími charakteristikami.
Vo farmakokinetike prípravkov na báze natívnych foriem vitamínu D, ich aktívnych metabolitov a derivátov sú výrazné rozdiely, ktoré do značnej miery určujú ich praktické využitie. Natívne vitamíny D2 a D3 sa vstrebávajú v hornej časti tenkého čreva, dostávajú sa do lymfatického systému, pečene a ďalej do krvného obehu ako súčasť chylomikrónov. Ich maximálna koncentrácia v krvnom sére sa pozoruje v priemere 12 hodín po užití jednorazovej dávky a na pôvodnú úroveň sa vracia po 72 hodinách.Na pozadí dlhodobého užívania týchto liekov (najmä vo veľkých dávkach) dochádza k ich eliminácii z obehu. výrazne spomaľuje a môže dosiahnuť mesiace, čo súvisí s možnosťou ukladania vitamínov D2 a D3 v tukovom a svalovom tkanive.
Vitamín D sa vylučuje žlčou ako polárnejšie metabolity. Farmakokinetika aktívneho metabolitu vitamínu D, kalcitriolu, bola podrobne študovaná. Po perorálnom podaní sa rýchlo vstrebáva v tenkom čreve. Maximálna koncentrácia kalcitriolu v krvnom sére sa dosiahne po 2-6 hodinách a výrazne klesá po 4-8 hodinách Polčas rozpadu je 3-6 hodín.Pri opakovanom podávaní sa dosiahnu rovnovážne koncentrácie do 7 dní. Na rozdiel od prírodného vitamínu D3, kalcitriol, ktorý nevyžaduje ďalšiu metabolizáciu, aby sa premenil na aktívnu formu, po perorálnom podaní v dávkach 0,25–0,5 μg, v dôsledku interakcie s extranukleárnymi receptormi enterocytov črevnej sliznice, spôsobuje zvýšenie črevnej vstrebávanie vápnika. Predpokladá sa, že exogénny kalcitriol preniká z krvi matky do fetálneho obehu a vylučuje sa do materského mlieka. Vylučuje sa žlčou a podlieha enterohepatálnej cirkulácii. Bolo identifikovaných niekoľko metabolitov kalcitriolu, ktoré vykazujú rôzne stupne vlastností vitamínu D; tieto zahŕňajú la,25-dihydroxy-24-oxocholekalciferol, la,23,25-trihydroxy-24-oxocholekalciferol atď.
Pri výrazných podobnostiach vo vlastnostiach a mechanizmoch účinku medzi liečivami aktívnych metabolitov vitamínu D existujú aj výrazné rozdiely. Charakteristickým znakom alfakalcidolu ako proliečiva je, ako už bolo uvedené, že sa premieňa na aktívnu formu, pričom sa metabolizuje v pečeni na 1a,25(OH)2D3 a na rozdiel od natívnych prípravkov vitamínu D nevyžaduje hydroxyláciu obličiek, čo umožňuje jeho použitie u pacientov s ochorením obličiek, ako aj u starších ľudí so zníženou funkciou obličiek. Zároveň sa zistilo, že účinok kalcitriolu sa vyvíja rýchlejšie a je sprevádzaný výraznejším hyperkalcemickým účinkom ako u alfakalcidolu (najrozšírenejšie alfakalcidolové liečivo v Rusku je Alpha D3-Teva), pričom posledný má lepší účinok na kostné tkanivo. Vlastnosti farmakokinetiky a farmakodynamiky týchto liekov určujú ich dávkovací režim a frekvenciu podávania. Takže, keďže polčas rozpadu kalcitriolu je relatívne krátky, mal by sa podávať aspoň 2-3 krát denne, aby sa udržala stabilná terapeutická koncentrácia. Účinok alfakalcidolu sa vyvíja pomalšie, ale po jednej injekcii je dlhší, čo určuje jeho podávanie v dávkach 0,25–1 μg 1–2 krát denne.
Prípravky natívnych vitamínov D2 a D3, ako aj ich aktívne metabolity patria medzi najlepšie tolerované a bezpečné lieky používané na prevenciu a liečbu OP. Toto ustanovenie má veľký praktický význam vzhľadom na to, že ich používanie je zvyčajne dosť dlhé (mnohé mesiace a dokonca roky). Klinické pozorovania ukazujú, že pri individuálnom výbere dávok prípravkov vitamínu D na základe hodnotenia hladiny vápnika v krvnej plazme je riziko nežiaducich účinkov minimálne. Je to spôsobené širokým terapeutickým účinkom, ktorý je týmto liekom vlastný. Napriek tomu sa pri užívaní aktívnych metabolitov vitamínu D môže približne u 2 – 4 % pacientov rozvinúť množstvo nežiaducich účinkov, z ktorých najčastejšie sú hyperkalcémia a hyperfosfatémia, ktorá je spojená s jedným z hlavných mechanizmov ich účinku – zvýšenou črevná absorpcia vápnika a fosforu. Oba tieto účinky sa môžu prejaviť malátnosťou, slabosťou, ospalosťou, bolesťami hlavy, nevoľnosťou, suchom v ústach, zápchou alebo hnačkou, nepríjemnými pocitmi v epigastrickej oblasti, bolesťami svalov a kĺbov, svrbením kože, búšením srdca. Pri individuálne zvolenej dávke sa tieto vedľajšie účinky pozorujú pomerne zriedkavo.
Medzinárodné a domáce skúsenosti s používaním prípravkov aktívneho metabolitu vitamínu D - kalcitriolu a alfakalcidolu na prevenciu a liečbu rôznych typov a foriem OP, ako aj na prevenciu pádov a zlomenín sú zhrnuté v Klinických pokynoch “ Osteoporóza. Diagnostika, prevencia a liečba“ 2008, ktorú pripravila Ruská asociácia pre osteoporózu. Záver a odporúčania týkajúce sa použitia liekov na báze aktívnych metabolitov vitamínu D v liečbe osteoporózy obsiahnuté v tomto dokumente sú uvedené v tabuľkách 4 a 5.
Prípravky vitamínu D sú teda skupinou účinných a bezpečných liečiv používaných najmä pri ochoreniach, v ktorých patogenéze zohráva vedúcu úlohu nedostatok/nedostatok D a s ním spojené poruchy metabolizmu minerálov. Natívne prípravky vitamínu D, najmä vo fyziologických dávkach, v dôsledku korekcie endogénneho deficitu/nedostatku D pôsobia preventívne pri krivici, ako aj vo vzťahu k osteoporóze, môžu znižovať jej intenzitu a predchádzať vzniku zlomenín. Užívanie natívnych preparátov vitamínu D je vhodné hlavne pri deficite D 1. typu, z dôvodu nedostatku slnečného žiarenia a príjmu vitamínu D z potravy. Prípravky aktívnych metabolitov vitamínu D (alfakalcidol a kalcitriol) sú indikované pri deficite D 1. aj 2. typu. Vďaka výrazne vyššej farmakologickej aktivite ako natívne prípravky vitamínu D sú schopné prekonať rezistenciu tkanivového PBD voči agonistovi a na premenu na aktívnu formu sa nemusia metabolizovať v obličkách. Prípravky aktívnych metabolitov vitamínu D majú preventívne a liečebné účinky pri rôznych typoch a formách OP, znižujú riziko pádov; možno ich použiť ako monoterapiu, tak aj v kombinácii s inými antiosteoporotickými látkami (napr. bisfosfonáty, HRT) a vápenatými soľami. Individuálny výber dávkovania kalcitriolu a alfakalcidolu minimalizuje riziko nežiaducich účinkov, čo spolu s prevenciou nových zlomenín, odstránením bolesti a zlepšením motorickej aktivity zlepšuje kvalitu života pacientov, najmä starších a senilných pacientov.
Vysoká miera deficitu D v populácii a vznik jeho asociácie s radom bežných extraskeletálnych ochorení (kardiovaskulárne, onkologické, neurologické a pod.) dáva záležať na ďalšom výskume o možnosti ich liečby liekmi z tzv. skupina aktívnych metabolitov vitamínu D.

Literatúra
1. Dambacher M.A., Shakht E. Osteoporóza a aktívne metabolity vitamínu D: myšlienky, ktoré prichádzajú na myseľ. Vydavateľstvo Eular, Bazilej, 1996 – 139 s.
2. E. I. Marova, S. S. Rodionova, L. Ya. Rozhinskaya a G. Ya. Alfakalcidol (Alfa-D3) v prevencii a liečbe osteoporózy. Metóda. odporúčania. M., 1998. - 35 s.
3. Rozhinskaya L.Ya. Systémová osteoporóza. Praktický sprievodca. 2. vyd. M.: Vydavateľstvo Mokeev, 2000, -196 s.
4. Nasonov E.L., Skripniková I.A., Nasonova V.A. Problém osteoporózy v reumatológii, M.: Steen, 1997. - 429 s.
5. Osteoporóza. / Ed. O.M. Lesnyak, L.I. Benevolenskoy - 2. vydanie, revidované. a dodatočné - M.: GEOTAR-Media, 2009. - 272 s. (Séria "Klinické odporúčania").
6. Schwartz G.Ya. Vitamín D, D-hormón a alfakalcidol: molekulárno-biologické a farmakologické aspekty.//Osteoporóza a osteopatia, 1998, - č. 3, - S.2-7.
7. Schwartz G.Ya. Farmakoterapia osteoporózy. M.: Lekárska informačná agentúra, 2002. - 368 s.
8. Schwartz G.Ya. Vitamín D a D-hormón. M.: Anacharsis, 2005. - 152 s.
9. Schwartz G.Ya. Osteoporóza, pády a zlomeniny u starších ľudí: úloha D-endokrinného systému. // RMJ, 2008 - v.17, č.10. - S. 660-669.
10. Autier P., Gaudini S. Suplementácia vitamínu D a celková úmrtnosť. // Arch Intern Med, 2007, 167 (16): 1730–1737.
11. Holík M.F. Vitamín D: význam v prevencii rakoviny, cukrovky 1. typu, srdcových chorôb a osteoporózy. // Am J Clin Nutr., 2004; 79 (3): 362-371.
12. Holík M.F. Nedostatok vitamínu D. // New Engl J Med., 2007; 357:266-281.
13. Forman J.P., Giovannucci E., Holmes M.D. a kol. Plazmatická hladina 25-hydroxyvitamínu D a riziko hypertenzie. //Hypertenzia, 2007; 49:1063-1069.
14. Vervloet M.G., Twisk J.W.R. Zníženie úmrtnosti aktiváciou receptora vitamínu D v konečnom štádiu ochorenia obličiek: komentár k robustnosti súčasných údajov. // Transplantácia nefrolového číselníka. 2009; 24:703–706.


