Miecha sa nachádza v miechovom kanáli a v priereze má vzhľad zaobleného povrazca, rozšíreného v krčnej a bedrovej oblasti. Skladá sa z dvoch symetrických polovíc, oddelených vpredu strednou štrbinou, vzadu strednou ryhou a vyznačuje sa segmentovou štruktúrou. Každý segment je spojený s párom predných (ventrálnych) a párom zadných (dorzálnych) koreňov. Miecha pozostáva z centrálne umiestnenej šedej hmoty a okolitej bielej hmoty. Sivá hmota v reze má tvar motýľa. Výbežky šedej hmoty, ktoré prebiehajú pozdĺž miechy, sa nazývajú stĺpce. K dispozícii sú zadné, bočné a predné stĺpiky. Stĺpy v priereze sa nazývajú rohy. Sivá hmota pozostáva zo skupín multipolárnych neurónov a neurogliocytov, nemyelinizovaných a tenkých myelinizovaných vlákien.
Zhluky neurónov, ktoré majú spoločnú morfológiu a funkciu, sa nazývajú jadrá . V zadných rohoch sú:
· okrajová Lissauerova zóna - miesto rozvetvenia vlákien chrbtových koreňov pri vstupe do miechy;
· hubovitá hmota , reprezentovaný gliovou kostrou s veľkou slučkou s veľkými neurónmi;
· želatínový (rôsolovité) látok o, tvorený neurogliou s malými nervovými bunkami;
· vlastné jadro dorzálneho rohu , pozostávajúce z chumáčových buniek, ktorých procesy, prechádzajúce cez prednú komisuru do laterálnej šnúry opačnej strany miechy, dosahujú mozoček ako súčasť predného spinocerebelárneho traktu;
· Clarke jadro , tiež pozostávajúce z chumáčových buniek, ktorých axóny, prechádzajúce ako súčasť zadnej spinocerebelárnej dráhy, sú spojené s mozočkom.
Stredná zóna šedej hmoty obklopuje miechový kanál, ktorý je lemovaný ependymogliou. V strednej zóne sú jadrá:
· mediálne, pozostávajúce z chumáčových buniek, ktorých neuróny sa spájajú s predným spinocerebelárnym traktom;
· bočné, lokalizované v laterálnych rohoch, pozostávajúce zo skupiny asociačných buniek, ktoré sú prvým neurónom eferentnej sympatickej dráhy.
Najväčšie nervové bunky ležia v predných rohoch, ako súčasť zadného a predného mediálneho jadra, tvoreného motorickými (koreňovými) neurónmi, ktorých axóny opúšťajú miechu ako súčasť predných koreňov a inervujú svaly trupu. Zadné a predné laterálne jadrá sú tiež tvorené motorickými neurónmi, ktoré inervujú svaly horných a dolných končatín.

Bielu hmotu predstavujú pozdĺžne prebiehajúce miazgové nervové vlákna, zhromaždené vo zväzkoch, tvoriace vodivé dráhy miechy. Biela hmota sa delí na: zadnú, bočnú a prednú šnúru.

Snopce sú rozdelené do dvoch skupín: niektoré spájajú iba oddelené úseky miechy a ležia v predných a bočných povrazcoch priamo pri sivej hmote, čím vytvárajú svoje vlastné dráhy miechy. Ďalšia skupina zväzkov spája miechu a mozog.
Existujú stúpajúce a klesajúce cesty. Vzostupné dráhy tvoria zadnú šnúru a stúpajú do medulla oblongata.
Rozlišovať jemný Gaullov drdol, tvorené axónmi zmyslových buniek, ktorých receptory ležia v dolnej polovici tela a klinovitý zväzok Burdach , ktorých receptory vnímajú vzruch v hornej polovici tela. Tieto zväzky končia v jadrách medulla oblongata. Sú to cesty hmatovej, bolestivej a teplotnej citlivosti.
Bočná šnúra pozostáva zo vzostupných dráh spinocerebelárneho predného a spinocerebelárneho zadného. Stimulácia pozdĺž týchto dráh sa dostáva do prednej časti mozočka a prechádza na motorické dráhy prebiehajúce od mozočka k červenému jadru.
Zostupné cesty zahŕňajú:
1. Dráhy spájajúce miechu s mozgovou kôrou: pyramídový, kortikospinálna spôsob a predná kortikospinálna dráha ležiaca v anterior funiculus. Tieto dráhy majú veľký význam pre realizáciu vedomých, koordinovaných pohybov tela. Všetky motorické impulzy týchto pohybov sa prenášajú cez pyramídové dráhy. Bulbosspinálna dráha nesie aj impulzy z mozgovej kôry.
2. Komunikácia s medulla oblongata sa uskutočňuje pomocou vestibulospinálna dráha (deuterospinálna), ktorá má veľký význam pre udržanie a správnu orientáciu tela v priestore, keďže k bunkám jadra Deiters vhodné sú procesy neurónov, ktoré majú receptorové aparáty v polkruhoch vestibulárneho aparátu.
3. Spája sa s mozočkom a stredným mozgom rubrospinálny trakt pochádzajúce z buniek červených jadier miechy. Impulzy idúce po tejto dráhe riadia všetky automatické pohyby.
4. Nemenej významné je spojenie medzi miechou a kvadrigeminálnym stredným mozgom, ktoré sa vykonáva tektospinálny A retikulospinálna spôsoby. Kvadrigeminálna oblasť prijíma vlákna z optického nervu a z okcipitálnej oblasti kôry a impulzy putujúce touto cestou k motorickým neurónom poskytujú objasnenie a smer pohybov.
Miecha je najstaršia a najprimitívnejšia formácia centrálneho nervového systému stavovcov, ktorá si zachováva svoju morfologickú a funkčnú segmentáciu u najviac organizovaných zvierat. Charakteristickým znakom organizácie miechy je periodicita jej štruktúry vo forme segmentov so vstupmi vo forme dorzálnych koreňov, bunkovej hmoty neurónov (sivá hmota) a výstupov vo forme predných koreňov.
Ľudská miecha má 31-33 segmentov: 8 krčných, 12 hrudných, 5 bedrových. 5 sakrálnych, 1-3 kostrčových.
Medzi segmentmi miechy neexistujú žiadne morfologické hranice, preto je rozdelenie na segmenty funkčné a je určené zónou distribúcie vlákien dorzálnych koreňov v nej a zónou buniek, ktoré tvoria výstup predných koreňov. Každý segment inervuje tri telesné metaméry cez svoje korene a tiež prijíma informácie z troch telesných metamér. V dôsledku prekrytia je každý metamér tela inervovaný tromi segmentmi a prenáša signály do troch segmentov miechy.
Ľudská miecha má dve zhrubnutia: krčné a bedrové - obsahujú väčší počet neurónov ako v iných jej častiach. Vlákna pohybujúce sa pozdĺž chrbtových koreňov miechy vykonávajú funkcie, ktoré sú určené tým, kde a na ktorých neurónoch tieto vlákna končia. Chrbtové korene sú aferentné, citlivé, dostredivé. Predné - eferentné, motorické, odstredivé.
Aferentné vstupy do miechy sú organizované axónmi miechových ganglií ležiacich mimo miechy, axónmi extramurálnych a intramurálnych ganglií sympatických a parasympatických oddelení autonómneho nervového systému.
Prvú skupinu aferentných vstupov miechy tvoria senzorické vlákna pochádzajúce zo svalových receptorov, šľachových receptorov, periostu a kĺbových membrán. Táto skupina receptorov tvorí začiatok proprioceptívnej citlivosti.
Druhá skupina aferentných vstupov miechy vychádza z kožných receptorov: bolesti, teploty, hmatu, tlaku – a predstavuje kožný receptívny systém.
Tretiu skupinu aferentných vstupov miechy predstavujú receptívne vstupy z viscerálnych orgánov; Toto je visceroceptívny systém.
Eferentné (motorické) neuróny sa nachádzajú v predných rohoch miechy, ich vlákna inervujú všetky kostrové svaly.
Miecha má dve funkcie: vodivú a reflexnú.
Miecha plní vodivú funkciu vďaka vzostupným a zostupným cestám prechádzajúcich bielou hmotou miechy. Tieto dráhy navzájom spájajú jednotlivé segmenty miechy. Miecha spája perifériu s mozgom dlhými vzostupnými a zostupnými dráhami. Aferentné impulzy pozdĺž miechových dráh sú prenášané do mozgu, nesúce informácie o zmenách vo vonkajšom a vnútornom prostredí tela. Pozdĺž zostupných dráh sa impulzy z mozgu prenášajú do efektorových neurónov miechy a spôsobujú alebo regulujú ich činnosť.
Ako reflexné centrum je miecha schopná vykonávať zložité motorické a autonómne reflexy. Je spojený aferentnými - senzitívnymi - dráhami s receptormi a eferentnými dráhami - s kostrovým svalstvom a všetkými vnútornými orgánmi.
Sivá hmota miechy, zadné a predné korene miechových nervov a vnútorné zväzky bielej hmoty tvoria segmentový aparát miechy. Zabezpečuje reflexnú (segmentovú) funkciu miechy.
Nervové centrá miechy sú segmentové alebo pracovné centrá. Ich neuróny sú priamo spojené s receptormi a pracovnými orgánmi. Funkčná diverzita neurónov miechy, prítomnosť aferentných neurónov, interneurónov, motorických neurónov a neurónov autonómneho nervového systému, ako aj početné priame a inverzné, segmentové, intersegmentálne spojenia a spojenia s mozgovými štruktúrami - to všetko vytvára podmienky pre reflexná aktivita miechy za účasti , a to ako vlastných štruktúr, tak aj mozgu.
Takáto organizácia umožňuje realizáciu všetkých motorických reflexov tela, bránice, genitourinárneho systému a konečníka, termoreguláciu, vaskulárne reflexy atď.
Nervový systém funguje podľa reflexných princípov. Reflex je odpoveďou organizmu na vonkajší alebo vnútorný vplyv a šíri sa po reflexnom oblúku, t.j. Vlastná reflexná činnosť miechy sa uskutočňuje segmentálnymi reflexnými oblúkmi. Reflexné oblúky sú obvody tvorené nervovými bunkami.
V reflexnom oblúku je päť článkov:
receptor;
citlivé vlákna vedú excitáciu do centier;
nervové centrum, kde dochádza k prepínaniu vzruchu zo zmyslových buniek na motorické;
motorické vlákno prenášajúce nervové impulzy do periférie;
pôsobiacim orgánom je sval alebo žľaza.
Najjednoduchší reflexný oblúk zahŕňa senzitívne a eferentné neuróny, po ktorých sa nervový impulz presúva z miesta vzniku (receptor) do pracovného orgánu (efektor).Telo prvého citlivého (pseudo-unipolárneho) neurónu sa nachádza v spinálnom gangliu. . Dendrit začína receptorom, ktorý vníma vonkajšiu alebo vnútornú stimuláciu (mechanickú, chemickú atď.) a premieňa ju na nervový impulz, ktorý sa dostane do tela nervovej bunky. Z tela neurónu pozdĺž axónu sa nervový impulz posiela cez senzorické korene miechových nervov do miechy, kde sa vytvárajú synapsie s telami efektorových neurónov. V každej interneurónovej synapsii dochádza k prenosu impulzov pomocou biologicky aktívnych látok (mediátorov). Axón efektorového neurónu opúšťa miechu ako súčasť predných koreňov miechových nervov (motorické alebo sekrečné nervové vlákna) a smeruje k pracovnému orgánu, čo spôsobuje svalovú kontrakciu a zvýšenú (inhibovanú) sekréciu žliaz.
Funkčne sú reflexnými centrami miechových reflexov jadrá miechy. V krčnej mieche je centrum bránicového nervu, centrum zúženia zrenice. V krčnej a hrudnej oblasti sú motorické centrá pre svaly horných končatín, hrudníka, brucha a chrbta. V bedrovej oblasti sa nachádzajú centrá svalov dolných končatín. Sakrálna oblasť obsahuje centrá na močenie, defekáciu a sexuálnu aktivitu. V bočných rohoch hrudnej a bedrovej oblasti sú centrá potenia a vazomotorické centrá.
Miecha má segmentovú štruktúru. Segment je segment, ktorý dáva vznik dvom párom koreňov. Ak sú zadné korene žaby prerezané na jednej strane a predné korene na druhej strane, potom nohy na strane, kde sú odrezané zadné korene, stratia citlivosť a na opačnej strane, kde sú odrezané predné korene, bude paralyzovaný. V dôsledku toho sú dorzálne korene miechy citlivé a predné sú motorické.
Reflexné reakcie miechy závisia od miesta, sily stimulácie, oblasti podráždenej reflexnej zóny, rýchlosti vedenia po aferentných a eferentných vláknach a napokon od vplyvu mozgu. Sila a trvanie miechových reflexov sa zvyšuje pri opakovanej stimulácii. Každý miechový reflex má svoje vlastné receptívne pole a svoju lokalizáciu (umiestnenie), svoju úroveň. Napríklad stred kožného reflexu sa nachádza v bedrovom segmente II-IV; Achilles - v V bedrových a I-II sakrálnych segmentoch; plantar - v I-II sakrálnom, stred brušných svalov - v VIII-XII hrudných segmentoch. Najdôležitejším vitálnym centrom miechy je motorické centrum bránice, ktoré sa nachádza v cervikálnych segmentoch III-IV. Jeho poškodenie vedie k smrti v dôsledku zástavy dýchania.
Miecha pozostáva z dvoch symetrických polovíc, oddelených od seba vpredu hlbokou strednou trhlinou a vzadu stredným sulcusom. Miecha je charakterizovaná segmentálnou (metamerickou) štruktúrou (31-33 segmentov); každý segment je spojený s párom predných (ventrálnych) a párom zadných (dorzálnych) koreňov.
V mieche sú šedá hmota, ktorý sa nachádza v centrálnej časti, a Biela hmota, ležiace na periférii.
Vonkajšiu hranicu bielej hmoty miechy tvoria obmedzujúca gliová membrána, pozostávajúce z fúzovaných sploštených procesov astrocytov. Táto membrána je prepichnutá nervovými vláknami, ktoré tvoria predné a zadné korene.
Cez celú miechu, v strede šedej hmoty, prechádza centrálny kanál miechy, ktorý komunikuje s komorami mozgu.
Sivá hmota v priereze má vzhľad motýľa a zahŕňa vpredu alebo ventrálne, zadná časť, alebo chrbtová, a bočné alebo bočné rohy. Sivá hmota obsahuje telá, dendrity a (čiastočne) axóny neurónov, ako aj gliové bunky. Hlavnou zložkou šedej hmoty, ktorá ju odlišuje od bielej hmoty, sú multipolárne neuróny. Medzi bunkovými telami neurónov je neuropil- sieť tvorená nervovými vláknami a výbežkami gliových buniek.
Medzi všetkými neurónmi miechy možno rozlíšiť tri typy buniek:
radikulárny,
· vnútorné,
· zviazaný.
Axóny radikulárne bunky opustiť miechu ako súčasť jej predných koreňov; sú to bunky bočných a predných rohov. Procesy vnútorné bunky končia synapsiami v sivej hmote miechy (hlavne neuróny chrbtových rohov). Axóny chumáčové bunky prechádzajú cez bielu hmotu v oddelených zväzkoch vlákien, ktoré prenášajú nervové impulzy z určitých jadier miechy do jej ďalších segmentov alebo do zodpovedajúcich častí mozgu, pričom vytvárajú dráhy.
Pri vývoji miechy z nervovej trubice sa neuróny izogeneticky zoskupujú do 10 vrstiev, príp. Rexed taniere. V tomto prípade platničky I-V zodpovedajú zadným rohom, platničky VI-VII - stredná zóna, platničky VIII-IX - predné rohy, platňa X - zóna blízko centrálneho kanála. Na priečnych rezoch sú jasnejšie viditeľné jadrové skupiny neurónov a na sagitálnych rezoch je lepšie viditeľná lamelárna štruktúra, kde sú neuróny zoskupené do Rexedových stĺpcov.
Bunky podobné veľkosťou, štruktúrou a funkčným významom ležia v sivej hmote v skupinách tzv jadrá.
IN zadné rohy rozlíšiť hubovitú vrstvu, želatínovú substanciu, jadro dorzálneho rohu a Clarkovo hrudné jadro, Rolandovo jadro s inhibičnými neurónmi, Lissauerovu oblasť.
Neuróny hubovitá zóna a želatínová hmota Komunikujú medzi zmyslovými bunkami miechových ganglií a motorickými bunkami predných rohov, uzatvárajú lokálne reflexné oblúky.
Neuróny Clarke jadrá prijímajú informácie z receptorov svalov, šliach a kĺbov (proprioceptívna citlivosť) pozdĺž najhrubších radikulárnych vlákien a prenášajú ich do mozočku, sú to veľké multipolárne neuróny.
Neuróny vlastné jadro dorzálny roh sú interkalárne malé multipolárne bunky, ktorých axóny končia v sivej hmote miechy na tej istej strane (asociatívne bunky) alebo na opačnej strane (komisurálne bunky).
Medzi zadnými a laterálnymi rohmi vystupuje sivá hmota do bielej hmoty v prameňoch, v dôsledku čoho vzniká jej sieťovité uvoľnenie, nazývané retikulárna formácia alebo retikulárna formácia miechy.
V strednej zóne (bočné rohy) sú umiestnené centrá autonómneho (autonómneho) nervového systému - pregangliové cholinergné neuróny jeho sympatického a parasympatického oddelenia.
IN predné rohy Sú umiestnené najväčšie neuróny miechy. Sú to radikulárne bunky, pretože ich axóny tvoria väčšinu vlákien predných koreňov. V predných rohoch sú 3 typy neurónov, ktoré tvoria 5 objemovo významných skupín jadier (laterálna - predná a zadná skupina, mediálna - predná a zadná skupina a centrálne alebo stredné jadro).
Alfa motorické neuróny- veľké neuróny 100-140 mikrónov. Podľa funkcie sú motorické a ich axóny, ako súčasť predných koreňov, opúšťajú miechu a smerujú do priečne pruhovaných svalov.
Gama motorické neuróny– menšie, sú bunky, ktoré riadia silu a rýchlosť kontrakcie.
Renshawove bunky - inhibičné bunky vykonávajú vzájomnú inhibíciu flexorových a extenzorových motorických neurónov a tiež vykonávajú recipročnú inhibíciu.
Biela hmota Rohy mozgu sú rozdelené do stĺpcov: predné (zostupné), stredné (zmiešané) a zadné (vzostupné). Biela hmota miechy je súbor pozdĺžne orientovaných prevažne myelinizovaných nervových vlákien. Zväzky nervových vlákien, ktoré komunikujú medzi rôznymi časťami nervového systému, sa nazývajú dráhy alebo dráhy miechy.
4. Reflexný aparát miechy (somatické reflexné oblúky)
Elementárny reflexný oblúk vlastného aparátu miechy predstavujú dva neuróny. Telo prvého aferentný neurón nachádza sa v miechovom gangliu. Jeho dendrit smeruje na perifériu a končí receptorom. Axón aferentného neurónu ako súčasť dorzálnych koreňov vstupuje do miechy, jej dorzálnych rohov a prechádza do buniek predných rohov miechy. Predné rohy obsahujú telá motorické eferentné bunky– veľké alfa motorické neuróny, na ktorých končí axón senzitívnej bunky axosomatickou synapsiou. Axón eferentného neurónu opúšťa miechu, vstupuje do ventrálnych koreňov, potom vstupuje do miechového nervu, plexu a nakoniec dosahuje somatický nerv. efektorový orgán(svaly, žľazy).
Pri podráždení (pichnutie do prsta) sa podráždi receptorový aparát (kožné noceceptory) a vytvorí sa nervový impulz, ktorý sa dostredivo vedie cez dendrit, telo aferentného neurónu a jeho axón cez synaptické spojenie s telo druhého eferentného neurónu. Odtiaľ nervový impulz odstredivo opúšťa miechu, predný koreň a nerv cez bunkový axón a spôsobuje excitáciu v efektorovom orgáne (m. biceps brachii), čo zase vedie k očakávanému účinku - stiahnutiu ruky.
Princíp štruktúry a fungovania vegetatívnych reflexných oblúkov sa chápe nezávisle.
1.1. Nervový systém: všeobecná štruktúra
Nervový systém je systém tela, ktorý integruje a reguluje rôzne fyziologické procesy v súlade s meniacimi sa podmienkami vonkajšieho a vnútorného prostredia. Nervový systém pozostáva zo zmyslových komponentov, ktoré reagujú na podnety vychádzajúce z prostredia, integračných komponentov, ktoré spracúvajú a uchovávajú zmyslové a iné údaje, a motorických komponentov, ktoré riadia pohyby a sekrečnú činnosť žliaz.
Nervový systém vníma zmyslové podnety, spracováva informácie a generuje správanie. Špeciálnymi druhmi spracovania informácií sú učenie a pamäť, vďaka ktorým sa pri zmene prostredia prispôsobuje správanie s prihliadnutím na predchádzajúce skúsenosti. Iné systémy, ako je endokrinný a imunitný systém, sú tiež zapojené do týchto funkcií, ale nervový systém je špecializovaný na vykonávanie týchto funkcií. Spracovaním informácií sa rozumie prenos informácií v neurónových sieťach, transformácia signálov ich kombináciou s inými signálmi (neurálna integrácia), ukladanie informácií do pamäte a získavanie informácií z pamäte, využitie zmyslových informácií na vnímanie, myslenie , učenie, plánovanie (príprava) a vykonávanie pohybových pohybov.príkazy, formovanie emócií. K interakciám medzi neurónmi dochádza prostredníctvom elektrických aj chemických procesov.
Správanie je komplex reakcií organizmu na meniace sa podmienky vonkajšieho a vnútorného prostredia. Správanie môže byť čisto vnútorný, skrytý proces (poznávanie) alebo prístupný vonkajšiemu pozorovaniu (motorické alebo autonómne reakcie). U ľudí je obzvlášť dôležitý súbor aktov správania, ktoré sú spojené s rečou. Každá reakcia, jednoduchá alebo zložitá, je zabezpečená nervovými bunkami organizovanými do neurónových sietí (nervových súborov a dráh).
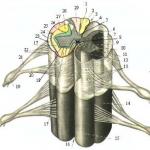
Nervový systém sa delí na centrálny a periférny (obr. 1.1). Centrálny nervový systém (CNS) pozostáva z mozgu a miechy. Periférny nervový systém zahŕňa korene, plexusy a nervy.
Ryža. 1.1. Všeobecná štruktúra nervového systému.
A- Centrálny nervový systém. B- Mozgový kmeň: 1 - telencephalon; 2 - diencephalon; 3 - stredný mozog; 4 - mostík a cerebellum, 5 - predĺžená miecha, 6 - telencephalon stredné štruktúry. IN- Miecha: 7 - miechový kužeľ; 8 - koncové závity. G- Periférny nervový systém: 9 - ventrálny koreň; 10- dorzálny koreň; 11 - spinálny ganglion; 12 - miechový nerv; 13 - zmiešaný periférny nerv; 14 - epineurium; 15 - perineurium; 16 - myelínový nerv; 17 - fibrocyt; 18 - endoneurium; 19 - kapilára; 20 - nemyelinizovaný nerv; 21 - kožné receptory; 22 - koniec motorického neurónu; 23 - kapilára; 24 - svalové vlákna; 25 - jadro Schwannovej bunky; 26 - zachytenie Ranviera; 27 - sympatický kmeň; 28 - spojovacia vetva
centrálny nervový systém
Centrálny nervový systém zhromažďuje a spracováva informácie o prostredí prichádzajúce z receptorov, vytvára reflexy a iné behaviorálne reakcie, plánuje a vykonáva vôľové pohyby. Okrem toho centrálny nervový systém zabezpečuje takzvané vyššie kognitívne (kognitívne) funkcie. Procesy súvisiace s pamäťou, učením a myslením prebiehajú v centrálnom nervovom systéme.
Počas procesu ontogenézy sa mozog tvorí z mozgových vezikúl, ktoré vznikajú v dôsledku nerovnomerného rastu predných úsekov dreňovej trubice (obr. 1.2). Z týchto vezikúl sa tvorí predný mozog (prosencephalon), stredný mozog (mezencefalón) a rhombencephalon (rombencefalón). Následne sa z predného mozgu vytvorí terminálny mozog (telencephalon) a stredne pokročilý (diencephalon) mozog a rhombencephalon sa delí na zadný mozog (metencephalon) a podlhovasté (myelencefalón, alebo medulla oblongata) mozgu. Z telencefalu, respektíve mozgových hemisfér vznikajú bazálne gangliá, z diencefala - talamus, epitalamus, hypotalamus, metatalamus, zrakové dráhy a nervy a sietnica. Optické nervy a sietnica sú časti centrálneho nervového systému, zdanlivo umiestnené mimo mozgu. Zo stredného mozgu sa tvoria lamina quadrigemina a mozgové stopky. Zo zadného mozgu sa tvorí mostík a mozoček. Pons mozog hraničí dole s medulla oblongata.
Zadná časť medulárnej trubice tvorí miechu a jej dutina sa stáva centrálnym kanálom miechy. Miecha pozostáva z krčnej, hrudnej, driekovej, krížovej a kostrčovej časti, z ktorých každá pozostáva zo segmentov.
Centrálny nervový systém je rozdelený na šedú a bielu hmotu. Šedá hmota je súborom telies neurónov, biela hmota sú procesy neurónov pokrytých myelínovým obalom. V mozgu sa sivá hmota nachádza v mozgovej kôre, subkortikálnych gangliách, jadrách mozgového kmeňa, mozočkovej kôre a jej jadrách. V mieche je šedá hmota sústredená v jej strede, biela hmota - na periférii.
Periférny nervový systém
Periférny nervový systém (PNS) je zodpovedný za rozhranie medzi prostredím (alebo excitabilnými bunkami) a centrálnym nervovým systémom. PNS zahŕňa senzorické (receptory a primárne aferentné neuróny) a motorické (somatické a autonómne motorické neuróny) zložky.
 Ryža. 1.2. Embryonálny vývoj nervového systému cicavcov. Schéma vývoja nervového oddelenia v treťom štádiu (A) a päť (B) mozgové bubliny. A. I- Celkový bočný pohľad: 1 - kraniálny ohyb; 2 - cervikálny ohyb; 3 - miechový uzol. II- Pohľad zhora: 4 - predný mozog; 5 - stredný mozog; 6 - kosoštvorcový mozog; 7 - neurocoel; 8 - stena nervovej trubice; 9 - rudimentárna miecha.
Ryža. 1.2. Embryonálny vývoj nervového systému cicavcov. Schéma vývoja nervového oddelenia v treťom štádiu (A) a päť (B) mozgové bubliny. A. I- Celkový bočný pohľad: 1 - kraniálny ohyb; 2 - cervikálny ohyb; 3 - miechový uzol. II- Pohľad zhora: 4 - predný mozog; 5 - stredný mozog; 6 - kosoštvorcový mozog; 7 - neurocoel; 8 - stena nervovej trubice; 9 - rudimentárna miecha.
B. I- Celkový bočný pohľad. B. II- Pohľad zhora: 10 - telencephalon; 11 - laterálna komora; 12 - diencephalon; 13 - očná stopka; 14 - šošovka; 15 - zrakový nerv; 16 - stredný mozog; 17 - zadný mozog; 18 - medulla oblongata; 19 - miecha; 20 - centrálny kanál; 21 - štvrtá komora; 22 - cerebrálny akvadukt; 23 - tretia komora. III- Bočný pohľad: 24 - neobark; 25 - interventrikulárna priehradka; 26 - striatum; 27 - globus pallidus; 28 - hipokampus; 29 - talamus; 30 - epifýzové telo; 31 - horné a dolné colliculi; 32 - cerebellum; 33 - zadný mozog; 34 - miecha; 35 - medulla oblongata; 36 - mostík; 37 - stredný mozog; 38 - neurohypofýza; 39 - hypotalamus; 40 - amygdala; 41 - čuchový trakt; 42 - čuchová kôra
Senzorická časť PNS. Zmyslové vnímanie je premena energie vonkajšieho podnetu na nervový signál. Vykonávajú ho špecializované štruktúry - receptory, ktoré vnímajú účinky rôznych druhov vonkajšej energie na telo, vrátane mechanických, svetelných, zvukových, chemických podnetov a zmien teploty. Na periférnych zakončeniach primárnych aferentných neurónov sú umiestnené receptory, ktoré prenášajú prijaté informácie do centrálneho nervového systému pozdĺž senzorických vlákien nervov, plexusov, miechových nervov a nakoniec pozdĺž dorzálnych koreňov miechy (alebo hlavových nervov). Bunkové telá dorzálnych koreňov a hlavových nervov sa nachádzajú v miechových gangliách alebo v gangliách hlavových nervov.
Motorová časť PNS. Motorická zložka PNS zahŕňa somatické a autonómne (autonómne) motorické neuróny. Somatické motorické neuróny inervujú priečne pruhované svaly. Bunkové telá sú umiestnené v prednom rohu miechy alebo v mozgovom kmeni a majú dlhé dendrity, ktoré prijímajú mnoho synaptických „vstupov“. Motorické neuróny každého svalu tvoria špecifické motorické jadro - skupinu neurónov centrálneho nervového systému, ktoré majú podobné funkcie. Napríklad tvárové svaly sú inervované z jadra tvárového nervu. Axóny somatických motorických neurónov opúšťajú centrálny nervový systém cez predný koreň alebo cez hlavový nerv.
Autonómne (autonómne) motorické neuróny posielajú nervy do hladkých svalových vlákien a žliaz - pregangliové a postgangliové neuróny sympatického a parasympatického nervového systému. Pregangliové neuróny sa nachádzajú v centrálnom nervovom systéme – v mieche alebo mozgovom kmeni. Na rozdiel od somatických motorických neurónov, autonómne pregangliové neuróny tvoria synapsie nie na efektorových bunkách (hladký sval alebo žľazy), ale na postgangliových neurónoch, ktoré zase synapsiu priamo s efektormi.
1.2. Mikroskopická štruktúra nervového systému
Nervový systém sa skladá z nervových buniek alebo neurónov, ktoré sa špecializujú na prijímanie prichádzajúcich signálov a prenos signálov do iných neurónov alebo efektorových buniek. Okrem nervových buniek obsahuje nervový systém gliové bunky a prvky spojivového tkaniva. Neurogliálne bunky (z gréckeho „glia“ - lepidlo)
plnia podporné, trofické a regulačné funkcie v nervovom systéme a zúčastňujú sa takmer všetkých typov neuronálnej aktivity. Kvantitatívne prevažujú nad neurónmi a zaberajú celý objem medzi cievami a nervovými bunkami.
Nervová bunka
Hlavnou stavebnou a funkčnou jednotkou nervového systému je neurón (obr. 1.3). Neurón má telo (soma) a procesy: dendrity a axón. Soma a dendrity predstavujú receptívny povrch bunky. Axón nervovej bunky tvorí synaptické spojenie s inými neurónmi alebo s efektorovými bunkami. Nervový impulz sa šíri vždy jedným smerom: pozdĺž dendritov do tela bunky, pozdĺž axónu - z tela bunky (Ramon y Cajalov zákon dynamickej polarizácie nervovej bunky). Typicky má neurón veľa „vstupov“ vytvorených dendritmi a iba jeden „výstup“ (axón) (pozri obr. 1.3).
Neuróny medzi sebou komunikujú pomocou akčných potenciálov, ktoré sa pohybujú pozdĺž axónov. Akčné potenciály sa pohybujú z jedného neurónu na druhý prostredníctvom synaptického prenosu. Akčný potenciál, ktorý dosiahne presynaptický terminál, zvyčajne spúšťa uvoľnenie neurotransmiteru, ktorý buď excituje postsynaptickú bunku tak, že produkuje výboj jedného alebo viacerých akčných potenciálov, alebo inhibuje jej aktivitu. Axóny neprenášajú informácie len v nervoch
 Ryža. 1.3.Štruktúra neurónu. A- Typický neurón pozostávajúci zo samotného tela, dendritov a axónu: 1 - začiatok axónu; 2 - dendrity; 3 - telo neurónu; 4 - axón; 5 - Schwannova bunka; 6 - vetvenie axónov. B- Zväčšené telo neurónu. Axonálny pahorok neobsahuje látku Nissl: 7 - jadro; 8 - Golgiho prístroje; 9 - mitochondrie; 10 - axonálny pahorok; 11 - látka Nissl
Ryža. 1.3.Štruktúra neurónu. A- Typický neurón pozostávajúci zo samotného tela, dendritov a axónu: 1 - začiatok axónu; 2 - dendrity; 3 - telo neurónu; 4 - axón; 5 - Schwannova bunka; 6 - vetvenie axónov. B- Zväčšené telo neurónu. Axonálny pahorok neobsahuje látku Nissl: 7 - jadro; 8 - Golgiho prístroje; 9 - mitochondrie; 10 - axonálny pahorok; 11 - látka Nissl
reťazce, ale tiež dodávajú chemikálie na synaptické terminály axonálnym transportom.
Existujú početné klasifikácie neurónov podľa tvaru ich tela, dĺžky a tvaru dendritov a iných charakteristík (obr. 1.4). Nervové bunky sa podľa funkčného významu delia na aferentné (senzitívne, senzorické), privádzajúce impulzy do centra, eferentné (motorické, motorické), prenášajúce informácie z centra do periférie, a interneuróny (interneuróny), v ktorých sú impulzy spracovávané a sú organizované kolaterálne spojenia.
Nervová bunka vykonáva dve hlavné funkcie: špecifické spracovanie prichádzajúcich informácií a prenos nervových impulzov a biosyntetickú, zameranú na udržanie jej životných funkcií. To sa prejavuje aj v ultraštruktúre nervovej bunky. Prenos informácií z jednej nervovej bunky do druhej, spojenie nervových buniek do systémov a komplexov rôznej zložitosti sa uskutočňuje prostredníctvom neurónových štruktúr: axónov, dendritov a synapsií. Organely spojené s energetickým metabolizmom a funkciou bunky syntetizujúcou proteín sa nachádzajú vo väčšine buniek; v nervových bunkách plnia funkcie zásobovania bunky energiou, spracovania a prenosu informácií (pozri obr. 1.3).
Štruktúra neurónov. Soma. Telo nervovej bunky má okrúhly alebo oválny tvar, s jadrom umiestneným v strede (alebo mierne excentrické). Obsahuje jadro a je obklopený vonkajšími a vnútornými jadrovými membránami, každá s hrúbkou asi 70 Á, oddelenými peri-
 Ryža. 1.4. Varianty neurónov rôznych tvarov.
Ryža. 1.4. Varianty neurónov rôznych tvarov.
A- Pseudounipolárny neurón. B- Purkyňova bunka (dendrity, axón). IN- pyramídová bunka (axón). G- motorický neurón predného rohu (axón)
jadrový priestor, ktorého rozmery sú variabilné. Hrudky chromatínu sú distribuované v karyoplazme, lokalizované hlavne na vnútornej jadrovej membráne. V cytoplazme nervových buniek sa nachádzajú prvky granulárneho a negranulárneho cytoplazmatického retikula, polyzómy, ribozómy, mitochondrie, lyzozómy, multivezikulárne telieska a iné organely (obr. 1.5).
Biosyntetický aparát v neurónoch zahŕňa Nissl telieska - tesne susediace sploštené cisterny granulárneho endoplazmatického retikula, ako aj dobre definovaný Golgiho aparát. Okrem toho soma obsahuje početné mitochondrie, ktoré určujú jej energetický metabolizmus, a cytoskeletálne prvky vrátane neurofilamentov a mikrotubulov. Lyzozómy a fagozómy sú hlavnými organelami „intracelulárneho tráviaceho traktu“.
Dendrity. Dendrity a ich vetvy určujú receptívne pole konkrétnej bunky (pozri obr. 1.5). Elektrónové mikroskopické vyšetrenie odhalí, že telo neurónu sa postupne premieňa na dendrit. Neexistujú žiadne ostré hranice alebo výrazné rozdiely v ultraštruktúre soma a počiatočnej časti veľkého dendritu. Dendrity majú veľmi variabilný tvar, veľkosť, vetvenie a ultraštruktúru. Typicky niekoľko dendritov vystupuje z tela bunky. Dĺžka dendritov môže presiahnuť 1 mm, tvoria viac ako 90% povrchu neurónu.
Hlavnými zložkami cytoplazmy dendritov sú mikrotubuly a neurofilamenty; proximálne časti dendritov (bližšie k telu bunky) obsahujú Nisslove telieska a úseky Golgiho aparátu. Predtým sa verilo, že dendrity sú elektricky nevybuditeľné; teraz sa dokázalo, že dendrity mnohých
 Ryža. 1.5. Ultraštruktúra nervovej bunky.
Ryža. 1.5. Ultraštruktúra nervovej bunky.
1 - jadro; 2 - granulárne endoplazmatické retikulum; 3 - lamelárny komplex (Golgi); 4 - mitochondrie; 5 - lyzozómy; 6 - multivezikulárne telo; 7 - polyzómy
neuróny majú napäťovo závislú vodivosť, ktorá je spôsobená prítomnosťou vápnikových kanálov na ich membránach, pri aktivácii ktorých sa vytvárajú akčné potenciály.
Axon. Axón pochádza z axónového pahorku - špecializovanej časti bunky (zvyčajne soma, ale niekedy aj dendrit) (pozri obr. 1.3). Axón a axónový vrch sa líšia od soma a proximálnych dendritov v neprítomnosti granulárneho endoplazmatického retikula, voľných ribozómov a Golgiho aparátu. Axón obsahuje hladké endoplazmatické retikulum a výrazný cytoskelet.
Axóny sú pokryté myelínovou pošvou, tvoriacou myelínové vlákna. Zväzky vlákien (ktoré môžu obsahovať jednotlivé nemyelinizované vlákna) tvoria bielu hmotu mozgu, hlavových a periférnych nervov. Keď axón prechádza do presynaptického zakončenia, vyplneného synaptickými vezikulami, axón tvorí predĺženie v tvare banky.
Prelínanie axónov, dendritov a výbežkov gliových buniek vytvára zložité, neopakujúce sa vzorce neuropilu. Distribúcia axónov a dendritov, ich relatívna poloha, aferentno-eferentné vzťahy a vzorce synaptoarchitektúry určujú mechanizmy integračnej funkcie mozgu.
Typy neurónov. Polymorfizmus v štruktúre neurónov je určený ich rôznymi úlohami v systémovej aktivite mozgu ako celku. Neuróny dorzálnych koreňových ganglií miechy (spinálne gangliá) teda dostávajú informácie nie cez synaptický prenos, ale zo senzorických nervových zakončení v receptorových orgánoch. V súlade s tým sú telá týchto neurónov zbavené dendritov a neprijímajú synaptické zakončenia (bipolárne bunky; obr. 1.6). Po opustení bunkového tela je axón takého neurónu rozdelený na dve vetvy, z ktorých jedna (periférny proces) je odoslaná ako súčasť periférneho nervu k receptoru a druhá vetva (centrálny proces) vstupuje do miechy ( ako súčasť dorzálneho koreňa) alebo mozgového kmeňa (ako súčasť hlavového nervu). Neuróny iného typu, ako sú pyramídové bunky mozgovej kôry a Purkyňove bunky cerebelárneho kortexu, sú zaneprázdnené spracovávaním informácií. Ich dendrity sú pokryté dendritickými tŕňmi a majú rozsiahly povrch; prijímajú obrovské množstvo synaptických vstupov (multipolárne bunky; pozri obr. 1.4, 1.6). Neuróny je možné klasifikovať podľa dĺžky ich axónov. Golgiho neuróny typu 1 majú krátke axóny, ktoré končia, podobne ako dendrity, blízko somy. Neuróny typu 2 majú dlhé axóny, niekedy dlhšie ako 1 m.
Neuroglia
Ďalšou skupinou bunkových elementov nervového systému sú neuroglie (obr. 1.7). V ľudskom centrálnom nervovom systéme je počet neurogliových buniek rádovo väčší ako počet neurónov: 10 13 a 10 12, v tomto poradí. Úzky morfologický vzťah je základom pre fyziologické a patologické interakcie medzi gliami a neurónmi. Ich vzťahy popisuje koncept dynamických neurónovo-gliových signalizačných procesov. Schopnosť prenášať signály z neurónov do glií a tým aj do iných neurónov otvára mnoho možností pre medzibunkové „preslechy“.
Existuje niekoľko typov neuroglií, v CNS sú neuroglie reprezentované astrocytmi a oligodendrocytmi a v PNS sú to Schwannove bunky a satelitné bunky. Okrem toho sa mikrogliové bunky a ependymálne bunky považujú za centrálne gliové bunky.
Astrocyty(pomenované podľa hviezdicového tvaru) regulujú stav mikroprostredia okolo neurónov CNS. Ich procesy sú obklopené skupinami synaptických terminálov, ktoré sú v dôsledku toho izolované od susedných synapsií. Špeciálne procesy - „nohy“ astrocytov vytvárajú kontakty s kapilárami a spojivovým tkanivom na povrchu mozgu a miechy (pia mater) (obr. 1.8). Nohy obmedzujú voľnú difúziu látok do centrálneho nervového systému. Astrocyty môžu aktívne vychytávať K+ a neurotransmitery a následne ich metabolizovať. Vďaka selektívne zvýšenej permeabilite pre ióny K+ astroglia reguluje aktiváciu enzýmov nevyhnutných na udržanie metabolizmu neurónov, ako aj na odstraňovanie mediátorov a iných látok uvoľnených počas procesu neurónov.
 Ryža. 1.6. Klasifikácia neurónov podľa počtu procesov vychádzajúcich z tela bunky.
Ryža. 1.6. Klasifikácia neurónov podľa počtu procesov vychádzajúcich z tela bunky.
A - bipolárne. B- pseudounipolárny. IN- multipolárny. 1 - dendrity; 2 - axón
 Ryža. 1.7. Hlavné typy gliových buniek.
Ryža. 1.7. Hlavné typy gliových buniek.
A- Protoplazmatický astrocyt. B- mikrogliálna bunka. IN- oligoderdrocyt. G- vláknitý astrocyt
ná činnosť. Astroglia sa podieľa na syntéze imunitných mediátorov: cytokínov, iných signálnych molekúl (cyklický guanozínmonofosfát - cCOMP, oxid dusnatý - NO), potom sa prenáša do neurónov, - pri syntéze gliových rastových faktorov ( GDNF), podieľa sa na trofizme a oprave neurónov. Astrocyty sú schopné reagovať na zvýšenie synaptickej koncentrácie neurotransmiterov a zmeny elektrickej aktivity neurónov zmenami intracelulárnej koncentrácie Ca 2+. To vytvára „vlnu“ migrácie Ca2+ medzi astrocytmi, ktorá môže modulovať stav mnohých neurónov.
Astroglia teda nie je len trofickou zložkou nervového systému, ale podieľa sa na špecifickom fungovaní nervového tkaniva. V cytoplazme astrocytov sú gliové vlákna, ktoré vykonávajú mechanickú podpornú funkciu v tkanive centrálneho nervového systému. Pri poškodení astrocytové procesy obsahujúce gliové vlákna podliehajú hypertrofii a vytvárajú gliovú jazvu.
Hlavná funkcia oligodendrocyty je zabezpečiť elektrickú izoláciu axónov vytvorením myelínového obalu (obr. 1.9). Ide o viacvrstvový obal špirálovito navinutý cez plazmatickú membránu axónov. V PNS je myelínový obal tvorený membránami Schwannových buniek (pozri obr. 1.18). Myelín predstavuje
Je to balík plátov špecifických plazmatických membrán bohatých na fosfolipidy a obsahuje aj niekoľko typov proteínov, odlišných v CNS a PNS. Proteínové štruktúry umožňujú, aby sa plazmatické membrány tesne spojili. Ako membrána gliových buniek rastie, rotuje okolo axónu neurónu a vytvára vrstvenú špirálu s dvojitou plazmatickou membránou okolo axónu. Hrúbka myelínového obalu môže byť 50-100 membrán, ktoré zohrávajú úlohu elektrického izolátora axónu, zabraňujúceho výmene iónov medzi cytozolom axónu a extracelulárnym prostredím.
Okrem toho, neuroglie zahŕňajú satelitné bunky, ktoré opuzdrujú neuróny ganglií miechových a kraniálnych nervov a regulujú mikroprostredie okolo týchto neurónov podobným spôsobom ako astrocyty (obr. 1.10).
Iný typ bunky - mikroglie, alebo latentné fagocyty. Mikroglie sú jediným zastúpením imunokompetentných buniek v centrálnom nervovom systéme. Je široko zastúpený v celom ľudskom mozgovom tkanive a predstavuje 9-12% celkovej populácie glií v sivej hmote a 7,5-9% v bielej hmote. Na rozdiel od astrocytov mikrogliálne bunky pochádzajú z kmeňových buniek a za normálnych podmienok sa rozvetvujú
 Ryža. 1.8. Interakcia astrocytov s okolitými bunkovými prvkami.
Ryža. 1.8. Interakcia astrocytov s okolitými bunkovými prvkami.
1 - tanycit; 2 - komorová dutina; 3 - ependýmové bunky; 4 - kapilára; 5 - neurón; 6 - myelinizovaný axón; 7 - pia mater; 8 - subarachnoidálny priestor.
Obrázok ukazuje dva astrocyty a ich vzťah s ependymálnymi bunkami lemujúcimi komoru, perikaryón, dendrity neurónu, kapiláru a skvamózny epitel pia mater. Treba poznamenať, že tento obrázok je schematický a spojenie neurónu s komorou a subarachnoidálnym priestorom je nepravdepodobné
 Ryža. 1.9. Oligodendrocyt: tvorba myelínovej pošvy axónu. 1 - axón; 2 - myelín; 3 - hladké endoplazmatické retikulum; 4 - neurofilamenty; 5 - mitochondrie
Ryža. 1.9. Oligodendrocyt: tvorba myelínovej pošvy axónu. 1 - axón; 2 - myelín; 3 - hladké endoplazmatické retikulum; 4 - neurofilamenty; 5 - mitochondrie
 Ryža. 1.10. Interakcia medzi gliovými bunkami a neurónmi. Schematicky znázornené šípkami. 1 - satelitná gliová bunka; 2 - gliová bunka, ktorá syntetizuje myelín
Ryža. 1.10. Interakcia medzi gliovými bunkami a neurónmi. Schematicky znázornené šípkami. 1 - satelitná gliová bunka; 2 - gliová bunka, ktorá syntetizuje myelín
kučeravý tvar s mnohými vetvami. Aktivácia mikroglií, najmä v podmienkach hypoxickej ischémie, je sprevádzaná produkciou prozápalových mediátorov s toxickými vlastnosťami. Chronická zápalová reakcia v mozgovom tkanive, ktorú podporujú, vedie k oneskoreným stratám neurónov, poruchám mikrocirkulácie a zmenám funkcie hematoencefalickej bariéry.
Za patologických podmienok sa mikrogliálne bunky sťahujú a nadobúdajú améboidnú formu, ktorá zodpovedá ich výraznej funkčnej aktivácii až do stavu fagocytózy. Keď je mozgové tkanivo poškodené, mikroglie spolu s fagocytmi prenikajúcimi do centrálneho nervového systému z krvného obehu pomáhajú odstraňovať produkty bunkového rozpadu.
Tkanivo centrálneho nervového systému je oddelené od mozgovomiechového moku (CSF), ktorý vypĺňa komory mozgu, epitelom, ktorý tvoria ependýmové bunky. Ependyma umožňuje difúziu mnohých látok medzi extracelulárnym priestorom mozgu a CSF. CSF je vylučovaný špecializovanými ependymálnymi bunkami choroidných plexusov v komorovom systéme.
Zásobovanie mozgovými bunkami živinami a odstraňovanie odpadových produktov buniek prebieha cez cievny systém.
systém. Hoci je nervové tkanivo plné kapilár a iných krvných ciev, hematoencefalická bariéra (BBB) obmedzuje difúziu mnohých látok medzi krvou a tkanivom CNS.
1.3. Elektrický prenos informácií medzi neurónmi
Normálna aktivita nervového systému závisí od excitability jeho neurónov. Vzrušivosť- ide o schopnosť bunkových membrán reagovať na pôsobenie adekvátnych podnetov špecifickými zmenami iónovej vodivosti a membránového potenciálu. Vzrušenie- elektrochemický proces, ktorý prebieha výlučne na cytoplazmatickej membráne bunky a je charakterizovaný zmenami jej elektrického stavu, ktorý spúšťa funkciu špecifickú pre každé tkanivo. Excitácia svalovej membrány teda spôsobuje jej kontrakciu a excitácia membrány neurónu vedie k vedeniu elektrického signálu pozdĺž axónov. Neuróny nie sú riadené len napätím, t.j. iónové kanály regulované pôsobením elektrického budiča, ale aj chemicky a mechanicky riadené.
Existujú rozdiely vo vzťahu medzi membránovým potenciálom/permeabilitou membrány a typom stimulu. Pri vystavení elektrickému stimulu je reťazec udalostí nasledujúci: stimul (elektrický prúd) => posun membránového potenciálu (na kritický potenciál) => aktivácia napäťovo riadených iónových kanálov => zmena iónovej permeability membrány => zmena iónových prúdov cez membránu => ďalší posun membrány potenciál (tvorba akčného potenciálu).
Pri vystavení chemickej dráždivosti nastáva zásadne odlišný reťazec udalostí: stimul (chemická látka) => chemická väzba stimulu a receptora chemo-gated iónového kanála => zmena konformácie komplexu ligand-receptor a otvorenie receptor-gated (chemo-gated) iónových kanálov => zmena v iónovej permeabilite membrány => zmena prúdov iónov cez membránu => posun membránového potenciálu (vznik napr. lokálneho potenciálu).
Reťazec udalostí pod vplyvom mechanického stimulu je podobný predchádzajúcemu, pretože v tomto prípade sa aktivujú aj receptory.
hradlované iónové kanály: stimul (mechanický stres) => zmena membránového napätia => otvorenie receptorom riadených (mechanicky riadených) iónových kanálov => zmena iónovej permeability membrány => zmena iónových prúdov cez membránu => posun membránového potenciálu (vznik mechanicky indukovaného potenciálu).
Pasívne elektrické vlastnosti bunky súvisia s elektrickými vlastnosťami jej membrány, cytoplazmy a vonkajšieho prostredia. Elektrické vlastnosti bunkovej membrány sú určené jej kapacitnými a odporovými charakteristikami, pretože lipidovú dvojvrstvu možno priamo prirovnať ku kondenzátoru aj odporu. Kapacitné charakteristiky lipidovej dvojvrstvy a skutočnej membrány sú podobné, ale odporové charakteristiky sa líšia v dôsledku prítomnosti predovšetkým proteínov, ktoré tvoria iónové kanály. Vo väčšine článkov sa vstupný odpor chová nelineárne: pre prúd tečúci jedným smerom je väčší ako pre prúd tečúci v opačnom smere. Táto vlastnosť asymetrie odráža aktívnu reakciu a nazýva sa narovnávanie. Prúd pretekajúci membránou je určený kapacitnou a odporovou zložkou. Odporová zložka opisuje samotný iónový prúd, pretože elektrina je prenášaná v článku iónmi. Pohybu iónov do bunky alebo z bunky bráni plazmatická membrána. Keďže membrána je lipidová dvojvrstva nepriepustná pre ióny, je odolná. Namiesto toho má membrána určitú vodivosť pre ióny, ktoré prechádzajú cez iónové kanály. Kvôli prekážke voľného pohybu iónov sa rovnaké ióny nachádzajú vonku a vo vnútri bunky, ale v rôznych koncentráciách.
Pre pohyb látok cez membránu existujú dva zásadné mechanizmy – prostredníctvom jednoduchej difúzie (obr. 1.11) a pri
 Ryža. 1.11. Transport látok cez bunkovú membránu.
Ryža. 1.11. Transport látok cez bunkovú membránu.
A- jednoduchá difúzia. B- uľahčená difúzia. IN- aktívny transport: 1- membrána
sila špecifických transportérov zabudovaných do membrány a reprezentujúcich transmembránové integrálne proteíny. Posledný mechanizmus zahŕňa uľahčenú difúziu a aktívny transport iónov, ktoré môžu byť primárne aktívne alebo sekundárne aktívne.
Jednoduchou difúziou (bez pomoci nosiča) môžu byť vo vode nerozpustné organické zlúčeniny a plyny (kyslík a oxid uhličitý) transportované cez lipidovú dvojvrstvu ich rozpustením v lipidoch bunkovej membrány; ióny Na +, Ca 2+, K +, Cl - cez iónové kanály bunkovej membrány spájajúce cytoplazmu buniek s vonkajším prostredím (pasívny transport iónov, ktorý je určený elektrochemickým gradientom a smeruje z vyššieho elektrochemického potenciálu do menšia: vnútri bunky pre ióny Na +, Ca 2+, Cl -, smerom von - pre ióny K+); molekuly vody cez membránu (osmóza).
Pomocou špecifických nosičov nastáva energeticky nezávislá uľahčená difúzia množstva zlúčenín (pozri obr. 1.11). Pozoruhodným príkladom uľahčenej difúzie je transport glukózy cez neurónovú membránu. Bez špecializovaného astrocytického transportéra by bol vstup glukózy do neurónov prakticky nemožný, keďže ide o relatívne veľkú polárnu molekulu. Kvôli rýchlej premene na glukózo-6-fosfát je intracelulárna hladina glukózy nižšia ako extracelulárna hladina, a tak sa udržiava gradient, aby sa zabezpečil kontinuálny tok glukózy do neurónov.
Energeticky závislý primárny aktívny transport iónov Na+, Ca 2 +, K+ a H+ je energeticky závislý prenos látok proti ich elektrochemickým gradientom (pozri obr. 1.11). Vďaka nemu môžu bunky akumulovať ióny vo vyšších koncentráciách ako v prostredí. Pohyb z nižších do vyšších koncentrácií a udržiavanie stabilného gradientu sú možné len pri nepretržitom dodávaní energie do transportného procesu. Počas primárneho aktívneho transportu sa ATP priamo spotrebúva. Energetické pumpy ATP (ATPázy) transportujú ióny proti ich koncentračnému gradientu. Na základe charakteristík molekulárnej organizácie sa rozlišujú 3 triedy - P, V a F (obr. 1.12). Všetky tri triedy ATPáz majú jedno alebo viac väzbových miest ATP na cytosolickom povrchu membrány. Trieda P zahŕňa Ca2+-ATPázu a Na+/K+-ATPázu. Aktívne nosiče transportu iónov sú špecifické pre transportovanú látku a sú saturovateľné, t.j. ich tok je maximálny, keď sú obsadené všetky špecifické väzbové miesta pre transportovanú látku.
Mnohé gradienty elektrochemického potenciálu bunky, ktoré sú nevyhnutnou podmienkou pasívneho transportu iónov, vznikajú v dôsledku ich aktívneho transportu. Gradienty K + a Na + teda vznikajú v dôsledku ich aktívneho prenosu pumpou Na + /K + - (obr. 1.13). V dôsledku aktivity Na + /K + pumpy vo vnútri bunky sú ióny K + prítomné vo vyšších koncentráciách, ale majú tendenciu prechádzať difúziou do extracelulárneho prostredia pozdĺž koncentračného gradientu. Aby sa zachovala rovnosť kladných a záporných nábojov vo vnútri bunky, uvoľňovanie iónov K + do vonkajšieho prostredia musí byť kompenzované vstupom iónov Na + do bunky. Pretože membrána v pokoji je oveľa menej priepustná pre ióny Na + ako pre ióny K +, draslík musí opustiť bunku pozdĺž koncentračného gradientu. V dôsledku toho sa na vonkajšej strane membrány hromadí kladný náboj a vo vnútri záporný náboj. Tým sa zachováva kľudový potenciál membrány.
Sekundárny aktívny transport množstva iónov a molekúl využíva aj energiu nahromadenú v dôsledku spotreby ATP a vynaloženú na vytvorenie koncentračného gradientu. Ako zdroj energie vytvorený primárnym aktívnym transportom sa využíva gradient koncentrácie iónov voči membráne (obr. 1.14). Sekundárny aktívny transport teda zahŕňa kotransport a protiprepravu: tok iónov z vyššej (vyšší energetický stav) do nižšej (nižší energetický stav) koncentrácie poskytuje energiu na presun aktívne transportovanej látky z oblasti s nízkou koncentráciou do oblasti vysoká koncentrácia.
 Ryža. 1.12. Tri triedy iónových púmp závislých od ATP. A- trieda P. B- trieda F1 IN- V 1 trieda
Ryža. 1.12. Tri triedy iónových púmp závislých od ATP. A- trieda P. B- trieda F1 IN- V 1 trieda
Bunkové potenciály určené pasívnym transportom iónov
V reakcii na podprahové, blízkoprahové a prahové impulzy elektrického prúdu dochádza k pasívnemu elektrotonickému potenciálu, lokálnej odozve a akčnému potenciálu (obr. 1.15). Všetky tieto potenciály sú určené pasívnym transportom iónov cez membránu. Ich výskyt si vyžaduje polarizáciu bunkovej membrány, ktorá môže prebiehať extracelulárne (obvykle pozorované na nervových vláknach) a intracelulárne (obvykle pozorované na tele bunky).
Pasívny elektrotonický potenciál vzniká ako odpoveď na podprahový impulz, ktorý nevedie k otvoreniu iónových kanálov a je určený iba kapacitnými a odporovými vlastnosťami bunkovej membrány. Pasívny elektrotonický potenciál je charakterizovaný časovou konštantou, ktorá odráža pasívne vlastnosti membrány, časový priebeh zmien membránového potenciálu, t.j. rýchlosť, ktorou sa mení pri prechode z jednej hodnoty na druhú. Pass-
 Ryža. 1.13. Mechanizmus činnosti Na + /K + čerpadla
Ryža. 1.13. Mechanizmus činnosti Na + /K + čerpadla
 Ryža. 1.14. Mechanizmus fungovania sekundárneho aktívneho transportu. A- Fáza 1. B- 2. fáza. IN- Stupeň 3: 1 - Na+; 2 - molekula látky, ktorá sa musí preniesť proti koncentračnému gradientu; 3 - dopravník. Keď sa Na+ naviaže na nosič, dôjde k alosterickým zmenám vo väzbovom centre nosičového proteínu pre transportovanú molekulu látky, čo spôsobí konformačné zmeny v nosičovom proteíne, čo umožní, aby ióny Na+ a viazaná látka vystúpili na druhej strane membrány.
Ryža. 1.14. Mechanizmus fungovania sekundárneho aktívneho transportu. A- Fáza 1. B- 2. fáza. IN- Stupeň 3: 1 - Na+; 2 - molekula látky, ktorá sa musí preniesť proti koncentračnému gradientu; 3 - dopravník. Keď sa Na+ naviaže na nosič, dôjde k alosterickým zmenám vo väzbovom centre nosičového proteínu pre transportovanú molekulu látky, čo spôsobí konformačné zmeny v nosičovom proteíne, čo umožní, aby ióny Na+ a viazaná látka vystúpili na druhej strane membrány.
Silný elektrotonický potenciál je charakterizovaný rovnakou rýchlosťou rastu a poklesu exponenciály. Medzi amplitúdami elektrického stimulu a pasívnym elektrotonickým potenciálom existuje lineárny vzťah a zvýšenie trvania impulzu tento vzor nemení. Pasívny elektrotonický potenciál sa šíri pozdĺž axónu s útlmom, ktorý je určený konštantnou dĺžkou membrány.
Keď sa sila elektrického impulzu priblíži k prahovej hodnote, a lokálna membránová odpoveďčo sa prejavuje zmenou tvaru pasívneho elektrotonického potenciálu a rozvojom nezávislého vrcholu malej amplitúdy, v tvare krivky v tvare S (pozri obr. 1.15). Prvé známky lokálnej odozvy sa zaznamenávajú pri pôsobení stimulov tvoriacich približne 75 % prahovej hodnoty. So zvyšujúcim sa dráždivým prúdom sa amplitúda lokálnej odozvy zvyšuje nelineárne a môže nielen dosiahnuť kritický potenciál, ale ho aj prekročiť, bez toho, aby sa vyvinul do akčného potenciálu. Nezávislý vývoj lokálnej odozvy je spojený so zvýšením priepustnosti sodíka membrány cez sodíkové kanály, ktoré poskytujú vstupný prúd, ktorý pri prahovom podnete vyvolá depolarizačnú fázu akčného potenciálu. Pri podprahovom stimule však toto zvýšenie permeability nestačí na spustenie procesu regeneračnej membránovej depolarizácie, pretože sa otvára len malá časť sodíkových kanálov. de-
 Ryža. 1.15. Potenciály bunkovej membrány.
Ryža. 1.15. Potenciály bunkovej membrány.
A- Dynamika zmien membránového potenciálu v závislosti od sily impulzu depolarizujúceho elektrického prúdu. B- Diskrétne zvýšenie sily depolarizujúceho impulzu
polarizácia sa zastaví. V dôsledku uvoľnenia iónov K+ z bunky sa potenciál vracia na úroveň pokojového potenciálu. Na rozdiel od akčného potenciálu lokálna odozva nemá jasný prah výskytu a nedodržiava zákon „všetko alebo nič“: so zvyšujúcou sa silou elektrického impulzu sa zvyšuje amplitúda lokálnej odozvy. V tele je lokálna odpoveď elektrofyziologickým vyjadrením lokálnej excitácie a zvyčajne predchádza akčnému potenciálu. Niekedy môže lokálna odpoveď existovať nezávisle vo forme excitačného postsynaptického potenciálu. Príklady nezávislého významu lokálneho potenciálu sú vedenie excitácie z amakrinných buniek sietnice - neurónov centrálneho nervového systému, bez axónov, do synaptických zakončení, ako aj odozva postsynaptickej membrány chemickej synapsie a komunikačný prenos informácií medzi nervovými bunkami generujúci synaptické potenciály.
Pri prahovej hodnote dráždivého elektrického impulzu, akčný potenciál, pozostávajúce z fáz depolarizácie a repolarizácie (obr. 1.16). Akčný potenciál začína ako výsledok posunutia pôsobením štvorcového impulzu elektrického prúdu z pokojového potenciálu (napríklad od -90 mV) na úroveň kritického potenciálu (rôzne pre rôzne typy buniek). Fáza depolarizácie je založená na aktivácii všetkých napäťovo riadených sodíkových kanálov, po ktorých nasleduje
 Ryža. 1.16. Zmeny membránového potenciálu neurónov (A) a vodivosť iónov cez plazmalemu (B) keď sa objaví akčný potenciál. 1 - rýchla depolarizácia; 2 - prestrel; 3 - repolarizácia; 4 - prahový potenciál; 5 - hyperpolarizácia; 6 - pokojový potenciál; 7 - pomalá depolarizácia; 8 - akčný potenciál; 9 - priepustnosť pre ióny sodíka; 10 - priepustnosť pre ióny draslíka.
Ryža. 1.16. Zmeny membránového potenciálu neurónov (A) a vodivosť iónov cez plazmalemu (B) keď sa objaví akčný potenciál. 1 - rýchla depolarizácia; 2 - prestrel; 3 - repolarizácia; 4 - prahový potenciál; 5 - hyperpolarizácia; 6 - pokojový potenciál; 7 - pomalá depolarizácia; 8 - akčný potenciál; 9 - priepustnosť pre ióny sodíka; 10 - priepustnosť pre ióny draslíka.
Krivky iónovej vodivosti sú vzájomne prepojené s krivkou akčného potenciálu
V dôsledku toho sa zvyšuje pasívny transport iónov Na + do bunky a dochádza k posunu membránového potenciálu až o 35 mV (táto vrcholová hladina je pre rôzne typy buniek rôzna). Prebytok akčného potenciálu nad nulovou čiarou sa nazýva prekmit. Po dosiahnutí vrcholu hodnota potenciálu spadne do negatívnej oblasti a dosiahne pokojový potenciál (fáza repolarizácie). Repolarizácia je založená na inaktivácii napäťovo riadených sodíkových kanálov a aktivácii napäťovo riadených draslíkových kanálov. K+ ióny opúšťajú bunku pasívnym transportom a výsledný prúd vedie k posunu membránového potenciálu do negatívnej oblasti. Fáza repolarizácie končí následnou hyperpolarizáciou alebo následnou depolarizáciou – alternatívne iónové mechanizmy na vrátenie membránového potenciálu na úroveň pokojového potenciálu (pozri obr. 1.16). Pri prvom mechanizme dosiahne repolarizácia pokojovú hodnotu a pokračuje ďalej do negatívnejšej oblasti, po ktorej sa vráti na úroveň pokojového potenciálu (stopová hyperpolarizácia); v druhom repolarizácia prebieha pomaly a plynulo prechádza do pokojového potenciálu (stopová depolarizácia). Rozvoj akčného potenciálu je sprevádzaný fázovými zmenami v dráždivosti buniek – od zvýšenej dráždivosti k absolútnej a relatívnej refraktérnosti.
Bioelektrická aktivita neurónov
Prvý typ bioelektrickej bunkovej aktivity je vlastný tichým neurónom, ktoré nie sú schopné nezávisle vytvárať akčné potenciály. Pokojový potenciál týchto buniek sa nemení (obr. 1.17).
Neuróny druhého typu sú schopné nezávisle generovať akčné potenciály. Medzi nimi sa rozlišujú bunky, ktoré generujú pravidelnú a nepravidelnú rytmickú alebo burstovú aktivitu (výbuch pozostáva z niekoľkých akčných potenciálov, po ktorých sa pozoruje krátke obdobie pokoja).
Tretí typ bioelektrickej aktivity zahŕňa neuróny, ktoré sú schopné nezávisle generovať výkyvy pokojového potenciálu sínusového alebo pílovitého tvaru, ktoré nedosahujú kritický potenciál. Iba zriedkavé oscilácie môžu dosiahnuť prah a spôsobiť generovanie jednorazových akčných potenciálov. Tieto neuróny sa nazývajú pacemakerové neuróny (obr. 1.17).
„Správanie“ jednotlivých neurónov a interneuronálne interakcie sú ovplyvnené dlhodobou polarizáciou (depolarizáciou alebo hyperpolarizáciou) postsynaptických bunkových membrán.
Stimulácia neurónov konštantným depolarizujúcim elektrickým prúdom spôsobuje reakcie s rytmickými výbojmi akčných potenciálov. Po ukončení dlhodobej depolarizácie membrány postaktivačná inhibícia v ktorých bunka nie je schopná vytvárať akčné potenciály. Trvanie post-aktivačného inhibičného štádia priamo koreluje s amplitúdou stimulačného prúdu. Potom bunka postupne obnoví svoj obvyklý rytmus generovania potenciálov.
Naopak, konštantný hyperpolarizačný prúd inhibuje rozvoj akčného potenciálu, čo je obzvlášť dôležité vo vzťahu k neurónom so spontánnou aktivitou. Zvýšenie hyperpolarizácie bunkovej membrány vedie k zníženiu frekvencie hrotovej aktivity a zvýšeniu amplitúdy každého akčného potenciálu; ďalšou fázou je úplné zastavenie potenciálnej generácie. Po ukončení predĺženej hyperpolarizácie membrány začína fáza postinhibičná aktivácia, keď bunka začne spontánne generovať akčné potenciály s vyššou frekvenciou ako normálne. Trvanie post-aktivačného štádia priamo koreluje s amplitúdou hyperpolarizačného prúdu, po ktorom bunka postupne obnovuje svoj obvyklý rytmus generovania potenciálu.
 Ryža. 1.17. Typy bioelektrickej aktivity nervových buniek
Ryža. 1.17. Typy bioelektrickej aktivity nervových buniek
1.4. Vedenie vzruchu pozdĺž nervového vlákna
Vzory vedenia vzruchu pozdĺž nervových vlákien sú určené elektrickými aj morfologickými charakteristikami axónov. Nervové kmene pozostávajú z myelinizovaných a nemyelinizovaných vlákien. Membrána nemyelinizovaného nervového vlákna je v priamom kontakte s vonkajším prostredím, t.j. výmena iónov medzi intracelulárnym a extracelulárnym prostredím môže nastať v ktoromkoľvek bode nemyelinizovaného vlákna. Myelinizované nervové vlákno je vo väčšej dĺžke pokryté tukovým (myelínovým) obalom, ktorý pôsobí ako izolant (pozri obr. 1.18).
Myelín z jednej gliovej bunky tvorí oblasť myelinizovaného nervového vlákna, oddelenú od ďalšej oblasti tvorenej ďalšou gliovou bunkou, nemyelinizovanú oblasť – Ranvierov uzol (obr. 1.19). Dĺžka Ranvierovho uzla je len 2 µm a dĺžka úseku myelinizovaných vlákien medzi susednými Ranvierovými uzlami dosahuje 2000 µm. Ranvierove uzliny sú úplne bez myelínu a môžu prísť do kontaktu s extracelulárnou tekutinou, t.j. elektrická aktivita myelinizovaného nervového vlákna je obmedzená membránou Ranvierových uzlín, cez ktorú môžu prenikať ióny. Tieto oblasti membrány obsahujú najvyššiu hustotu napäťovo riadených sodíkových kanálov.
Pasívny elektrotonický potenciál sa šíri pozdĺž nervového vlákna na krátke vzdialenosti (obr. 1.20), pričom jeho zosilňovač
 Ryža. 1.18. Schéma myelinizácie periférneho nervového vlákna. A- Štádiá myelinizácie. a - axón je zachytený procesom Schwannovej bunky; b - proces ovinutia Schwannovej bunky okolo axónu; c - Schwannova bunka stráca väčšinu svojej cytoplazmy a mení sa na lamelárnu membránu okolo axónu. B- Nemyelinizované axóny obklopené procesmi Schwannových buniek
Ryža. 1.18. Schéma myelinizácie periférneho nervového vlákna. A- Štádiá myelinizácie. a - axón je zachytený procesom Schwannovej bunky; b - proces ovinutia Schwannovej bunky okolo axónu; c - Schwannova bunka stráca väčšinu svojej cytoplazmy a mení sa na lamelárnu membránu okolo axónu. B- Nemyelinizované axóny obklopené procesmi Schwannových buniek
 Ryža. 1.19.Štruktúra uzla Ranviera.
Ryža. 1.19.Štruktúra uzla Ranviera.
1 - plazmatická membrána axónu;
2 - myelínové membrány; 3 - cytosol Schwannovej bunky; 4 - Ranvierova záchytná zóna; 5 - plazmatická membrána Schwannovej bunky
tam rýchlosť stúpania a klesania klesá so vzdialenosťou (fenomén rozpadu excitácie). Šírenie excitácie vo forme akčného potenciálu nie je sprevádzané zmenou tvaru alebo amplitúdy potenciálu, pretože pri prahovej depolarizácii sa aktivujú napäťovo riadené iónové kanály, ku ktorým nedochádza pri šírení pasívneho elektrotonického potenciálu. . Proces šírenia akčného potenciálu závisí od pasívnych (kapacita, odpor) a aktívnych (aktivácia napäťovo riadených kanálov) vlastností membrány nervového vlákna.
Vnútorné aj vonkajšie prostredie axónu sú dobré vodiče. Axónová membrána, napriek svojim izolačným vlastnostiam, môže tiež viesť prúd v dôsledku prítomnosti iónových „únikových“ kanálov. Keď je stimulované nemyelinizované vlákno, v mieste stimulácie sa otvoria napäťovo riadené sodíkové kanály, čo spôsobí, že dôjde k vnútornému prúdu a depolarizačnej fáze akčného potenciálu sa vytvorí v tejto časti axónu. Prichádzajúci prúd Na+ indukuje miestne prúdové kruhy medzi depolarizovanými a nedepolarizovanými oblasťami membrány. Vďaka opísanému mechanizmu sa v nemyelinizovanom vlákne akčný potenciál šíri obojsmerne z miesta vzruchu.
V myelinizovaných nervových vláknach sa akčné potenciály vytvárajú iba v Ranvierových uzloch. Elektrický odpor oblastí pokrytých myelínovou pošvou je vysoký a neumožňuje rozvoj miestnych kruhových prúdov, ktoré sú nevyhnutné na vytvorenie akčného potenciálu. Keď sa excitácia šíri pozdĺž myelinizovaného vlákna, nervový impulz preskočí z jedného uzla Ranviera do druhého (saltačné vedenie) (pozri obr. 1.20). V tomto prípade sa akčný potenciál môže šíriť oboma smermi z miesta podráždenia, ako v nemyelinizovanom vlákne. Salatačné vedenie
 Ryža. 1.20. Schéma šírenia elektrického potenciálu pozdĺž nervového vlákna.
Ryža. 1.20. Schéma šírenia elektrického potenciálu pozdĺž nervového vlákna.
A- Šírenie akčného potenciálu pozdĺž nemyelinizovaného axónu: a - axón v pokoji; b - iniciácia akčného potenciálu a výskyt lokálnych prúdov; c - šírenie miestnych prúdov; d - šírenie akčného potenciálu pozdĺž axónu. B- Šírenie akčného potenciálu z tela neurónu na koncové zakončenie. B- Salatačné vedenie vzruchov po myelinizovaných vláknach. Ranvierove uzliny oddeľujú segmenty myelínovej pošvy axónu
Dilatácia impulzu poskytuje 5-50 krát vyššiu rýchlosť excitácie v porovnaní s nemyelinizovaným vláknom. Navyše je to ekonomickejšie, keďže lokálna depolarizácia axónovej membrány len v Ranvierovom uzle vedie k strate 100-krát menšieho počtu iónov, ako keď sa lokálne prúdy tvoria v nemyelinizovanom vlákne. Okrem toho, počas soľného vedenia sú napäťovo riadené draslíkové kanály zapojené minimálne, v dôsledku čoho akčné potenciály myelinizovaných vlákien často nemajú fázu hyperpolarizácie.
Zákony pre vedenie vzruchu pozdĺž nervového vlákna Prvý zákon: pri podráždení nervového vlákna sa vzruch pozdĺž nervu šíri oboma smermi.
Druhý zákon: k šíreniu budenia v oboch smeroch dochádza rovnakou rýchlosťou.
Tretí zákon: vzruch sa šíri pozdĺž nervu bez javu útlmu, alebo bez dekrementu. Štvrtý zákon: vedenie vzruchu po nervovom vlákne je možné len vtedy, ak je anatomicky a fyziologicky neporušené. Akékoľvek poranenie povrchovej membrány nervového vlákna (prerezanie, kompresia v dôsledku zápalu a opuchu okolitých tkanív) narúša vedenie stimulácie. Vodivosť je narušená aj pri zmene fyziologického stavu vlákna: blokáda iónových kanálov, ochladzovanie atď.
Piaty zákon: je izolovaná excitácia šírenia pozdĺž nervových vlákien, t.j. neprechádza z jedného vlákna do druhého, ale vzrušuje len tie bunky, s ktorými sú zakončenia daného nervového vlákna v kontakte. Vzhľadom na skutočnosť, že periférny nerv zvyčajne zahŕňa mnoho rôznych vlákien (motorické, senzorické, autonómne), inervujúce rôzne orgány a tkanivá a vykonávajúce rôzne funkcie, je izolované vedenie pozdĺž každého vlákna obzvlášť dôležité.
Šiesty zákon: nervové vlákno sa neunaví; Akčný potenciál vlákna má veľmi dlhú dobu rovnakú amplitúdu.
Siedmy zákon: rýchlosť excitácie je v rôznych nervových vláknach rôzna a je určená elektrickým odporom intra- a extracelulárneho prostredia, membrány axónu, ako aj priemerom nervového vlákna. S rastúcim priemerom vlákna sa zvyšuje rýchlosť stimulácie.
Klasifikácia nervových vlákien
Na základe rýchlosti excitácie pozdĺž nervových vlákien, trvania fáz akčného potenciálu a štruktúrnych znakov sa rozlišujú tri hlavné typy nervových vlákien: A, B a C.
Všetky vlákna typu A sú myelinizované; delia sa na 4 podskupiny: α, β, γ a δ. αA vlákna majú najväčší priemer (12-22 µm), čo určuje vysokú rýchlosť budenia cez ne (70-170 m/s). U ľudí αA vlákna vedú excitáciu z motorických neurónov predných rohov miechy do kostrových svalov, ako aj z proprioceptívnych svalových receptorov do senzorických centier centrálneho nervového systému.
Iné vlákna typ A(β, γ a δ) majú menší priemer, pomalšiu rýchlosť vedenia a dlhší akčný potenciál. Tieto skupiny vlákien zahŕňajú prevažne senzorické vlákna, ktoré vedú impulzy z rôznych receptorov v centrálnom nervovom systéme; výnimkou sú vlákna γA, ktoré vedú vzruch z γ-neurónov predných rohov miechy k intrafúznym svalovým vláknam.
Vlákna typ B aj myelinizované, patriace najmä k pregangliovým vláknam autonómneho nervového systému. Rýchlosť vedenia pozdĺž nich je 3-18 m/s, trvanie akčného potenciálu je takmer 3-krát vyššie ako pri vláknach typu A. Fáza stopovej depolarizácie nie je pre tieto vlákna charakteristická.
Vlákna typ C nemyelinizované, majú malý priemer (asi 1 µm) a nízku rýchlosť excitácie (do 3 m/s). Väčšina vlákien typu C sú postgangliové vlákna sympatického nervového systému; niektoré vlákna typu C sa podieľajú na vedení excitácie z bolesti, teploty a iných receptorov.
1.5. Kódovanie
Informácie prenášané pozdĺž axónu jedným alebo druhým spôsobom sú zakódované. Súbor neurónov, ktoré poskytujú špecifickú funkciu (napríklad špecifickú senzorickú modalitu), tvorí projekčnú dráhu (prvá kódovacia metóda). Zraková dráha teda zahŕňa neuróny v sietnici, laterálne genikulárne telo talamu a vizuálne oblasti mozgovej kôry. Axóny, ktoré vedú vizuálne signály, sú súčasťou optického nervu, optického traktu a optického žiarenia. Fyziologickým stimulom pre aktiváciu zrakového systému je svetlo vstupujúce do sietnice. Neuróny sietnice premieňajú tieto informácie a prenášajú signál ďalej pozdĺž vizuálnej dráhy. Pri mechanickej alebo elektrickej stimulácii neurónov zrakovej dráhy však vzniká aj zrakový vnem, aj keď spravidla skreslený. Neuróny zrakového systému teda tvoria projekčnú dráhu, pri ktorej aktivácii vzniká zrakový vnem. Motorické dráhy predstavujú aj projekčné štruktúry. Napríklad, keď sú aktivované určité neuróny v mozgovej kôre, v motorických neurónoch svalov rúk sa vytvárajú výboje a tieto svaly sa sťahujú.
Druhá metóda kódovania je určená princípom usporiadanej priestorovej (somatotopickej) organizácie centrálneho nervového systému. Somatotopické mapy zostavujú určité skupiny neurónov v senzorickom a motorickom systéme. Tieto skupiny neurónov po prvé prijímajú informácie z vhodne lokalizovaných oblastí povrchu tela a po druhé posielajú motorické príkazy špecifickým častiam tela. Vo zrakovom systéme sú oblasti sietnice reprezentované v mozgovej kôre skupinami neurónov, ktoré tvoria retinotopické mapy. V sluchovom systéme sa frekvenčné charakteristiky zvukov odrážajú v tonotopických mapách.
Tretí spôsob kódovania informácií je založený na meniacich sa charakteristikách sekvencií (sérií) nervových impulzov,
lyzované v dôsledku synaptického prenosu na ďalšiu skupinu neurónov, pričom kódovacím mechanizmom je dočasná organizácia výboja nervových impulzov. Sú možné rôzne typy takéhoto kódovania. Často je kódom priemerná rýchlosť streľby: v mnohých senzorických systémoch je zvýšenie intenzity stimulu sprevádzané zvýšením rýchlosti snímania senzorických neurónov. Okrem toho môže byť kódom trvanie výboja, rôzne zoskupenia impulzov vo výboji, trvanie vysokofrekvenčných impulzov atď.
1.6. Vedenie excitácie medzi bunkami.
Vzťahy medzi nervovými bunkami sa uskutočňujú interneuronálnymi kontaktmi alebo synapsiami. Informácie vo forme série akčných potenciálov prichádzajú z prvého (presynaptického) neurónu do druhého (postsynaptického) buď vytvorením lokálneho prúdu medzi susednými bunkami (elektrické synapsie), alebo nepriamo pôsobením chemikálií - mediátorov, neurotransmiterov (chemické synapsie) alebo prostredníctvom oboch mechanizmov (zmiešané synapsie). Rýchly prenos signálu sa uskutočňuje elektrickými synapsiami, pomalší - chemickými.
Typické synapsie sú útvary tvorené axónovými zakončeniami jedného neurónu a dendritmi druhého neurónu (axodendritické synapsie). Okrem toho existujú axosomatické, axo-axonálne a dendrodendritické synapsie (obr. 1.21). Niektoré asociačné neuróny majú rôzne synaptické spojenia (obr. 1.22). Synapsia medzi axónom motorického neurónu a vláknom kostrového svalstva sa nazýva motorická koncová platňa alebo neuromuskulárne spojenie.
U elektrická synapsia(obr. 1.23) bunkové membrány susedných neurónov tesne priliehajú k sebe, medzera medzi nimi je asi 2 nm. Oblasti membrán susedných buniek, ktoré tvoria medzerové spojenie, obsahujú špecifické proteínové komplexy pozostávajúce zo 6 podjednotiek (konexónov), usporiadaných v takom poradí, že v strede kontaktu sa vytvorí pór naplnený vodou. Konexóny membrán susedných buniek, ktoré sa zoraďujú proti sebe, tvoria otvorené spojenie - „kanály“, ktorých vzdialenosť je asi 8 nm.
 Ryža. 1.21. Hlavné typy synapsií.
Ryža. 1.21. Hlavné typy synapsií.
A- a - elektrická synapsia; b - ostnatá synapsia obsahujúca vezikuly s hustotou elektrónov; V - "sk passant"-synapse alebo synaptické "púčiky"; d - inhibičná synapsia umiestnená v počiatočnej časti axónu (obsahuje elipsoidné vezikuly); d - dendritická chrbtica; e - ostnatá synapsia; g - inhibičná synapsia; h - axo-axonálna synapsia; a - recipročná synapsia; k - excitačná synapsia. B- Atypické synapsie: 1 - axo-axonálna synapsia. Zakončenie jedného axónu môže regulovať aktivitu druhého; 2 - dendrodendritická synapsia; 3 - somasomatická synapsia
Elektrické synapsie vznikajú najčastejšie v embryonálnom štádiu vývoja, u dospelých sa ich počet znižuje. Avšak aj v dospelom tele zostáva význam elektrických synapsií pre gliové bunky a amakrinné bunky sietnice; elektrické synapsie možno nájsť v mozgovom kmeni, najmä v dolných olivách, v sietnici a vestibulárnych koreňoch.
Depolarizácia presynaptickej membrány vedie k vytvoreniu rozdielu potenciálov s nedepolarizovanou postsynaptickou membránou. Výsledkom je, že cez kanály vytvorené konexónmi začína pohyb kladných iónov pozdĺž gradientu rozdielu potenciálu do postsynaptickej bunky alebo pohyb aniónov v opačnom smere. Po dosiahnutí postsynaptickej membrány
 Ryža. 1.22. Asociačný neurón s viacerými synaptickými spojeniami.
Ryža. 1.22. Asociačný neurón s viacerými synaptickými spojeniami.
1 - axónový pahorok, meniaci sa na axón; 2 - myelínové puzdro; 3 - axodendritická synapsia; 4 - jadro; 5 - dendrit; 6 - axosomatická synapsia
 Ryža. 1.23.Štruktúra elektrickej synapsie.
Ryža. 1.23.Štruktúra elektrickej synapsie.
A- Medzerové spojenie medzi úsekmi membrán susedných buniek. B- Konexóny membrán susedných buniek tvoria interneuronálny „kanál“. 1 - proteínový komplex; 2 - iónový kanál. 3 - kanál; 4 - spojovacia bunka 1; 5 - každých šesť podjednotiek; 6 - pripájacia bunka 2
Celková depolarizácia prahovej hodnoty vytvára akčný potenciál. Je dôležité poznamenať, že v elektrickej synapsii vznikajú iónové prúdy s minimálnym časovým oneskorením 10 -5 s, čo vysvetľuje vysokú synchronizáciu odozvy aj veľmi veľkého počtu buniek spojených medzerovým spojom. Vedenie prúdu cez elektrickú synapsiu je tiež možné v oboch smeroch (na rozdiel od chemickej synapsie).
Funkčný stav elektrických synapsií je regulovaný iónmi Ca 2+ a úrovňou potenciálu bunkovej membrány, čo vytvára podmienky na ovplyvňovanie šírenia vzruchu až po jeho ukončenie. K zvláštnostiam činnosti elektrických synapsií patrí nemožnosť priameho prenosu excitácie na vzdialené bunky, keďže len niekoľko ďalších je priamo spojených s excitovanou bunkou; úroveň excitácie v presynaptických a postsynaptických bunkách je rovnaká; spomaliť šírenie
excitácia je nemožná, a preto sa mozog novorodencov a malých detí, ktorý obsahuje podstatne viac elektrických synapsií ako mozog dospelých, ukazuje ako oveľa vzrušujúcejší pre elektrické procesy: rýchlo sa šíriaca elektrická excitácia nepodlieha inhibičnej korekcii a takmer okamžite sa stáva zovšeobecnené, čo vysvetľuje zvláštnu zraniteľnosť a náchylnosť k rozvoju paroxyzmálnej aktivity.
Je potrebné poznamenať, že pri niektorých formách demyelinizačných polyneuropatií sa axóny, ktoré sú súčasťou jedného nervového kmeňa, začnú navzájom tesne dotýkať a vytvárajú patologické zóny (ephapsy), v ktorých je možné „preskočiť“ akčný potenciál z jeden axón k druhému. V dôsledku toho sa môžu objaviť symptómy, ktoré odrážajú príjem „pseudoinformácií“ v mozgu - pocit bolesti bez podráždenia periférnych receptorov bolesti atď.
Chemická synapsia prenáša aj elektrický signál z presynaptickej bunky do postsynaptickej bunky, ale v nej sa otvárajú alebo uzatvárajú iónové kanály na postsynaptickej membráne chemickými nosičmi (prenášače, neurotransmitery) uvoľnenými z presynaptickej membrány (obr. 1.24). Zmena schopnosti viesť určité ióny cez postsynaptickú membránu je základom fungovania chemických synapsií. Iónové prúdy menia potenciál postsynaptickej membrány, t.j. spôsobiť rozvoj postsynaptického potenciálu. V závislosti od toho, ktorá iónová vodivosť sa pôsobením neurotransmitera mení, môže byť jeho účinok inhibičný (hyperpolarizácia postsynaptickej membrány dodatočným odchádzajúcim prúdom iónov K+ alebo prichádzajúci prúd iónov C1 -) alebo excitačný (depolarizácia postsynaptickej membrány v dôsledku dodatočného prichádzajúceho prúdu Ca2+ iónov alebo Na+).
Na synapsii (obr. 1.25) sa rozlišuje presynaptický proces obsahujúci presynaptické vezikuly (vezikuly) a postsynaptickú časť (dendrit, bunkové telo alebo axón). Na presynaptickom nervovom zakončení sa neurotransmitery hromadia vo vezikulách. Synaptické vezikuly sú fixované hlavne k cytoskeletu cez proteíny synapsín, lokalizované na cytoplazmatickom povrchu každého vezikula, a spektrín, lokalizovaný na F-aktínových vláknach cytoskeletu (obr. 1.26). Menšina vezikúl je spojená s pres-
naptickej membrány prostredníctvom vezikulárneho proteínu synaptobrevínu a presynaptického membránového proteínu syntaxínu.
Jedna vezikula obsahuje 6000-8000 vysielacích molekúl, čo je 1 vysielacie kvantum, t.j. minimálne množstvo uvoľnené do synaptickej štrbiny. Keď séria akčných potenciálov dosiahne nervové zakončenie (presynaptickú membránu), ióny Ca2+ sa vrhnú do bunky. Na vezikulách spojených s presynaptickou membránou sa ióny Ca2+ viažu na proteín synaptotagmy vezikuly
 Ryža. 1.24. Hlavné štádiá prenosu cez chemickú synapsiu: 1 - akčný potenciál dosiahne presynaptické zakončenie; 2 - depolarizácia presynaptickej membrány vedie k otvoreniu napäťovo závislých Ca 2+ kanálov; 3 - Ca 2+ ióny sprostredkovávajú fúziu vezikúl s presynaptickou membránou; 4 - molekuly vysielača sa uvoľňujú do synaptickej štrbiny exocytózou; 5 - molekuly vysielača sa viažu na postsynaptické receptory, čím sa aktivujú iónové kanály; 6 - nastáva zmena vodivosti membrány pre ióny a v závislosti od vlastností mediátora vzniká excitačný (depolarizačný) alebo inhibičný (hyperpolarizačný) potenciál postsynaptickej membrány; 7 - iónový prúd sa šíri pozdĺž postsynaptickej membrány; 8 - molekuly vysielača sa vracajú na presynaptický koniec spätným vychytávaním alebo 9 - difundujú do extracelulárnej tekutiny
Ryža. 1.24. Hlavné štádiá prenosu cez chemickú synapsiu: 1 - akčný potenciál dosiahne presynaptické zakončenie; 2 - depolarizácia presynaptickej membrány vedie k otvoreniu napäťovo závislých Ca 2+ kanálov; 3 - Ca 2+ ióny sprostredkovávajú fúziu vezikúl s presynaptickou membránou; 4 - molekuly vysielača sa uvoľňujú do synaptickej štrbiny exocytózou; 5 - molekuly vysielača sa viažu na postsynaptické receptory, čím sa aktivujú iónové kanály; 6 - nastáva zmena vodivosti membrány pre ióny a v závislosti od vlastností mediátora vzniká excitačný (depolarizačný) alebo inhibičný (hyperpolarizačný) potenciál postsynaptickej membrány; 7 - iónový prúd sa šíri pozdĺž postsynaptickej membrány; 8 - molekuly vysielača sa vracajú na presynaptický koniec spätným vychytávaním alebo 9 - difundujú do extracelulárnej tekutiny
nom, čo spôsobí otvorenie membrány vezikuly (pozri obr. 1.26). Paralelne dochádza k fúzii polypeptidového komplexu synaptofyzínu s neidentifikovanými proteínmi presynaptickej membrány, čo vedie k vytvoreniu póru, cez ktorý dochádza k regulovanej exocytóze, t.j. sekrécia neurotransmiteru do synaptickej štrbiny. Tento proces regulujú špeciálne vezikulové proteíny (rab3A).
Ca 2+ ióny v presynaptickom zakončení aktivujú Ca 2+ -kalmodulín-dependentnú proteínkinázu II, enzým, ktorý fosforyluje synapsín na presynaptickej membráne. Výsledkom je, že vezikuly naplnené vysielačom sa môžu uvoľniť z cytoskeletu a presunúť sa do presynaptickej membrány, aby uskutočnili ďalší cyklus.
Šírka synaptickej štrbiny je asi 20-50 nm. Uvoľňujú sa do nej molekuly neurotransmiterov, ktorých lokálna koncentrácia bezprostredne po uvoľnení je pomerne vysoká a pohybuje sa v milimolárnom rozmedzí. Molekuly neurotransmiterov difundujú do postsynaptickej membrány približne za 0,1 ms.
V postsynaptickej membráne sa rozlišuje subsynaptická zóna - oblasť priameho kontaktu medzi presynaptickou a postsynaptickou membránou, nazývaná tiež aktívna zóna synapsie. Obsahuje proteíny, ktoré tvoria iónové kanály. V pokoji sa tieto kanály otvárajú len zriedka. Keď molekuly neurotransmiterov vstupujú do postsynaptickej membrány, interagujú s proteínmi iónových kanálov (synaptické receptory), menia svoju konformáciu a vedú k výrazne častejšiemu otváraniu iónových kanálov. Tie receptory, ktorých iónové kanály sa otvárajú po priamom kontakte s ligandom (neurotransmiter), sa nazývajú ionotropný. Receptory, v ktorých sú otvorené
 Ryža. 1.25. Ultraštruktúra axodendritickej synapsie. 1 - axón; 2 - dendrit; 3 - mitochondrie; 4 - synaptické vezikuly; 5 - presynaptická membrána; 6 - postsynaptická membrána; 7 - synaptická štrbina
Ryža. 1.25. Ultraštruktúra axodendritickej synapsie. 1 - axón; 2 - dendrit; 3 - mitochondrie; 4 - synaptické vezikuly; 5 - presynaptická membrána; 6 - postsynaptická membrána; 7 - synaptická štrbina
Vznik iónových kanálov je spojený s prepojením ďalších chemických procesov, tzv metabotropný(obr. 1.27).
V mnohých synapsiách sa neurotransmiterové receptory nachádzajú nielen na postsynaptickej, ale aj na presynaptickej membráne. (autoreceptory). Keď neurotransmiter interaguje s autoreceptormi na presynaptickej membráne, jeho uvoľňovanie je zosilnené alebo oslabené (pozitívna alebo negatívna spätná väzba) v závislosti od typu synapsie. Funkčný stav autoreceptorov ovplyvňuje aj koncentrácia Ca 2+ iónov.
Interakciou s postsynaptickým receptorom otvára neurotransmiter nešpecifické iónové kanály v postsynaptickom
 Ryža. 1.26. Ukotvenie vezikúl na presynaptickej membráne. A- Synaptická vezikula sa pripojí k cytoskeletálnemu prvku pomocou molekuly synapsínu. Dokovací komplex je zvýraznený štvoruholníkom: 1 - samkináza 2; 2 - synapsia 1; 3 - fodrín; 4 - nosič mediátora; 5 - synaptofyzín; 6 - dokovací komplex
Ryža. 1.26. Ukotvenie vezikúl na presynaptickej membráne. A- Synaptická vezikula sa pripojí k cytoskeletálnemu prvku pomocou molekuly synapsínu. Dokovací komplex je zvýraznený štvoruholníkom: 1 - samkináza 2; 2 - synapsia 1; 3 - fodrín; 4 - nosič mediátora; 5 - synaptofyzín; 6 - dokovací komplex
B- Zväčšený diagram dokovacieho komplexu: 7 - synaptobrevín; 8 - synaptotagmín; 9 - rab3A; 10 - NSF; 11 - synaptofyzín; 12 - SNAP; 13 - syntaxín; 14 - neurexín; 15 - fyziofylín; 16 - a-SNAP; 17 - Ca2+; 18 - n-sek1. CaM kináza-2 - kalmodulín-dependentná proteínkináza 2; n-sek - sekrečný proteín; NSF - N-etylmaleimid-senzitívny fúzny proteín; gab3ZA - GTPáza z rodiny ras; SNAP - presynaptický membránový proteín
membrána Excitačný postsynaptický potenciál vzniká zvýšením schopnosti iónových kanálov viesť monovalentné katióny v závislosti od ich elektrochemických gradientov. Potenciál postsynaptickej membrány je teda v rozsahu medzi -60 a -80 mV. Rovnovážny potenciál pre ióny Na+ je +55 mV, čo vysvetľuje silnú hnaciu silu iónov Na+ do bunky. Rovnovážny potenciál pre ióny K+ je približne -90 mV, t.j. zostáva mierny prúd iónov K+, smerujúci z intracelulárneho do extracelulárneho prostredia. Prevádzka iónových kanálov vedie k depolarizácii postsynaptickej membrány, ktorá sa nazýva excitačný postsynaptický potenciál. Keďže iónové prúdy závisia od rozdielu medzi rovnovážnym potenciálom a potenciálom membrány, pri znížení pokojového potenciálu membrány prúd iónov Na + slabne a prúd iónov K + sa zvyšuje, čo vedie k zníženiu amplitúda excitačného postsynaptického potenciálu. Na + a K + prúdy podieľajúce sa na výskyte excitačných postsynaptických
 Ryža. 1.27. Schéma štruktúry receptora.
Ryža. 1.27. Schéma štruktúry receptora.
A- Metabotropný. B- Ionotropné: 1 - neuromodulátory alebo lieky; 2 - receptory s rôznymi väzbovými miestami (heteroceptor); 3 - neuromodulácia; 4 - sekundárny posol; 5 - autoreceptor; 6 - spätná väzba; 7 - vloženie membrány vezikuly; 8 - neuromodulátory; 9 - vysielač; 10 - neuromodulácia; 11-prenášač katalyzuje reakcie G-proteínu; 12 - vysielač otvorí iónový kanál
ktoré potenciály sa správajú inak ako pri vytváraní akčného potenciálu, keďže na mechanizme postsynaptickej depolarizácie sa podieľajú iné iónové kanály s odlišnými vlastnosťami. Ak sa pri vytváraní akčného potenciálu aktivujú napäťovo riadené iónové kanály a so zvyšujúcou sa depolarizáciou sa otvárajú aj ďalšie kanály, v dôsledku čoho sa depolarizačný proces zosilňuje, potom je vodivosť vysielača riadeného (ligand- gated) kanálov závisí len od počtu vysielacích molekúl spojených s receptormi, t.j. na počte otvorených iónových kanálov. Amplitúda excitačného postsynaptického potenciálu sa pohybuje od 100 μV do 10 mV, trvanie potenciálu od 4 do 100 ms v závislosti od typu synapsie.
Excitačný postsynaptický potenciál vytvorený lokálne v zóne synapsie sa pasívne šíri po celej postsynaptickej membráne bunky. Pri súčasnej excitácii veľkého počtu synapsií dochádza k fenoménu súčtu postsynaptického potenciálu, ktorý sa prejavuje prudkým zvýšením jeho amplitúdy, v dôsledku čoho môže dôjsť k depolarizácii membrány celej postsynaptickej bunky. Ak veľkosť depolarizácie dosiahne prahovú hodnotu (viac ako 10 mV), začne sa generovať akčný potenciál, ktorý je vedený pozdĺž axónu postsynaptického neurónu. Od začiatku excitačného postsynaptického potenciálu do vzniku akčného potenciálu prejde asi 0,3 ms, t.j. pri masívnom uvoľnení neurotransmiteru sa postsynaptický potenciál môže objaviť do 0,5-0,6 ms od momentu príchodu akčného potenciálu do presynaptickej oblasti (tzv. synaptické oneskorenie).
Iné zlúčeniny môžu mať vysokú afinitu k proteínu postsynaptického receptora. Podľa toho, k akému účinku (vo vzťahu k neurotransmiteru) vedie ich väzba na receptor, sa rozlišujú agonisty (jednosmerné pôsobenie s neurotransmiterom) a antagonisty (ktorých pôsobenie interferuje s účinkami neurotransmitera).
Existujú receptorové proteíny, ktoré nie sú iónovými kanálmi. Keď sa na ne naviažu molekuly neurotransmiterov, dôjde ku kaskáde chemických reakcií, v dôsledku ktorých sa susedné iónové kanály otvárajú pomocou sekundárnych poslov - metabotropné receptory. G proteín hrá dôležitú úlohu v ich fungovaní. Synaptický prenos, ktorý využíva metabotropný príjem, je veľmi pomalý, s dobou prenosu okolo 100 ms. K synapsiám
Tento typ zahŕňa postgangliové receptory, receptory parasympatického nervového systému a autoreceptory. Príkladom je cholinergná synapsia muskarínového typu, v ktorej väzbová zóna neurotransmitera a iónový kanál nie sú lokalizované v samotnom transmembránovom proteíne; metabotropné receptory sú spojené priamo s G proteínom. Keď sa transmiter naviaže na receptor, G proteín, ktorý má tri podjednotky, vytvorí s receptorom komplex. GDP naviazaný na G proteín je nahradený GTP a G proteín je aktivovaný a získava schopnosť otvárať draslíkový iónový kanál, t.j. hyperpolarizujú postsynaptickú membránu (pozri obr. 1.27).
Druhí poslovia môžu otvárať alebo zatvárať iónové kanály. Iónové kanály sa teda môžu otvárať pomocou cAMP/IP 3 alebo fosforylácie proteínkinázy C. Tento proces prebieha aj pomocou proteínu G, ktorý aktivuje fosfolipázu C, čo vedie k tvorbe inozitoltrifosfátu (IP 3) . Okrem toho sa zvyšuje tvorba diacylglycerolu (DAG) a proteínkinázy C (PKC) (obr. 1.28).
Každá nervová bunka má na svojom povrchu mnoho synaptických zakončení, z ktorých niektoré sú excitačné, iné -
 Ryža. 1.28.Úloha inozitoltrifosfátu (IP 3) druhých poslov (A) a diacylglycerol (DAG) (B) vo fungovaní metabotropného receptora. Keď sa mediátor naviaže na receptor (P), nastane zmena v konformácii G proteínu, po ktorej nasleduje aktivácia fosfolipázy C (PLS). Aktivovaný PLS rozkladá fosfatidylinozitoltrifosfát (PIP 2) na DAG a IP 3. DAG zostáva vo vnútornej vrstve bunkovej membrány a IP 3 difunduje do cytosolu ako druhý posol. DAG je uložený vo vnútornej vrstve membrány, kde interaguje s proteínkinázou C (PKC) v prítomnosti fosfatidylserínu (PS)
Ryža. 1.28.Úloha inozitoltrifosfátu (IP 3) druhých poslov (A) a diacylglycerol (DAG) (B) vo fungovaní metabotropného receptora. Keď sa mediátor naviaže na receptor (P), nastane zmena v konformácii G proteínu, po ktorej nasleduje aktivácia fosfolipázy C (PLS). Aktivovaný PLS rozkladá fosfatidylinozitoltrifosfát (PIP 2) na DAG a IP 3. DAG zostáva vo vnútornej vrstve bunkovej membrány a IP 3 difunduje do cytosolu ako druhý posol. DAG je uložený vo vnútornej vrstve membrány, kde interaguje s proteínkinázou C (PKC) v prítomnosti fosfatidylserínu (PS)
rozumný. Ak sú susedné excitačné a inhibičné synapsie aktivované paralelne, výsledné prúdy sa navzájom superponujú, čo vedie k postsynaptickému potenciálu s amplitúdou menšou ako jeho excitačná a inhibičná zložka oddelene. V tomto prípade je hyperpolarizácia membrány významná v dôsledku zvýšenia jej vodivosti pre ióny K + a C1 -.
Excitačný postsynaptický potenciál je teda generovaný v dôsledku zvýšenia permeability pre ióny Na + a prichádzajúceho prúdu iónov Na + a inhibičný postsynaptický potenciál je generovaný v dôsledku odchádzajúceho prúdu iónov K + alebo prichádzajúceho prúdu C1 - ióny. Zníženie vodivosti pre ióny K+ by malo depolarizovať bunkovú membránu. Synapsie, pri ktorých je depolarizácia spôsobená znížením vodivosti pre ióny K +, sú lokalizované v gangliách autonómneho nervového systému
Synaptický prenos musí byť dokončený rýchlo, aby bola synapsia pripravená na nový prenos, inak by reakcia nevznikla pod vplyvom novo prichádzajúcich signálov a bola by pozorovaná depolarizačný blok. Dôležitým regulačným mechanizmom je rýchly pokles citlivosti postsynaptického receptora (desenzibilizácia), ku ktorému dochádza, keď sú ešte zachované molekuly neurotransmiterov. Napriek kontinuálnej väzbe neurotransmiteru na receptor sa konformácia kanálotvorného proteínu mení, iónový kanál sa stáva nepriepustným pre ióny a synaptický prúd sa zastaví. Pri mnohých synapsiách môže byť desenzibilizácia receptora predĺžená (až niekoľko minút), kým nedôjde k rekonfigurácii a reaktivácii kanála.
Ďalšími spôsobmi ukončenia pôsobenia transmitera, ktoré sa vyhýbajú dlhodobej desenzibilizácii receptora, sú rýchle chemické štiepenie transmitera na neaktívne zložky alebo jeho odstránenie zo synaptickej štrbiny vysoko selektívnym spätným vychytávaním presynaptickým zakončením. Povaha inaktivačného mechanizmu závisí od typu synapsie. Acetylcholín je teda veľmi rýchlo hydrolyzovaný acetylcholínesterázou na acetát a cholín. V CNS sú excitačné glutamátergické synapsie husto pokryté astrocytovými procesmi, ktoré aktívne zachytávajú neurotransmiter zo synaptickej štrbiny a metabolizujú ho.
1.7. Neurotransmitery a neuromodulátory
Neurotransmitery prenášajú signály na synapsiách medzi neurónmi alebo medzi neurónmi a výkonnými orgánmi (svaly, žľazové bunky). Neuromodulátory presynapticky ovplyvňujú množstvo uvoľneného neurotransmitera alebo jeho spätné vychytávanie neurónom. Okrem toho neuromodulátory postsynapticky regulujú citlivosť receptorov. Neuromodulátory sú teda schopné regulovať úroveň excitability v synapsiách a meniť účinok neurotransmiterov. Neurotransmitery a neuromodulátory spolu tvoria skupinu neuroaktívnych látok.
Mnohé neuróny sú vystavené viacerým neuroaktívnym látkam, ale pri stimulácii uvoľňujú iba jeden vysielač. Ten istý neurotransmiter, v závislosti od typu postsynaptického receptora, môže vyvolať excitačný alebo inhibičný účinok. Niektoré neurotransmitery (napríklad dopamín) môžu fungovať aj ako neuromodulátory. Neurofunkčný systém zvyčajne zahŕňa niekoľko neuroaktívnych látok a jedna neuroaktívna látka môže ovplyvniť niekoľko neurofunkčných systémov.
Katecholaminergné neuróny
Katecholaminergné neuróny obsahujú vo svojej perikaryi a procesoch neurotransmitery ako dopamín, norepinefrín alebo epinefrín, ktoré sú syntetizované z aminokyseliny tyrozínu. V mozgu dospelých dopamínergné, noradrenergné a adrenergné neuróny zodpovedajú lokalizáciou neurónom obsahujúcim melanín. Noradrenergné a dopamínergné bunky sú označené číslami od A1 do A15 a adrenergné bunky - od C1 do C3, poradové čísla sú priradené vzostupne, podľa ich umiestnenia v mozgovom kmeni od spodnej po hornú časť.
Dopaminergné neuróny Bunky syntetizujúce dopamín (A8-A15) sa nachádzajú v strednom mozgu, diencephalone a telencephalone (obr. 1.29). Najväčšou skupinou dopamínergných buniek je substantia nigra pars compacta (A9). Ich axóny tvoria vzostupnú dráhu prechádzajúcu cez laterálnu časť hypotalamu a vnútornú kapsulu, nigrostriatálne zväzky vlasov
 Ryža. 1.29. Lokalizácia dopaminergných neurónov a ich dráh v mozgu potkana.
Ryža. 1.29. Lokalizácia dopaminergných neurónov a ich dráh v mozgu potkana.
1 - cerebellum; 2 - mozgová kôra; 3 - striatum; 4 - nucleus accumbens; 5 - čelná kôra; 6 - čuchová žiarovka; 7 - čuchový tuberkul; 8 - kaudátne jadro; 9 - jadro amygdaly; 10 - stredná nadmorská výška; 11 - nigrostriatálny zväzok. Hlavná dráha (nigrostriatálny zväzok) začína v substantia nigra (A8, A9) a prechádza dopredu do striata
con dosiahnuť nucleus caudate a putamen. Spolu s dopaminergnými neurónmi substantia reticularis (A8) tvoria nigrostriatálny systém.
Hlavná dráha (nigrostriatálny zväzok) začína v substantia nigra (A8, A9) a prechádza dopredu do striata.
Mezolimbická skupina dopaminergných neurónov (A10) siaha od mezencefalických oblastí až po limbický systém. Skupina A10 tvorí ventrálny vrchol v interpedunkulárnych jadrách v tegmente stredného mozgu. Axóny smerujú do vnútorných jadier sulcus terminalis, septa, čuchových tuberkul, nucleus accumbens (n. accumbens), cingulate gyrus.
Tretí dopaminergný systém (A12), nazývaný tuberoinfundibulárny systém, sa nachádza v diencephalone, nachádza sa v sivom tuberosite a siaha až do infundibula. Tento systém je spojený s neuroendokrinnými funkciami. Ďalšie skupiny diencefalických buniek (A11, A13 a A14) a ich cieľové bunky sa tiež nachádzajú v hypotalame. Malá skupina A15 je rozptýlená v čuchovom bulbe a je jedinou dopaminergnou skupinou neurónov v telencefalu.
Všetky dopamínové receptory pôsobia prostredníctvom systému sekundárnych poslov. Ich postsynaptické pôsobenie môže byť excitačné alebo inhibičné. Dopamín sa rýchlo dostáva späť do presynaptického konca, kde je metabolizovaný monoaminooxidázou (MAO) a katechol-O-metyltransferázou (COMT).
Noradrenergné neuróny Noradrenergné nervové bunky sa nachádzajú len v úzkej anterolaterálnej zóne tegmenta medulla oblongata a pons (obr. 1.30). v-
 Ryža. 1.30. Lokalizácia noradrenergných neurónov a ich dráh v mozgu potkana (parasagitálny rez).
Ryža. 1.30. Lokalizácia noradrenergných neurónov a ich dráh v mozgu potkana (parasagitálny rez).
1 - cerebellum; 2 - dorzálny zväzok; 3 - ventrálny zväzok; 4 - hipokampus; 5 - mozgová kôra; 6 - čuchová žiarovka; 7 - priečka; 8 - mediálny zväzok predného mozgu; 9 - koncová lišta; 10 - hypotalamus.
Hlavná dráha začína v locus coeruleus (A6) a prechádza dopredu v niekoľkých zväzkoch, čím sa rozvetvujú rôzne časti mozgu. Noradrenergné jadrá sa tiež nachádzajú vo ventrálnej časti mozgového kmeňa (A1, A2, A5 a A7). Väčšina ich vlákien ide spolu s vláknami neurónov locus coeruleus, ale niektoré sú premietané dorzálnym smerom
vlákna pochádzajúce z týchto neurónov stúpajú do stredného mozgu alebo klesajú do miechy. Okrem toho majú noradrenergné bunky spojenie s mozočkom. Noradrenergné vlákna sa rozvetvujú viac ako dopamínergné vlákna. Predpokladá sa, že zohrávajú úlohu pri regulácii cerebrálneho prietoku krvi.
Najväčšia skupina noradrenergných buniek (A6) sa nachádza v locus coeruleus (locus ceeleus) a zahŕňa takmer polovicu všetkých noradrenergných buniek (obr. 1.31). Jadro sa nachádza v hornej časti mostíka v spodnej časti IV komory a siaha až po spodné colliculi. Axóny buniek locus coeruleus sa opakovane rozvetvujú, ich adrenergné zakončenia nájdeme v mnohých častiach centrálneho nervového systému. Majú modulačný účinok na procesy dozrievania a učenia, spracovanie informácií v mozgu, reguláciu spánku a endogénnu inhibíciu bolesti.
Zadný noradrenergný zväzok pochádza zo skupiny A6 a spája sa v strednom mozgu s jadrami zadného raphe, colliculi superior a inferior; v diencefalóne - s prednými jadrami talamu, strednými a bočnými genikulárnymi telami; v telencefalu - s amygdalou, hipokampom, neokortexom, cingulárnym gyrusom.
Ďalšie vlákna z buniek skupiny A6 idú do mozočka cez jeho hornú stopku (pozri obr. 1.31). Zostupné vlákna z locus coeruleus spolu s vláknami susednej skupiny buniek A7 smerujú do zadného jadra blúdivého nervu, dolnej olivy a miechy. Anterolaterálna
 Ryža. 1.31. Schéma noradrenergných dráh z nucleus coeruleus (makuly), lokalizovaných v sivej hmote pons.
Ryža. 1.31. Schéma noradrenergných dráh z nucleus coeruleus (makuly), lokalizovaných v sivej hmote pons.
1 - vlákna vodivej cesty; 2 - hipokampus; 3 - talamus; 4 - hypotalamus a jadro amygdaly; 5 - cerebellum; 6 - miecha; 7 - modrá škvrna
Zostupujúci zväzok z locus coeruleus posiela vlákna do predných a zadných rohov miechy.
Neuróny skupín A1 a A2 sa nachádzajú v predĺženej mieche. Spolu so skupinami pontínových buniek (A5 a A7) tvoria predné vzostupné noradrenergné dráhy. V strednom mozgu sa premietajú na sivé periakvaduktálne jadro a retikulárny útvar, v diencefale - na celý hypotalamus, v telencefalu - na čuchový bulbus. Okrem toho z týchto skupín buniek (A1, A2, A5, A7) smerujú do miechy aj bulbospinálne vlákna.
V PNS je norepinefrín (a v menšej miere epinefrín) dôležitým neurotransmiterom sympatických postgangliových zakončení autonómneho nervového systému.
Adrenergné neuróny
Neuróny syntetizujúce adrenalín sa nachádzajú iba v medulla oblongata, v úzkej anterolaterálnej oblasti. Najväčšia skupina buniek C1 leží za zadným olivárnym jadrom, stredná skupina buniek C2 leží vedľa jadra solitárneho traktu a skupina buniek C3 leží priamo pod periakveduktálnou sivou hmotou. Eferentné cesty z C1-C3 idú do zadného jadra blúdivého nervu, jadra solitárneho traktu, locus coeruleus, periakveduktálnej šedej hmoty mosta a stredného mozgu a hypotalamu.
Existujú 4 hlavné typy katecholaminergných receptorov, ktoré sa líšia svojou odpoveďou na agonisty alebo antagonisty a svojimi postsynaptickými účinkami. α1 receptory poháňajú vápnikové kanály prostredníctvom druhého posla inozitol fosfátu-3 a keď sú aktivované, zvyšujú intracelulárne koncentrácie iónov
Ca 2+. Stimulácia β2 receptorov vedie k zníženiu koncentrácie druhého posla cAMP, čo je sprevádzané rôznymi účinkami. Receptory prostredníctvom sekundárneho posla cAMP zvyšujú vodivosť membrány pre ióny K+, čím vytvárajú inhibičný postsynaptický potenciál.
Serotonergné neuróny
Serotonín (5-hydroxytryptamín) sa tvorí z aminokyseliny tryptofán. Väčšina sérotonergných neurónov je lokalizovaná v mediálnych častiach mozgového kmeňa, kde tvoria takzvané raphe nuclei (obr. 1.32). Skupiny B1 a B2 sa nachádzajú v medulla oblongata, B3 - v hraničnej zóne medzi medulla oblongata a pons, B5 - v pons, B7 - v strednom mozgu. Raphe neuróny B6 a B8 sa nachádzajú v tegmentu mostíka a stredného mozgu. Raphe nuclei obsahujú aj nervové bunky obsahujúce ďalšie neurotransmitery ako dopamín, norepinefrín, GABA, enkefalín a substanciu P. Z tohto dôvodu sa jadrá raphe nazývajú aj multitransmiterové centrá.
Projekcie serotonergných neurónov zodpovedajú priebehu noradrenalínových vlákien. Väčšina vlákien smeruje do štruktúr limbického systému, retikulárnej formácie a miechy. Existuje spojenie s locus coeruleus - hlavnou koncentráciou neurónov norepinefrínu.
Veľký predný vzostupný trakt vzniká z buniek skupín B6, B7 a B8. Prechádza vpredu cez tegmentum stredného mozgu a laterálne cez hypotalamus, potom vydáva vetvy smerom k fornixu a cingulárnemu gyrusu. Touto cestou sú skupiny B6, B7 a B8 spojené v strednom mozgu s interpedunkulárnymi jadrami a substantia nigra, v diencefale - s jadrami vodítka, talamu a hypotalamu, v telencefalu - s jadrami septa a jadra čuchová žiarovka.
Existujú početné projekcie zo serotonergných neurónov do hypotalamu, cingulárneho kortexu a čuchového kortexu, ako aj spojenia so striatum a frontálnym kortexom. Kratší zadný vzostupný trakt spája bunky skupín B3, B5 a B7 cez zadný pozdĺžny fascikul s periakvaduktálnou sivou hmotou a zadnou hypotalamickou oblasťou. Okrem toho existujú serotonergné výbežky do mozočku (B6 a B7) a miechy (B1 až B3), ako aj početné vlákna spájajúce sa s retikulárnou formáciou.
Serotonín sa uvoľňuje obvyklým spôsobom. Na postsynaptickej membráne sú receptory, ktoré pomocou sekundárnych poslov otvárajú kanály pre ióny K+ a Ca2+. Existuje 7 tried serotonínových receptorov: 5-HT1 - 5-HT7, ktoré reagujú odlišne na pôsobenie agonistov a antagonistov. Receptory 5-HT 1, 5-HT 2 a 5-HT 4 sa nachádzajú v mozgu, 5-HT 3 receptory sa nachádzajú v PNS. Účinok serotonínu končí mechanizmom spätného vychytávania neurotransmiterov presynaptickým zakončením. Serotonín, ktorý nevstupuje do vezikúl, je deaminovaný MAO. Existuje inhibičný účinok zostupných serotonergných vlákien na prvé sympatické neuróny miechy. Predpokladá sa, že týmto spôsobom raphe neuróny medulla oblongata riadia vedenie bolestivých impulzov v anterolaterálnom systéme. Nedostatok serotonínu je spojený s depresiou.
 Ryža. 1.32. Lokalizácia serotonergných neurónov a ich dráh v mozgu potkana (parasagitálny rez).
Ryža. 1.32. Lokalizácia serotonergných neurónov a ich dráh v mozgu potkana (parasagitálny rez).
1 - čuchová žiarovka; 2 - pás; 3 - corpus callosum; 4 - mozgová kôra; 5 - mediálny pozdĺžny fasciculus; 6 - cerebellum; 7 - mediálny zväzok predného mozgu; 8 - medulárny pás; 9 - koncová lišta; 10 - klenba; 11 - nucleus caudatus; 12 - vonkajšia kapsula. Serotonergné neuróny sú zoskupené do deviatich jadier umiestnených v mozgovom kmeni. Jadrá B6-B9 vyčnievajú dopredu do diencephalon a telencephalon, zatiaľ čo kaudálne jadrá vyčnievajú do medulla oblongata a miechy
Histaminergné neuróny
Histaminergné nervové bunky sa nachádzajú v dolnej časti hypotalamu v blízkosti infundibula. Histamín je metabolizovaný enzýmom histidíndekarboxylázou z aminokyseliny histidín. Dlhé a krátke zväzky vlákien histaminergných nervových buniek v dolnej časti hypotalamu smerujú do mozgového kmeňa ako súčasť zadnej a periventrikulárnej zóny. Histaminergné vlákna dosahujú periakveduktálnu sivú hmotu, zadné raphe nucleus, mediálne vestibulárne jadro, jadro solitárneho traktu, zadné jadro nervus vagus,
tvárový nerv, predné a zadné kochleárne jadrá, laterálny lemniscus a colliculus inferior. Okrem toho sú vlákna nasmerované do diencefalu - zadnej, laterálnej a prednej časti hypotalamu, prsných teliesok, talamu optici, periventrikulárnych jadier, laterálnych genikulárnych teliesok a do telencefalu - Brocovho diagonálneho gyru, n. accumbens, amygdala a mozgová kôra.
Cholinergné neuróny
Alfa (α)- a gama (γ)-motoneuróny okulomotorického, trochleárneho, trigeminálneho, abducenového, tvárového, glosofaryngeálneho, vagusového, prídavného a hypoglossálneho nervu a miechového nervu sú cholinergné (obr. 1.33). Acetylcholín ovplyvňuje kontrakciu kostrových svalov. Pregangliové neuróny autonómneho nervového systému sú cholinergné, stimulujú postgangliové neuróny autonómneho nervového systému. Ďalšie cholinergné nervové bunky boli označené alfanumericky zhora nadol (v opačnom poradí katecholaminergných a serotonergných neurónov). Ch1 cholinergné neuróny tvoria asi 10 % buniek stredných septálnych jadier, neuróny Ch2 tvoria 70 % buniek vertikálnej vetvy diagonálnej štrbiny Broca, neuróny Ch3 tvoria 1 % buniek horizontálnej vetvy diagonálna puklina Broca. Všetky tri skupiny neurónov vyčnievajú smerom nadol k stredovým jadrám vodítka a interpedunkulárnym jadrám. Neuróny Ch1 sú spojené vzostupnými vláknami cez fornix do hipokampu. Bunková skupina Ch3 je synapticky spojená s nervovými bunkami bulbu olfactorius.
V ľudskom mozgu je skupina buniek Ch4 pomerne rozsiahla a zodpovedá nucleus basalis Meynert, v ktorom je 90 % všetkých buniek cholinergných. Tieto jadrá dostávajú aferentné impulzy zo subkortikálnych diencefalicko-telencefalických oblastí a tvoria limbicko-paralimbickú kôru mozgu. Predné bunky bazálneho jadra vyčnievajú do frontálneho a parietálneho neokortexu a zadné bunky vyčnievajú do okcipitálneho a temporálneho neokortexu. Bazálne jadro je teda prenosovým článkom medzi limbicko-paralimbickými oblasťami a neokortexom. Dve malé skupiny cholinergných buniek (Ch5 a Ch6) sa nachádzajú v ponse a sú považované za súčasť vzostupného retikulárneho systému.
Malá skupina buniek periolivárneho jadra, čiastočne pozostávajúca z cholinergných buniek, sa nachádza na okraji lichobežníkového tela v dolných častiach mostíka. Jeho eferentné vlákna smerujú do receptorových buniek sluchového systému. Tento cholinergný systém ovplyvňuje prenos zvukových signálov.
Aminacidergické neuróny
Neurotransmiterové vlastnosti boli preukázané pre štyri aminokyseliny: excitačné pre glutámovú (glutamát), aspartátové (aspartátové) kyseliny, inhibičné pre kyselinu g-aminomaslovú a glycín. Predpokladá sa, že cysteín má neurotransmiterové (excitačné) vlastnosti; taurín, serín a p-alanín (inhibičné).
 Ryža. 1.33. Lokalizácia cholinergných neurónov a ich dráh v mozgu potkana (parasagitálny rez). 1 - jadro amygdaly; 2 - predné čuchové jadro; 3 - oblúkovité jadro; 4 - bazálne jadro Meynert; 5 - mozgová kôra; 6 - škrupina jadra caudatus; 7 - Brocov diagonálny nosník; 8 - ohnutý nosník (Meynertov nosník); 9 - hipokampus; 10 - interpedunkulárne jadro; 11 - laterálne dorzálne tegmentálne jadro; 12 - mediálne jadro vodítka; 13 - čuchová žiarovka; 14 - čuchový tuberkul; 15 - retikulárna formácia; 16 - medulárny pás; 17 - talamus; 18 - retikulárna formácia pneumatiky
Ryža. 1.33. Lokalizácia cholinergných neurónov a ich dráh v mozgu potkana (parasagitálny rez). 1 - jadro amygdaly; 2 - predné čuchové jadro; 3 - oblúkovité jadro; 4 - bazálne jadro Meynert; 5 - mozgová kôra; 6 - škrupina jadra caudatus; 7 - Brocov diagonálny nosník; 8 - ohnutý nosník (Meynertov nosník); 9 - hipokampus; 10 - interpedunkulárne jadro; 11 - laterálne dorzálne tegmentálne jadro; 12 - mediálne jadro vodítka; 13 - čuchová žiarovka; 14 - čuchový tuberkul; 15 - retikulárna formácia; 16 - medulárny pás; 17 - talamus; 18 - retikulárna formácia pneumatiky
Glutamátergné a aspartatergné neurónyŠtruktúrne podobné aminokyseliny glutamát a aspartát (obrázok 1.34) sú elektrofyziologicky klasifikované ako excitačné neurotransmitery. Nervové bunky obsahujúce glutamát a/alebo aspartát ako neurotransmitery sú prítomné v sluchovom systéme (neuróny prvého rádu), v čuchovom systéme (zjednocuje čuchový bulbus s mozgovou kôrou), v limbickom systéme, v neokortexe (pyramídové bunky). Glutamát sa nachádza aj v neurónoch dráh pochádzajúcich z pyramídových buniek: kortikostriatálneho, kortikotalamického, kortikotektálneho, kortikomontínového a kortikospinálneho traktu.
Dôležitú úlohu vo fungovaní glutamátového systému zohrávajú astrocyty, ktoré nie sú pasívnymi prvkami nervového systému, ale podieľajú sa na poskytovaní energetických substrátov neurónov v reakcii na zvýšenie synaptickej aktivity. Astrocytárne procesy
 Ryža. 1.34. Syntéza kyseliny glutámovej a asparágovej.
Ryža. 1.34. Syntéza kyseliny glutámovej a asparágovej.
Glykolýza premieňa glukózu na pyruvát, ktorý v prítomnosti acetyl-CoA vstupuje do Krebsovho cyklu. Ďalej sa transamináciou oxaloacetát a α-ketoglutarát premenia na aspartát a glutamát (reakcie sú znázornené v spodnej časti obrázku)
ki sú umiestnené okolo synaptických kontaktov, čo im umožňuje vnímať zvýšenie synaptickej koncentrácie neurotransmiterov (obr. 1.35). Prenos glutamátu zo synaptickej štrbiny je sprostredkovaný špecifickými transportnými systémami, z ktorých dva sú špecifické pre gliu ( GLT-1 A GLAST- dopravcovia). Tretí dopravný systém (EAAS-1), nachádza výlučne v neurónoch, nezúčastňuje sa prenosu glutamátu uvoľneného zo synapsií. K prechodu glutamátu na astrocyty dochádza pozdĺž elektrochemického gradientu iónov Na +.
Za normálnych podmienok sú extracelulárne koncentrácie glutamátu a aspartátu udržiavané relatívne konštantné. Ich nárast zahŕňa kompenzačné mechanizmy: zachytávanie prebytkov z medzibunkového priestoru neurónmi a astrocytmi, presynaptická inhibícia uvoľňovania neurotransmiterov, metabolické využitie a
 Ryža. 1.35.Štruktúra glutamátergickej synapsie.
Ryža. 1.35.Štruktúra glutamátergickej synapsie.
Glutamát sa uvoľňuje zo synaptických vezikúl do synaptickej štrbiny. Obrázok ukazuje dva mechanizmy spätného vychytávania: 1 - späť na presynaptický terminál; 2 - do susednej gliovej bunky; 3 - gliová bunka; 4 - axón; 5 - glutamín; 6 - glutamínsyntetáza; 7 - ATP+NH4+; 8 - glutamináza; 9 - glutamát + NH4+; 10 - glutamát; 11 - postsynaptická membrána. V gliových bunkách glutamínsyntáza premieňa glutamát na glutamín, ktorý potom prechádza do presynaptického zakončenia. Na presynaptickom konci sa glutamín pomocou enzýmu glutaminázy premieňa späť na glutamát. Voľný glutamát sa tiež syntetizuje v reakciách Krebsovho cyklu v mitochondriách. Voľný glutamát sa zhromažďuje v synaptických vezikulách predtým, ako sa objaví ďalší akčný potenciál. Pravá strana obrázku ukazuje konverzné reakcie glutamátu a glutamínu sprostredkované glutamínsyntetázou a glutaminázou
Ak je narušená ich eliminácia zo synaptickej štrbiny, absolútna koncentrácia a doba zotrvania glutamátu a aspartátu v synaptickej štrbine prekračuje prípustné limity a proces depolarizácie neurónových membrán sa stáva nezvratným.
V centrálnom nervovom systéme cicavcov existujú rodiny ionotropných a metabotropných glutamátových receptorov. Ionotropné receptory regulujú permeabilitu iónových kanálov a sú klasifikované v závislosti od ich citlivosti na pôsobenie N-metyl-D-aspartátu (NMDA), kyselina a-amino-3-hydroxy-5-metyl-4-izoxazol-propiónová (AMRA), kyselina kaínová (K) a kyselina L-2-amino-4-fosfonomaslová (L-AP4)- najselektívnejšie ligandy tohto typu receptorov. Názvy týchto zlúčenín boli priradené zodpovedajúcim typom receptorov: NMDA, AMRA, K A L-AP4.
Najviac študované receptory sú typu NMDA (obr. 1.36). Postsynaptický receptor NMDA je komplexná supramolekulárna formácia, ktorá zahŕňa niekoľko miest (miest) regulácie: miesto pre špecifickú väzbu mediátora (kyselina L-glutámová), miesto pre špecifickú väzbu koagonistu (glycín) a alosterické modulačné miesta umiestnené na membráne (polyamín) a v iónovom kanáli, spojené s receptorom (väzbové miesta pre dvojmocné katióny a miesto „fencyklidínu“ – väzbové miesto pre nekompetitívnych antagonistov).
Ionotropné receptory hrajú kľúčovú úlohu pri realizácii excitačnej neurotransmisie v centrálnom nervovom systéme, pri realizácii neuroplasticity, pri tvorbe nových synapsií (synaptogenéze) a pri zvyšovaní účinnosti fungovania existujúcich synapsií. Mechanizmy pamäti, učenia (osvojovania si nových zručností) a kompenzácie funkcií narušených organickým poškodením mozgu sú vo veľkej miere spojené s týmito procesmi.
Vzrušujúce aminoacidergické neurotransmitery (glutamát a aspartát) sa za určitých podmienok vyznačujú cytotoxicitou. Pri interakcii s nadmerne excitovanými postsynaptickými receptormi vznikajú dendrosomatické lézie bez zmien vo vodivej časti nervovej bunky. Stavy, ktoré spôsobujú takúto nadmernú excitáciu, sú charakterizované zvýšeným uvoľňovaním a/alebo zníženým spätným vychytávaním transportéra. Nadmerná excitácia receptorov glutamátom NMDA vedie k otvoreniu minulosti-
nist-dependentné vápnikové kanály a silný prílev Ca2+ do neurónov s náhlym zvýšením jeho koncentrácie na prahovú hodnotu. Spôsobené nadmerným pôsobením aminoacidergických neurotransmiterov "excitotoxická smrť neurónov" je univerzálny mechanizmus poškodenia nervového tkaniva. Je základom nekrotickej smrti neurónov pri rôznych ochoreniach mozgu, akútnych (ischemická mŕtvica) aj chronických (neu-
 Ryža. 1.36. Glutamátový NMDA receptor
Ryža. 1.36. Glutamátový NMDA receptor
rodegenerácia). Extracelulárne hladiny aspartátu a glutamátu, a teda závažnosť excitotoxicity, sú ovplyvnené teplotou a pH mozgu a extracelulárnymi koncentráciami monovalentných iónov C1 - a Na+. Metabolická acidóza inhibuje transportné systémy glutamátu zo synaptickej štrbiny.
Existujú dôkazy o neurotoxických vlastnostiach glutamátu spojených s aktiváciou AMPA a K receptorov, čo vedie k zmene permeability postsynaptickej membrány pre monovalentné katióny K+ a Na+, zvýšeniu vstupujúceho prúdu iónov Na+ a krátkodobej depolarizácii postsynaptickej membrány, čo zase spôsobuje zvýšenie prítoku Ca 2+ do bunky prostredníctvom agonisticky závislých (receptorov NMDA) a napäťovo riadené kanály. Prúdenie iónov Na+ je sprevádzané vstupom vody do buniek, čo spôsobuje opuch apikálnych dendritov a lýzu neurónov (osmolytické poškodenie neurónov).
Metabotropné glutamátové receptory spojené s G proteínom hrajú dôležitú úlohu v regulácii vnútrobunkového vápnikového prúdu spôsobeného aktiváciou NMDA receptorov a vykonávajú modulačné funkcie, čím spôsobujú zmeny v bunkovej aktivite. Tieto receptory neovplyvňujú fungovanie iónových kanálov, ale stimulujú tvorbu intracelulárnych mediátorov diacylglycerolu a nozitoltrifosfátu, ktoré sa podieľajú na ďalších procesoch ischemickej kaskády.
GABAergické neuróny
Niektoré neuróny obsahujú ako neurotransmiter kyselinu g-aminomaslovú (GABA), ktorá vzniká z kyseliny glutámovej pôsobením glutamátdekarboxylázy (obr. 1.37). V mozgovej kôre sa GABAergické neuróny nachádzajú v čuchových a limbických oblastiach (neuróny hippocampu). GABA obsahuje aj neuróny eferentných extrapyramídových striatonigrálnych, pallidonigrálnych a subtalamopallidálnych dráh, Purkyňove bunky mozočka, neuróny cerebelárnej kôry (Golgiho, hviezdicový a košík), interkalárne inhibičné neuróny miechy.
GABA je najdôležitejší inhibičný neurotransmiter centrálneho nervového systému. Hlavnou fyziologickou úlohou GABA je vytvárať stabilnú rovnováhu medzi excitačným a inhibičným systémom, modulovať a regulovať aktivitu hlavného excitačného neurotransmiteru glutamátu. GABA obmedzuje šírenie excitačného stimulu tak presynapticky - cez GABA-B receptory, funkčne
 Ryža. 1.37. Reakcia premeny glutamátu na GABA.
Ryža. 1.37. Reakcia premeny glutamátu na GABA.
Aktivita dekarboxylázy kyseliny glutámovej (DHA) vyžaduje koenzým pyridoxalfosfát.
 Ryža. 1.38. GABA receptor.
Ryža. 1.38. GABA receptor.
1 - väzbové miesto pre benzodiazepín;
2 - GABA-väzbové miesto; 3 - iónový kanál pre CL - ; 4 - miesto viažuce barbituráty
ale spojené s napäťovo riadenými vápnikovými kanálmi presynaptických membrán a postsynapticky - prostredníctvom GABAA receptorov (GABA-barbiturátový benzodiazepínový receptorový komplex), funkčne spojené s napäťovo riadenými chloridovými kanálmi. Aktivácia postsynaptických GABA-A receptorov vedie k hyperpolarizácii bunkových membrán a inhibícii excitačného impulzu spôsobeného depolarizáciou.
Hustota GABA-A receptorov je maximálna v temporálnom a frontálnom kortexe, hipokampe, amygdale a hypotalamických jadrách, substantia nigra, periakveduktálnej šedej hmote a mozočkových jadrách. V o niečo menšom rozsahu sú receptory zastúpené v jadre caudate, putamene, talame, okcipitálnom kortexe a epifýze. Všetky tri podjednotky GABA-A receptora (α, β a γ) viažu GABA, hoci väzbová afinita je najvyššia pre β podjednotku (obr. 1.38). Barbituráty interagujú s a- a P-podjednotkami; benzodiazepíny – len so 7-podjednotkou. Väzbová afinita každého ligandu sa zvyšuje, ak iné ligandy interagujú s receptorom paralelne.
Glycinergné neuróny Glycín je inhibičný neurotransmiter takmer vo všetkých častiach centrálneho nervového systému. Najväčšia hustota glycínových receptorov bola zistená v štruktúrach mozgového kmeňa, mozgovej kôry, striata, jadier hypotalamu, vodičov z frontálneho kortexu do hypotalamu, mozgu
srdce, miecha. Glycín vykazuje inhibičné vlastnosti prostredníctvom interakcie nielen s vlastnými glycínovými receptormi citlivými na strychnín, ale aj s GABA receptormi.
V malých koncentráciách je glycín nevyhnutný pre normálne fungovanie glutamátových receptorov NMDA. Glycín je receptor ko-agonista NMDA pretože ich aktivácia je možná len vtedy, ak sa glycín viaže na špecifické (strychnín necitlivé) glycínové miesta. Zosilňujúci účinok glycínu na receptory NMDA sa objavuje pri koncentráciách pod 0,1 umol a pri koncentráciách od 10 do 100 umol je glycínové miesto úplne nasýtené. Vysoké koncentrácie glycínu (10-100 mmol) neaktivujú NMDA-indukovanú depolarizáciu in vivo a preto nezvyšujú excitotoxicitu.
Peptidergické neuróny
Neurotransmiterová a/alebo neuromodulačná funkcia mnohých peptidov sa stále študuje. Peptidergické neuróny zahŕňajú:
Hypotalamoneurohypofýzové nervové bunky s peptidmi o-
Cytocín a vazopresín ako neurotransmitery; hypofystrofické bunky s peptidmi somatostatín, korti-
koliberín, tyroliberín, luliberín;
Neuróny s peptidmi autonómneho nervového systému gastrointestinálneho traktu, ako je látka P, vazoaktívny črevný polypeptid (VIN) a cholecystokinín;
Neuróny, ktorých peptidy sú tvorené proopiomelanokortínom (kortikotropín a β-endorfín),
Enkefalínergné nervové bunky.
Substance-R - neuróny obsahujúce Substance P je peptid z 11 aminokyselín, ktorý má pomalý nástup a dlhotrvajúci stimulačný účinok. Látka P obsahuje:
Asi 1/5 buniek spinálnych ganglií a trigeminálneho (gasserovského) ganglia, ktorých axóny majú tenkú myelínovú pošvu alebo nie sú myelinizované;
Bunky čuchových cibúľ;
Neuróny periakveduktálnej šedej hmoty;
Neuróny dráhy prebiehajúce od stredného mozgu k interpedunkulárnym jadrám;
Neuróny eferentných nigrostriatálnych dráh;
Malé nervové bunky nachádzajúce sa v mozgovej kôre, hlavne vo vrstvách V a VI.
Neuróny obsahujúce VIP Vazoaktívny črevný polypeptid (VIP) pozostáva z 28 aminokyselín. V nervovom systéme je VIP excitačný neurotransmiter a/alebo neuromodulátor. Najvyššia koncentrácia VIP sa nachádza v neokortexe, hlavne v bipolárnych bunkách. V mozgovom kmeni sa nervové bunky obsahujúce VIP nachádzajú v jadre osamelého traktu a sú spojené s limbickým systémom. Suprachiazmatické jadro obsahuje neuróny obsahujúce VIP spojené s jadrami hypotalamu. V gastrointestinálnom trakte má vazodilatačný účinok a stimuluje prechod glykogénu na glukózu.
Neuróny obsahujúce β-endorfínβ-endorfín je peptid s 31 aminokyselinami, ktorý funguje ako inhibičný neuromodulátor v mozgu. Endorfínergné bunky sa nachádzajú v mediobazálnom hypotalame a v dolných častiach jadra solitárneho traktu. Vzostupné endorfínergné dráhy z hypotalamu smerujú do preoptického poľa, septálnych jadier a amygdaly a zostupné dráhy smerujú do periakveduktálnej šedej hmoty, coeruleus nucleus a retikulárnej formácie. Endorfínergné neuróny sa podieľajú na centrálnej regulácii analgézie, stimulujú uvoľňovanie rastového hormónu, prolaktínu a vazopresínu.
Enkefalinergné neuróny
Enkefalín je peptid s 5 aminokyselinami, ktorý funguje ako endogénny ligand opiátových receptorov. Enkefalínergné neuróny sa nachádzajú v povrchovej vrstve zadného rohu miechy a jadra miechového traktu trojklanného nervu, perioválneho jadra (sluchového systému), olfaktorických bulbov, v jadrách raphe a v sivom periakvaduktálnom látka. Neuróny obsahujúce enkefalín sa nachádzajú aj v neokortexe a alokortexe.
Enkefalínergné neuróny presynapticky inhibujú uvoľňovanie substancie P zo synaptických zakončení aferentov, ktoré vedú bolestivé impulzy (obr. 1.39). Analgéziu možno dosiahnuť elektrickou stimuláciou alebo mikroinjekciou opiátov do oblasti. Enkefalínergné neuróny ovplyvňujú hypotalamo-hypofyzárnu reguláciu syntézy a uvoľňovania oxytocínu, vazopresínu, niektorých liberínov a statínov.
Oxid dusnatý
Oxid dusnatý (NO) je multifunkčný fyziologický regulátor s vlastnosťami neurotransmiteru, ktorý sa na rozdiel od tradičných neurotransmiterov neukladá v synaptických vezikulách nervových zakončení a do synaptickej štrbiny sa uvoľňuje voľnou difúziou, nie mechanizmom exocytózy. . Molekula NO je syntetizovaná v reakcii na fyziologické potreby enzýmom WA syntáza (WAS) z aminokyseliny L-arginínu. Schopnosť NO vyvolať biologický účinok je daná najmä malou veľkosťou jeho molekuly, jeho vysokou reaktivitou a schopnosťou difundovať do tkanív, vrátane nervového tkaniva. To bol základ pre označenie NO za retrográdneho posla.
Existujú tri formy WAV. Dva z nich sú konštitutívne: neurónový (ncNOS) a endotelový (ecWAS), tretí je indukovateľný (WAV), ktorý sa nachádza v gliových bunkách.
Závislosť neurónovej izoformy WAV od vápnika a kalmodulínu spôsobuje zvýšenú syntézu NO so zvyšujúcimi sa hladinami intracelulárneho vápnika. V tomto ohľade akékoľvek procesy vedúce k akumulácii vápnika v bunke (nedostatok energie, zmeny aktívneho transportu iónov,
 Ryža. 1.39. Mechanizmus enkefalínergnej regulácie citlivosti na bolesť na úrovni želatínovej substancie.
Ryža. 1.39. Mechanizmus enkefalínergnej regulácie citlivosti na bolesť na úrovni želatínovej substancie.
1 - interneurón; 2 - enkefalín; 3 - enkefalínové receptory; 4 - neurón zadného rohu miechy; 5 - receptory látky P; 6 - látka P; 7 - senzorický neurón spinálneho ganglia. V synapsii medzi periférnym senzorickým neurónom a neurónom spinotalamického ganglia je hlavným prenášačom látka P. Enkefalínergný interneurón reaguje na citlivosť na bolesť tým, že má presynaptický inhibičný účinok na uvoľňovanie látky P
glutamátová excitotoxicita, oxidačný stres, zápal) sú sprevádzané zvýšením hladín NO.
Ukázalo sa, že NO má modulačný účinok na synaptickú transmisiu a funkčný stav NMDA glutamátových receptorov. Aktiváciou rozpustnej guanylátcyklázy obsahujúcej hem sa NO podieľa na regulácii intracelulárnej koncentrácie iónov Ca 2+ a pH vo vnútri nervových buniek.
1.8. Axonálny transport
Axonálny transport hrá dôležitú úlohu v interneuronálnych spojeniach. Membránové a cytoplazmatické zložky, ktoré sa tvoria v biosyntetickom aparáte soma a proximálnej časti dendritov, musia byť distribuované pozdĺž axónu (dôležitý je najmä ich vstup do presynaptických štruktúr synapsií), aby sa kompenzovala strata prvkov, ktoré boli uvoľnené alebo inaktivované.
Mnohé axóny sú však príliš dlhé na to, aby sa materiály mohli efektívne presúvať zo soma do synaptických terminálov jednoduchou difúziou. Túto úlohu vykonáva špeciálny mechanizmus - axonálny transport. Existuje niekoľko typov. Membránou obklopené organely a mitochondrie sa transportujú relatívne vysokou rýchlosťou prostredníctvom rýchleho axonálneho transportu. Látky rozpustené v cytoplazme (napríklad proteíny) sa pohybujú pomocou pomalého axonálneho transportu. U cicavcov má rýchly axonálny transport rýchlosť 400 mm/deň a pomalý axonálny transport asi 1 mm/deň. Synaptické vezikuly sa môžu dostať rýchlym axonálnym transportom zo sómy motorického neurónu ľudskej miechy do svalov chodidla po 2,5 dňoch. Porovnajme: dodanie mnohých rozpustných bielkovín na rovnakú vzdialenosť trvá približne 3 roky.
Axonálny transport vyžaduje metabolickú energiu a prítomnosť intracelulárneho vápnika. Prvky cytoskeletu (presnejšie mikrotubuly) vytvárajú systém vodiacich vlákien, po ktorých sa pohybujú organely obklopené membránami. Tieto organely sa pripájajú k mikrotubulom spôsobom podobným tomu, ktorý sa vyskytuje medzi hrubými a tenkými vláknami vlákien kostrového svalstva; pohyb organel pozdĺž mikrotubulov spúšťajú ióny Ca 2+.
Axonálny transport prebieha v dvoch smeroch. Transport zo somy do axonálnych zakončení, nazývaný anterográdny axonálny transport, dopĺňa zásobu synaptických vezikúl a enzýmov zodpovedných za syntézu neurotransmiterov v presynaptických zakončeniach. Transport v opačnom smere, retrográdny axonálny transport, vracia prázdne synaptické vezikuly do soma, kde sú tieto membránové štruktúry degradované lyzozómami. Látky pochádzajúce zo synapsií sú nevyhnutné na udržanie normálneho metabolizmu tiel nervových buniek a navyše nesú informácie o stave ich terminálneho aparátu. Prerušenie retrográdneho axonálneho transportu vedie k zmenám v normálnom fungovaní nervových buniek a v závažných prípadoch k retrográdnej neuronálnej degenerácii.
Axonálny transportný systém je hlavným mechanizmom, ktorý určuje obnovu a zásobovanie vysielačov a modulátorov v presynaptických termináloch a tiež je základom tvorby nových procesov, axónov a dendritov. Podľa predstáv o plasticite mozgu ako celku, dokonca aj v mozgu dospelých, neustále prebiehajú dva vzájomne prepojené procesy: tvorba nových procesov a synapsií, ako aj deštrukcia a zánik niektorých už existujúcich interneuronálnych kontaktov. Mechanizmy axonálneho transportu, súvisiace procesy synaptogenézy a rast najjemnejších axonálnych vetiev sú základom učenia, adaptácie a kompenzácie poškodených funkcií. Porucha axonálneho transportu vedie k deštrukcii synaptických zakončení a zmenám vo fungovaní niektorých mozgových systémov.
Liečivé a biologicky aktívne látky môžu ovplyvňovať metabolizmus neurónov, čo podmieňuje ich axonálny transport, stimuluje ho a tým zvyšuje možnosť kompenzačných a regeneračných procesov. Posilnenie axonálneho transportu, rast najjemnejších axonálnych vetiev a synaptogenéza zohrávajú pozitívnu úlohu pri normálnej funkcii mozgu. V patológii sú tieto javy základom reparačných, kompenzačných a obnovovacích procesov.
Niektoré vírusy a toxíny sa šíria cez periférne nervy axonálnym transportom. Áno, vírus ovčích kiahní (vírus varicella zoster) preniká do buniek miechových ganglií. Vírus tam zostáva v neaktívnej forme, niekedy aj mnoho rokov, kým sa nezmení imunitný stav osoby. Potom môže byť vírus transportovaný pozdĺž senzorických axónov na kožu a v dermatómoch,
miechových nervov, vyskytujú sa bolestivé vyrážky herpes zoster (herpes zoster). Tetanový toxín je tiež transportovaný axonálnym transportom. Baktérie Clostridium tetani z kontaminovanej rany vstupujú do motorických neurónov retrográdnym transportom. Ak sa toxín uvoľní do extracelulárneho priestoru predných rohov miechy, blokuje aktivitu synaptických receptorov pre inhibičné neurotransmiterové aminokyseliny a spôsobí tetanické záchvaty.
1.9. Reakcie nervového tkaniva na poškodenie
Poškodenie nervového tkaniva je sprevádzané reakciami neurónov a neuroglií. Ak je poškodenie vážne, bunky odumierajú. Pretože neuróny sú postmitotické bunky, nie sú doplňované.
Mechanizmy smrti neurónov a gliových buniek
V ťažko poškodených tkanivách prevládajú procesy nekrózy postihujúce celé bunkové polia s pasívnou degeneráciou buniek, opuchom a fragmentáciou organel, deštrukciou membrán, lýzou buniek, uvoľnením vnútrobunkového obsahu do okolitého tkaniva a rozvojom zápalovej odpovede. Nekróza je vždy spôsobená hrubou patológiou, jej mechanizmy nevyžadujú výdaj energie a možno jej zabrániť iba odstránením príčiny poškodenia.
Apoptóza- druh programovanej bunkovej smrti. Apoptotické bunky, na rozdiel od nekrotických, sú umiestnené jednotlivo alebo v malých skupinách, rozptýlené po celom tkanive. Sú menšie, majú nezmenené membrány, zvrásnenú cytoplazmu so zachovaním organel a výskyt viacerých výbežkov spojených s cytoplazmatickou membránou. Nie je pozorovaná žiadna zápalová reakcia tkaniva, čo v súčasnosti slúži ako jeden z dôležitých rozlišujúcich morfologických znakov apoptózy od nekrózy. Scvrknuté bunky aj apoptotické telá obsahujú intaktné bunkové organely a masy kondenzovaného chromatínu. Výsledkom postupnej deštrukcie DNA v apoptotických bunkách je nemožnosť ich replikácie (reprodukcie) a účasti na medzibunkových interakciách, keďže tieto procesy vyžadujú syntézu nových proteínov. Odumierajúce bunky sú účinne odstránené z tkaniva fagocytózou. Hlavné rozdiely medzi procesmi nekrózy a apoptózy sú zhrnuté v tabuľke. 1.1.
Tabuľka 1.1. Známky rozdielov medzi procesmi nekrózy a apoptózy
 Apoptóza je neoddeliteľnou súčasťou procesov vývoja a homeostázy zrelého tkaniva. Normálne telo používa tento geneticky naprogramovaný mechanizmus v embryogenéze na zničenie „nadbytočného“ bunkového materiálu v ranom štádiu vývoja tkaniva, najmä v neurónoch, ktoré nemajú nadviazané kontakty s cieľovými bunkami a sú tak zbavené trofickej podpory týchto buniek. V dospelosti intenzita apoptózy v centrálnom nervovom systéme cicavcov výrazne klesá, hoci v iných tkanivách zostáva vysoká. Eliminácia buniek infikovaných vírusom a rozvoj imunitnej odpovede sú tiež sprevádzané apoptotickou reakciou. Spolu s apoptózou existujú aj iné varianty programovanej bunkovej smrti.
Apoptóza je neoddeliteľnou súčasťou procesov vývoja a homeostázy zrelého tkaniva. Normálne telo používa tento geneticky naprogramovaný mechanizmus v embryogenéze na zničenie „nadbytočného“ bunkového materiálu v ranom štádiu vývoja tkaniva, najmä v neurónoch, ktoré nemajú nadviazané kontakty s cieľovými bunkami a sú tak zbavené trofickej podpory týchto buniek. V dospelosti intenzita apoptózy v centrálnom nervovom systéme cicavcov výrazne klesá, hoci v iných tkanivách zostáva vysoká. Eliminácia buniek infikovaných vírusom a rozvoj imunitnej odpovede sú tiež sprevádzané apoptotickou reakciou. Spolu s apoptózou existujú aj iné varianty programovanej bunkovej smrti.
Morfologické markery apoptózy sú apoptotické telá a vrásčité neuróny s neporušenou membránou. Biochemický marker, ktorý sa stal takmer identickým s konceptom „apoptózy“, je fragmentácia DNA. Tento proces je aktivovaný iónmi Ca2+ a Mg2+ a inhibovaný iónmi Zn2+. K štiepeniu DNA dochádza v dôsledku pôsobenia endonukleázy závislej od vápnika a horčíka. Zistilo sa, že endonukleázy štiepia DNA medzi histónovými proteínmi a uvoľňujú fragmenty pravidelnej dĺžky. DNA sa najprv rozdelí na veľké fragmenty s 50 000 a 300 000 bázami, ktoré sa potom štiepia na kúsky so 180 pármi báz, ktoré po oddelení gélovou elektroforézou tvoria „rebrík“. Fragmentácia DNA nie vždy koreluje s morfologickou charakteristikou apoptózy a je podmieneným markerom, ktorý nie je ekvivalentný morfologickým kritériám. Najpokročilejšou metódou na potvrdenie apoptózy je biologicko-histochemická metóda, ktorá umožňuje zaznamenať nielen fragmentáciu DNA, ale aj dôležitý morfologický znak – apoptotické telieska.
Program apoptózy pozostáva z troch po sebe nasledujúcich etáp: rozhodnutie o smrti alebo prežití; implementácia mechanizmu ničenia; eliminácia odumretých buniek (degradácia bunkových zložiek a ich fagocytóza).
Prežitie alebo smrť buniek je do značnej miery determinované produktmi expresie génov rodiny cW. Proteínové produkty dvoch z týchto génov sú ced-3 A ced-4(„zabíjačské gény“) sú nevyhnutné na to, aby došlo k apoptóze. Proteínový produkt génu ced-9 chráni bunky tým, že bráni apoptóze tým, že bráni excitácii génu ced-3 A ced-4.Ďalšie gény rodiny ced kódujú proteíny zapojené do balenia a fagocytózy umierajúcich buniek a degradácie DNA mŕtvych buniek.
U cicavcov homológy génu zabijaka ced-3(a jeho proteínové produkty) sú gény kódujúce enzýmy konvertujúce interleukín – kaspázy (cysteínaspartylproteázy), ktoré majú rôzne substrátové a inhibičné špecifity. Neaktívne prekurzory kaspáz, prokaspázy, sú prítomné vo všetkých bunkách. Aktivácia prokaspáz u cicavcov sa uskutočňuje analógom génu ced-4 - excitačným faktorom apoptotickej proteázy-1 (Apaf-a), väzba na ATP, čo zdôrazňuje dôležitosť úrovne dodávky energie pre voľbu mechanizmu smrti. Pri excitácii kaspázy modifikujú aktivitu bunkových proteínov (polymerázy, endonukleázy, zložky jadrovej membrány) zodpovedných za fragmentáciu DNA v apoptotických bunkách. Aktivované enzýmy začínajú štiepenie DNA objavením sa trifosfonukleotidov v miestach zlomov a spôsobujú deštrukciu cytoplazmatických proteínov. Bunka stráca vodu a zmenšuje sa, pH cytoplazmy klesá. Bunková membrána stráca svoje vlastnosti, bunka sa zmenšuje, vznikajú apoptotické telieska. Proces reštrukturalizácie bunkových membrán je založený na aktivácii syringomyelázy, ktorá rozkladá syringomyelín bunky za uvoľnenia ceramidu, ktorý aktivuje fosfolipázu A2. Akumulujú sa produkty kyseliny arachidónovej. Proteíny fosfatidylserín a vitronektín exprimované počas apoptózy sa dostanú na vonkajší povrch bunky a signalizujú makrofágom, ktoré uskutočňujú fagocytózu apoptotických teliesok.
Homológy génu háďatka ced-9, určujúci prežitie buniek, u cicavcov je to rodina protoonkogénov bcl-2. A bcl-2, a príbuzný proteín bcl-x-l prítomné v mozgu cicavcov, kde chránia neuróny pred apoptózou počas ischemickej expozície, odstránením rastových faktorov a vplyvom neurotoxínov in vivo A in vitro. Analýza produktov génovej expresie bcl-2 odhalila celú rodinu proteínov súvisiacich s bcl-2, vrátane antiapoptotických (Bcl-2 A Bcl-x-l), a proapoptotické (Bcl-x-s, Bax, Bad, Bag) bielkoviny. Bax a bad proteíny majú homológnu sekvenciu a tvoria heterodiméry s bcl-2 A bcl-x-l in vitro. Za činnosť, ktorá potláča smrť, bcl-2 A bcl-x-l musí tvoriť diméry s proteínom bah, a diméry so zlým proteínom zvyšujú smrť. To nám umožnilo dospieť k záveru bcl-2 a príbuzné molekuly sú kľúčovými determinantmi bunkového prežitia alebo bunkovej smrti v CNS. Molekulárne genetické štúdie zistili, že je to tak
nazývaná génová rodina bcl-2, pozostáva zo 16 génov s opačnými funkciami, u ľudí je mapovaný na chromozóme 18. Antiapoptotické účinky má šesť génov z čeľade, podobne ako predchodca skupiny bcl-2; ostatných 10 génov podporuje apoptózu.
Pro- a antiapoptotické účinky aktivovaných produktov génovej expresie bcl-2 sa realizujú moduláciou mitochondriálnej aktivity. Mitochondrie sú kľúčovými hráčmi v apoptóze. Obsahujú cytochróm C, ATP, ióny Ca 2+ a faktor indukujúci apoptózu (AIF) – zložky potrebné na vyvolanie apoptózy. K uvoľneniu týchto faktorov z mitochondrií dochádza pri interakcii jej membrány s aktivovanými proteínmi rodiny bcl-2, ktoré sa pripájajú k vonkajšej membráne mitochondrie v miestach, kde sa vonkajšia a vnútorná membrána spájajú - v oblasti takzvaného permeabilizačného póru, čo je megakanál s priemerom do 2 nm. Pri pripájaní bielkovín bcl-2 smerom k vonkajšej membráne mitochondrií sa megakanály pórov rozširujú na 2,4-3 nm. Prostredníctvom týchto kanálov vstupujú cytochróm C, ATP a AIF do cytosólu bunky z mitochondrií. Rodina antiapoptotických proteínov bcl-2, naopak, uzatvárajú megakanály, čím prerušujú postup apoptotického signálu a chránia bunku pred apoptózou. Počas procesu apoptózy mitochondrie nestrácajú svoju integritu a nie sú zničené. Cytochróm C uvoľnený z mitochondrií tvorí komplex s apoptotickým faktorom aktivujúcim proteázu (APAF-l), kaspázou-9 a ATP. Tento komplex je apoptozóm, v ktorom dochádza k aktivácii kaspázy-9 a potom hlavnej „zabijáckej“ kaspázy-3, ktorá vedie k bunkovej smrti. Mitochondriálna signalizácia je hlavnou cestou na vyvolanie apoptózy.
Ďalším mechanizmom na vyvolanie apoptózy je prenos proapoptotického signálu, keď sa ligand viaže na receptory oblasti bunkovej smrti, ku ktorému dochádza pomocou adaptorových proteínov FADD/MORT1, TRADD. Receptorová dráha bunkovej smrti je oveľa kratšia ako mitochondriálna: kaspáza-8 je aktivovaná prostredníctvom adaptorových molekúl, ktoré následne priamo aktivujú „zabíjačské“ kaspázy.
Určité bielkoviny ako napr p53, p21 (WAF1), môže podporovať rozvoj apoptózy. Ukázalo sa, že je to prirodzené p53 indukuje apoptózu v nádorových bunkových líniách a in vivo. Transformácia p53 z prirodzeného typu na mutantnú formu vedie k rozvoju rakoviny v mnohých orgánoch v dôsledku potlačenia procesov apoptózy.
Degenerácia axónov
Po prerezaní axónu v sóme nervovej bunky sa vyvinie takzvaná axónová reakcia, zameraná na obnovu axónu syntézou nových štruktúrnych proteínov. V sóme intaktných neurónov sú Nissl telieska intenzívne zafarbené zásaditým anilínovým farbivom, ktoré sa viaže na ribonukleové kyseliny ribozómov. Počas reakcie axónov však cisterny hrubého endoplazmatického retikula zväčšujú svoj objem a plnia sa produktmi syntézy bielkovín. Dochádza k chromatolýze – dezorganizácii ribozómov, v dôsledku čoho sa farbenie teliesok Nissl základným anilínovým farbivom výrazne oslabuje. Telo bunky napučí a zaguľatí a jadro sa posunie na jednu stranu (excentrická poloha jadra). Všetky tieto morfologické zmeny sú odrazom cytologických procesov sprevádzajúcich zvýšenú syntézu bielkovín.
Časť axónu distálna od miesta transekcie odumiera. V priebehu niekoľkých dní je táto oblasť a všetky synaptické zakončenia axónu zničené. Degeneruje aj myelínový obal axónu, jeho fragmenty sú zachytené fagocytmi. Neurogliálne bunky, ktoré tvoria myelín, však nezomrú. Tento sled javov sa nazýva Wallerova degenerácia.
Ak poškodený axón poskytol jediný alebo hlavný synaptický vstup do nervovej alebo efektorovej bunky, potom postsynaptická bunka môže degenerovať a zomrieť. Známym príkladom je atrofia vlákien kostrového svalstva po narušení ich inervácie motorickými neurónmi.
Regenerácia axónov
Po degenerácii poškodeného axónu môže mnohým neurónom vyrásť nový axón. Na konci proximálneho segmentu sa axón začína vetviť [pruiting (klíčenie)- šírenie]. V PNS rastú novovzniknuté vetvy pozdĺž pôvodnej dráhy mŕtveho nervu, ak je, samozrejme, táto cesta prístupná. Počas Wallerovej degenerácie Schwannove bunky distálnej časti nervu nielen prežívajú, ale aj proliferujú a zoraďujú sa do radov, kadiaľ prechádzal mŕtvy nerv. "Rastové kužele" regenerujúceho axónu si cestujú medzi radmi Schwannových buniek a môžu nakoniec dosiahnuť svoje ciele a reinervovať ich. Axóny sú potom remyelinizované Schwannovými bunkami. Rýchlosť regenerácie je obmedzená
je určená rýchlosťou pomalého axonálneho transportu, t.j. približne 1 mm/deň.
Regenerácia axónov v CNS je trochu odlišná: bunky oligodendroglií nemôžu poskytnúť cestu pre rast vetiev axónov, pretože v CPS každý oligodendrocyt myelinizuje mnoho axónov (na rozdiel od Schwannových buniek v PNS, z ktorých každá dodáva myelín len jednému axónu).
Je dôležité poznamenať, že chemické signály majú rôzne účinky na regeneračné procesy v CNS a PNS. Ďalšou prekážkou regenerácie axónov v centrálnom nervovom systéme sú gliové jazvy tvorené astrocytmi.
Synaptické klíčenie, ktoré zabezpečuje „opätovné zosilnenie“ existujúcich neuronálnych prúdov a tvorbu nových polysynaptických spojení, určuje plasticitu neurónového tkaniva a tvorí mechanizmy podieľajúce sa na obnove poškodených neurologických funkcií.
Trofické faktory
Úroveň jeho trofického zásobenia hrá dôležitú úlohu pri vzniku ischemického poškodenia mozgového tkaniva.
Neurotrofické vlastnosti sú vlastné mnohým proteínom, vrátane štrukturálnych proteínov (napríklad S100β). Zároveň sú maximálne realizované rastovými faktormi, ktoré predstavujú heterogénnu skupinu trofických faktorov, pozostávajúcu minimálne zo 7 rodín - neurotrofíny, cytokíny, fibroblastové rastové faktory, inzulín-dependentné rastové faktory, rodina transformujúcich rastových faktorov 31 (TGF-J3I), epidermálne rastové faktory a iné, vrátane rastového proteínu 6 (GAP-6)4, rastového faktora závislého od krvných doštičiek, neurotrofického faktora viazaného na heparín, erytropoetínu, faktora stimulujúceho kolónie makrofágov atď. (tabuľka 1.2).
Najsilnejší trofický vplyv na všetky základné procesy života neurónov majú neurotrofíny - regulačné proteíny nervového tkaniva, ktoré sa syntetizujú v jeho bunkách (neurónoch a gliách). Pôsobia lokálne - v mieste uvoľnenia a obzvlášť intenzívne vyvolávajú dendritické vetvenie a rast axónov v smere k cieľovým bunkám.
Doteraz boli najviac študované tri neurotrofíny, ktoré sú si navzájom štrukturálne podobné: nervový rastový faktor (NGF), rastový faktor odvodený od mozgu (BDNF) a neurotrofín-3 (NT-3).
Tabuľka 1.2. Moderná klasifikácia neurotrofických faktorov

 Vo vyvíjajúcom sa organizme sú syntetizované cieľovou bunkou (napríklad svalovým vretienkom), difundujú smerom k neurónu a viažu sa na receptorové molekuly na jeho povrchu.
Vo vyvíjajúcom sa organizme sú syntetizované cieľovou bunkou (napríklad svalovým vretienkom), difundujú smerom k neurónu a viažu sa na receptorové molekuly na jeho povrchu.
Rastové faktory naviazané na receptor sú vychytávané neurónmi (t. j. endocytované) a transportované retrográdne do soma. Tam môžu pôsobiť priamo na jadro a meniť tvorbu enzýmov zodpovedných za syntézu neurotransmiterov a rast axónov. Existujú dve formy receptorov pre rastové faktory – nízkoafinitné receptory a vysokoafinitné receptory tyrozínkinázy, s ktorými sa viaže väčšina trofických faktorov.
Výsledkom je, že axón dosiahne cieľovú bunku a vytvorí s ňou synaptický kontakt. Rastové faktory podporujú život neurónov, ktoré v ich neprítomnosti nemôžu existovať.
Trofická dysregulácia je jednou z univerzálnych zložiek patogenézy poškodenia nervového systému. Keď sú zrelé bunky zbavené trofickej podpory, vyvíja sa biochemická a funkčná dediferenciácia neurónov so zmenami vlastností inervovaných tkanív. Trofická dysregulácia ovplyvňuje stav makromolekúl zapojených do membránovej elektrogenézy, aktívneho transportu iónov, synaptickej transmisie (enzýmy na syntézu mediátorov, postsynaptické receptory) a efektorovej funkcie (svalový myozín). Súbory dediferencovaných centrálnych neurónov vytvárajú ohniská patologicky zvýšenej excitácie, spúšťajú patobiochemické kaskády, ktoré vedú k smrti neurónov prostredníctvom mechanizmov nekrózy a apoptózy. Naopak, pri dostatočnej úrovni trofického zásobenia sa často pozoruje regresia neurologického deficitu po ischemickom poškodení mozgu aj pri zostávajúcom morfologickom defekte, ktorý ho pôvodne spôsobil, čo svedčí o vysokej adaptabilite mozgových funkcií.
Zistilo sa, že rozvoj nedostatočného trofického zásobenia zahŕňa zmeny v homeostáze draslíka a vápnika, nadmernú syntézu oxidu dusnatého, ktorý blokuje enzým tyrozínkinázu, ktorý je súčasťou aktívneho centra trofických faktorov, a nerovnováhu cytokínov. Jedným z navrhovaných mechanizmov je autoimunitná agresia voči vlastným neurotrofínom a štrukturálnym neurošpecifickým proteínom, ktoré majú trofické vlastnosti, čo je možné v dôsledku narušenia ochrannej funkcie hematoencefalickej bariéry.
Na základe ich morfofunkčných charakteristík existujú 3 hlavné typy neurónov.
Aferentné (senzitívne, receptorové) neuróny vedú impulzy do centrálneho nervového systému, t.j. dostredivý. Telá týchto neurónov ležia vždy mimo mozgu alebo miechy v uzlinách (gangliách) periférneho nervového systému 2) Interkalované (intermediárne, asociatívne) neuróny prenášajú vzruch z aferentného (senzitívneho) neurónu na eferentný (motorický alebo sekrečný). 3) Eferentné (motorické, sekrečné, efektorové) neuróny vedú impulzy pozdĺž svojich axónov k pracovným orgánom (svaly, žľazy). Telá týchto neurónov sa nachádzajú v centrálnom nervovom systéme alebo na periférii – v sympatických a parasympatikových uzlinách.
Hlavnou formou nervovej aktivity je reflex. Reflex (lat. reflexus - odraz) je kauzálne podmienená reakcia tela na podráždenie, ktorá sa vykonáva s povinnou účasťou centrálneho nervového systému. Štrukturálny základ reflexnej aktivity tvoria nervové reťazce receptorových, interkalárnych a efektorových neurónov. Tvoria dráhu, po ktorej prechádzajú nervové vzruchy z receptorov do výkonného orgánu, nazývanú reflexný oblúk Zahŕňa: receptor -> aferentná nervová dráha -> reflexné centrum -> eferentná dráha -> efektor.
Miecha (medulla spinalis) je počiatočná časť centrálneho nervového systému. Nachádza sa v miechovom kanáli a je to valcovitá šnúra, sploštená spredu dozadu, 40-45 cm dlhá, 1 až 1,5 cm široká, s hmotnosťou 34-38 g (2 % mozgovej hmoty). Zhora prechádza do predĺženej miechy a dole je ukončená hrotom - dreňovým kužeľom na úrovni I - II bedrových stavcov, kde z neho vystupuje tenké koncové (terminálne) vlákno (zárodok drene). kaudálny (kaudálny) koniec miechy). Priemer miechy sa v rôznych oblastiach líši. V krčnej a bedrovej oblasti tvorí zhrubnutia (inervácia horných a dolných končatín). Na prednej ploche miechy je predná stredná štrbina, na zadnej ploche zadná sulcus medianus, ktoré rozdeľujú miechu na prepojené pravé a ľavé symetrické polovice. Na každej polovici sú rozlíšené slabo definované predné bočné a zadné bočné ryhy. Prvým je miesto, kde predné motorické korene vychádzajú z miechy, druhým je miesto, kde do mozgu vstupujú zadné senzorické korene miechových nervov. Tieto bočné drážky tiež slúžia ako hranica medzi predným, laterálnym a zadným povrazcom miechy. Vo vnútri miechy je úzka dutina - centrálny kanál, naplnený cerebrospinálnou tekutinou (u dospelého človeka je zarastená v rôznych častiach a niekedy po celej dĺžke).
Miecha je rozdelená na časti: krčnú, hrudnú, driekovú, krížovú a kostrčovú a časti sú rozdelené na segmenty. Segment (štrukturálna a funkčná jednotka miechy) je oblasť zodpovedajúca dvom párom koreňov (dvom predným a dvom zadným). Po celej dĺžke miechy vychádza z každej strany 31 párov koreňov. V súlade s tým je 31 párov miechových nervov v mieche rozdelených do 31 segmentov: 8 krčných, 12 hrudných, 5 bedrových, 5 sakrálnych a 1-3 kostrčových.
Miecha pozostáva zo šedej a bielej hmoty. Šedá hmota - neuróny (13 miliónov), tvoriace 3 sivé stĺpce v každej polovici miechy: predné, zadné a bočné. V priereze miechy majú stĺpce šedej hmoty na každej strane vzhľad rohov. Širší predný roh a úzky zadný roh zodpovedajú prednému a zadnému šedému stĺpiku. Bočný roh zodpovedá strednému stĺpcu (vegetatívnemu) šedej hmoty. Sivá hmota predných rohov obsahuje motorické neuróny (motoneuróny), zadné rohy obsahujú interkalárne senzorické neuróny a bočné rohy obsahujú interkalárne autonómne neuróny. Biela hmota miechy je lokalizovaná smerom von zo sivej hmoty a tvorí prednú, bočnú a zadnú šnúru. Skladá sa prevažne z pozdĺžne prebiehajúcich nervových vlákien, spojených do zväzkov - dráh. Biela hmota predných povrazcov obsahuje zostupné dráhy, postranné povrazce obsahujú vzostupné a zostupné dráhy a zadné povrazce obsahujú vzostupné dráhy.
Spojenie medzi miechou a perifériou sa uskutočňuje cez nervové vlákna prechádzajúce v miechových koreňoch. Predné korene obsahujú dostredivé motorické vlákna a zadné korene dostredivé senzorické vlákna (preto pri obojstrannej transekcii dorzálnych koreňov miechy u psa citlivosť zmizne, predné korene sú zachované, ale svalový tonus končatín zmizne).