Podstawowe pojęcia chemii, prawa stechiometrii
Atomizm chemiczny (teoria atomowo-molekularna) jest historycznie pierwszą podstawową koncepcją teoretyczną, która stanowi podstawę współczesnej nauki chemicznej. Tworzenie tej teorii trwało ponad sto lat i jest związane z działalnością tak wybitnych chemików jak M.V. Łomonosow, A.L. Lavoisier, J. Dalton, A. Avogadro, S. Cannizzaro.
Nowoczesną teorię atomowo-molekularną można przedstawić w postaci szeregu postanowień:
1. Substancje chemiczne mają strukturę dyskretną (nieciągłą). Cząsteczki materii znajdują się w ciągłym, chaotycznym ruchu termicznym.
2. Podstawową jednostką strukturalną substancji chemicznej jest atom.
3. Atomy substancji chemicznej łączą się ze sobą, tworząc cząstki molekularne lub agregaty atomowe (struktury supramolekularne).
4. Substancje złożone (lub związki chemiczne) składają się z atomów różnych pierwiastków. Substancje proste składają się z atomów jednego pierwiastka i należy je uważać za homojądrowe związki chemiczne.
Formułując podstawowe zasady teorii atomowo-molekularnej, musieliśmy wprowadzić kilka pojęć, które należy omówić bardziej szczegółowo, ponieważ są one fundamentalne we współczesnej chemii. Są to pojęcia „atom” i „cząsteczka”, a dokładniej cząstki atomowe i molekularne.
Cząstki atomowe obejmują sam atom, jony atomowe, rodniki atomowe i jony rodnikowe.
Atom jest najmniejszą elektrycznie obojętną cząstką pierwiastek chemiczny, który jest nośnikiem jego właściwości chemicznych i składa się z dodatnio naładowanego jądra i powłoki elektronowej.
Jon atomowy to cząstka atomowa, która ma ładunek elektrostatyczny, ale nie ma niesparowanych elektronów, na przykład Cl - to anion chlorkowy, Na + to kation sodu.
Rodnik atomowy- elektrycznie obojętna cząstka atomowa zawierająca niesparowane elektrony. Na przykład atom wodoru jest w rzeczywistości rodnikiem atomowym - H × .
Cząstkę atomową, która ma ładunek elektrostatyczny i niesparowane elektrony, nazywa się jon rodnikowy atomowy. Przykładem takiej cząstki jest kation Mn 2+, który zawiera pięć niesparowanych elektronów na podpoziomie d (3d 5).
Jedną z najważniejszych cech fizycznych atomu jest jego masa. Ponieważ wartość bezwzględna masy atomu jest znikoma (masa atomu wodoru wynosi 1,67 × 10 -27 kg), w chemii stosuje się względną skalę mas, w której 1/12 masy atomu węgla izotopu- Jako jednostkę wybrano 12. Względna masa atomowa to stosunek masy atomu do 1/12 masy atomu węgla izotopu 12C.
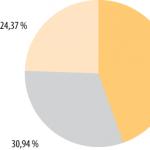
Należy zauważyć, że w układzie okresowym D.I. Mendelejew przedstawia średnie izotopowe masy atomowe pierwiastków, które są najczęściej reprezentowane przez kilka izotopów, które składają się na masę atomową pierwiastka proporcjonalnie do ich zawartości w przyrodzie. Zatem pierwiastek chlor jest reprezentowany przez dwa izotopy - 35 Cl (75 mol.%) i 37 Cl (25 mol.%). Średnia masa izotopowa pierwiastka chloru wynosi 35,453 amu. (jednostki masy atomowej) (35×0,75 + 37×0,25).
Podobnie jak cząstki atomowe, cząstki molekularne obejmują same cząsteczki, jony molekularne, rodniki molekularne i jony rodnikowe.
cząsteczka molekularna- jest to najmniejszy stabilny zbiór wzajemnie połączonych cząstek atomowych, który jest nośnikiem właściwości chemicznych substancji. Cząsteczka jest pozbawiona ładunku elektrostatycznego i nie ma niesparowanych elektronów.
jon molekularny to cząsteczka molekularna, która ma ładunek elektrostatyczny, ale nie ma niesparowanych elektronów, na przykład NO 3 - jest anionem azotanowym, NH 4 + jest kationem amonowym.
rodnik molekularny jest elektrycznie obojętną cząsteczką zawierającą niesparowane elektrony. Większość rodników to cząstki reakcyjne o krótkim czasie życia (rzędu 10 -3 -10 -5 s), choć obecnie znane są rodniki dość stabilne. A więc rodnik metylowy × CH3 jest typową cząstką o niskiej stabilności. Jeśli jednak znajdujące się w nim atomy wodoru zostaną zastąpione rodnikami fenylowymi, wówczas powstanie stabilny rodnik molekularny trifenylometyl
Cząsteczki z nieparzystą liczbą elektronów, takie jak NO lub NO2, można również uznać za wysoce stabilne wolne rodniki.
Cząsteczka molekularna posiadająca ładunek elektrostatyczny i niesparowane elektrony nazywa się jon rodnikowy molekularny. Przykładem takiej cząstki jest kation rodnika tlenowego – ×O 2 + .
Ważną cechą cząsteczki jest jej względna masa cząsteczkowa. Względna masa cząsteczkowa (M r) to stosunek średniej masy izotopowej cząsteczki, obliczonej z uwzględnieniem naturalnej zawartości izotopów, do 1/12 masy atomu węgla izotopu 12 C.
W ten sposób odkryliśmy, że najmniejszą jednostką strukturalną dowolnej substancji chemicznej jest atom, a raczej cząstka atomowa. Z kolei w dowolnej substancji, z wyjątkiem gazów obojętnych, atomy są połączone ze sobą wiązaniami chemicznymi. W takim przypadku możliwe jest tworzenie dwóch rodzajów substancji:
· związki molekularne, w których można wyodrębnić najmniejsze nośniki właściwości chemicznych, posiadające stabilną strukturę;
· związki o strukturze supramolekularnej, będące agregatami atomowymi, w których cząstki atomowe są połączone wiązaniami kowalencyjnymi, jonowymi lub metalicznymi.
Odpowiednio, substancjami o strukturze supramolekularnej są kryształy atomowe, jonowe lub metaliczne. Z kolei substancje molekularne tworzą kryształy molekularne lub molekularno-jonowe. Substancje zawarte w substancjach mają również strukturę molekularną. normalne warunki w stanie gazowym lub ciekłym.
Tak naprawdę pracując z konkretną substancją chemiczną nie mamy do czynienia z pojedynczymi atomami czy cząsteczkami, ale ze zbiorem bardzo duża liczba cząstek, których poziomy organizacji można przedstawić za pomocą następującego diagramu:

Do ilościowego opisu dużych układów cząstek, będących makrociałami, wprowadzono specjalne pojęcie „ilości materii”, jako ściśle określonej liczby jej elementów strukturalnych. Jednostką ilości substancji jest mol. Mol to ilość substancji(N) , zawierający tyle jednostek strukturalnych lub wzorów, ile jest atomów zawartych w 12 g izotopu węgla 12 C. Obecnie liczba ta jest mierzona dość dokładnie i wynosi 6,022 × 10 23 (liczba Avogadra, N A). Atomy, cząsteczki, jony, wiązania chemiczne i inne obiekty mikroświata mogą pełnić rolę jednostek strukturalnych. Pojęcie „jednostki wzoru” stosowane jest w przypadku substancji o strukturze supramolekularnej i definiuje się je jako najprostszą zależność pomiędzy jej elementami składowymi (wzór brutto). W w tym przypadku jednostka formuły przyjmuje rolę cząsteczki. Na przykład 1 mol chlorku wapnia zawiera 6,022 × 10 23 jednostek wzoru - CaCl 2.
Jedną z ważnych cech substancji jest jej masa molowa (M, kg/mol, g/mol). Masa molowa to masa jednego mola substancji. Względna masa cząsteczkowa i masa molowa substancji są liczbowo takie same, ale mają różne wymiary, na przykład dla wody M r = 18 (względne masy atomowe i cząsteczkowe są wartościami bezwymiarowymi), M = 18 g/mol. Ilość substancji i masa molowa są powiązane prostą zależnością:
Podstawowe prawa stechiometryczne, które zostały sformułowane na przełomie XVII i XVIII wieku, odegrały główną rolę w powstaniu atomizmu chemicznego.
1. Prawo zachowania masy (M.V. Łomonosow, 1748).
Suma mas produktów reakcji jest równa sumie mas substancji, które oddziaływały. W formie matematycznej prawo to wyraża się następującym równaniem:
![]()
Dodatkiem do tego prawa jest prawo zachowania masy pierwiastka (A. Lavoisier, 1789). Zgodnie z tym prawem Podczas reakcji chemicznej masa każdego pierwiastka pozostaje stała.
Prawa M.V. Łomonosowa i A. Lavoisier znalazły proste wyjaśnienie w ramach teorii atomowej. Rzeczywiście, podczas każdej reakcji atomy pierwiastków chemicznych pozostają niezmienione i w stałych ilościach, co pociąga za sobą zarówno stałość masy każdego pierwiastka indywidualnie, jak i układ substancji jako całości.
Rozważane prawa mają decydujące znaczenie dla chemii, gdyż pozwalają modelować reakcje chemiczne za pomocą równań i na ich podstawie dokonywać obliczeń ilościowych. Należy jednak zaznaczyć, że prawo zachowania masy nie jest w pełni dokładne. Jak wynika z teorii względności (A. Einstein, 1905), każdemu procesowi zachodzącemu wraz z wyzwoleniem energii towarzyszy spadek masy układu zgodnie z równaniem:
gdzie DE to uwolniona energia, Dm to zmiana masy układu, c to prędkość światła w próżni (3,0×10 8 m/s). W efekcie równanie prawa zachowania masy należy zapisać w postaci:
![]()
Zatem reakcjom egzotermicznym towarzyszy spadek masy, a reakcjom endotermicznym towarzyszy wzrost masy. W tym przypadku prawo zachowania masy można sformułować w następujący sposób: w układzie izolowanym suma mas i zredukowanych energii jest wielkością stałą. Jednak w przypadku reakcji chemicznych efekty termiczne które są mierzone w setkach kJ/mol, defekt masy wynosi 10 -8 -10 -9 g i nie można go wykryć eksperymentalnie.
2. Prawo stałości składu (J. Proust, 1799-1804).
Indywidualny środek chemiczny struktura molekularna posiada stały skład jakościowy i ilościowy, niezależny od sposobu jego przygotowania. Związki podlegające prawu stałego składu nazywane są daltonista. Daltonidy to wszystkie znane obecnie związki organiczne (około 30 milionów) i część (około 100 tysięcy) substancji nieorganicznych. Substancje o strukturze niemolekularnej ( Bertolidy), nie przestrzegają tego prawa i mogą mieć zmienny skład, w zależności od sposobu uzyskania próbki. Należą do nich większość (ok. 500 tys.) substancji nieorganicznych. Są to głównie związki binarne pierwiastków d (tlenki, siarczki, azotki, węgliki itp.). Przykładem związku o zmiennym składzie jest tlenek tytanu(III), którego skład waha się od TiO 1,46 do TiO 1,56. Przyczyną zmiennego składu i irracjonalności formuł Bertolidu są zmiany w składzie niektórych elementarnych komórek kryształu (wady w strukturze kryształu), które nie pociągają za sobą gwałtownej zmiany właściwości substancji. W przypadku daltonidów takie zjawisko jest niemożliwe, ponieważ zmiana składu cząsteczki prowadzi do powstania nowego związku chemicznego.
3. Prawo ekwiwalentów (I. Richter, J. Dalton, 1792-1804).
Masy reagujących substancji są wprost proporcjonalne do ich mas równoważnych.
gdzie E A i E B są równoważnymi masami reagujących substancji.
Masa równoważna substancji to masa molowa jej odpowiednika.
Równoważnik to cząstka rzeczywista lub warunkowa, która oddaje lub zyskuje jeden kation wodoru w reakcjach kwasowo-zasadowych, jeden elektron w reakcjach redoks lub oddziałuje z jednym równoważnikiem dowolnej innej substancji w reakcjach wymiany. Na przykład, gdy metaliczny cynk reaguje z kwasem, jeden atom cynku wypiera dwa atomy wodoru, oddając dwa elektrony:
Zn + 2H + = Zn 2+ + H 2
Zn 0 - 2e - = Zn 2+
Zatem odpowiednikiem cynku jest 1/2 jego atomu, tj. 1/2 Zn (cząstka warunkowa).
Liczba wskazująca, która część cząsteczki lub jednostki wzoru substancji jest jej odpowiednikiem, nazywana jest współczynnikiem równoważności - f e. Masę równoważną lub masę molową równoważnika definiuje się jako iloczyn współczynnika równoważności i masy molowej:
Na przykład w reakcji zobojętniania kwas siarkowy oddaje dwa kationy wodoru:
H 2 SO 4 + 2KOH = K 2 SO 4 + 2H 2 O
Odpowiednio, równoważnik kwasu siarkowego wynosi 1/2 H 2 SO 4, współczynnik równoważności wynosi 1/2, a masa równoważna wynosi (1/2) × 98 = 49 g/mol. Wodorotlenek potasu wiąże jeden kation wodoru, więc jego odpowiednikiem jest jednostka wzoru, współczynnik równoważności jest równy jeden, a masa równoważna jest równa masie molowej, tj. 56 g/mol.
Z rozważanych przykładów jasno wynika, że przy obliczaniu masy równoważnej konieczne jest określenie współczynnika równoważności. Jest na to kilka zasad:
1. Współczynnik równoważności kwasu lub zasady jest równy 1/n, gdzie n jest liczbą kationów wodorowych lub anionów wodorotlenkowych biorących udział w reakcji.
2. Współczynnik równoważności soli jest równy ilorazowi jedności podzielonej przez iloczyn wartościowości (v) kationu metalu lub reszty kwasowej i ich liczby (n) w soli (wskaźnik stechiometryczny we wzorze):
Na przykład dla Al 2 (SO 4) 3 - f e = 1/6
3. Współczynnik równoważności środka utleniającego (redukującego) jest równy ilorazowi jedności podzielonemu przez liczbę przyłączonych (oddanych) przez niego elektronów.
Należy zwrócić uwagę na fakt, że ten sam związek może mieć inny współczynnik równoważności w różnych reakcjach. Na przykład w reakcjach kwasowo-zasadowych:
H 3 PO 4 + KOH = KH 2 PO 4 + H 2 O fa mi (H 3 PO 4) = 1
H 3 PO 4 + 2KOH = K 2 HPO 4 + 2H 2 O fa e (H 3 PO 4) = 1/2
H 3 PO 4 + 3KOH = K 3 PO 4 + 3H 2 O fa e (H 3 PO 4) = 1/3
lub w reakcjach redoks:
KMn 7+ O 4 + NaNO 2 + H 2 SO 4 ® Mn 2+ SO 4 + NaNO 3 + K 2 SO 4 + H 2 O
MnO 4 - + 8H + + 5e - ® Mn 2+ + 4H 2 O f e (KMnO 4) = 1/5
Materiał z Uncyklopedii
Wiodącą ideą nauk atomowo-molekularnych, która stanowi podstawę współczesnej fizyki, chemii i nauk przyrodniczych, jest idea nieciągłości (nieciągłości struktury) materii.
Pierwsze koncepcje mówiące, że materia składa się z pojedynczych, niepodzielnych cząstek, pojawiły się już w starożytności i początkowo były rozwijane w sposób ogólny idee filozoficzne o świecie. Na przykład niektórzy szkoły filozoficzne Starożytne Indie(I tysiąclecie p.n.e.) uznali nie tylko istnienie pierwotnych niepodzielnych cząstek materii (anu), ale także ich zdolność do łączenia się ze sobą, tworząc nowe cząstki. Podobne nauki istniały w innych krajach świat starożytny. Największą sławę i wpływ na dalszy rozwój nauki wywarł starożytny grecki atomizm, którego twórcami byli Leucypos (V wp.n.e.) i Demokryt (b. ok. 460 p.n.e. - ok. 370 p.n.e.). „Przyczynami wszystkiego” – napisał starożytny grecki filozof i uczony Arystoteles (384–322 p.n.e.), objaśniając doktrynę Demokryta – „są pewne różnice w atomach. I są trzy różnice: forma, porządek i pozycja.” W pracach samego Arystotelesa istnieje ważna koncepcja mixis – jednorodnego związku utworzonego z różne substancje. Później starożytny grecki filozof materialista Epikur (342–341 p.n.e. - 271–270 p.n.e.) wprowadził koncepcję masy atomów i ich zdolności do spontanicznego odchylania się podczas ruchu.
Należy zauważyć, że według wielu starożytnych greckich naukowców złożone ciało nie jest prostą mieszaniną atomów, ale jakościowo nową integralną formacją, obdarzoną nowymi właściwościami. Jednak Grecy nie opracowali jeszcze koncepcji specjalnych cząstek „wieloatomowych” - cząsteczek pośrednich między atomami i ciałami złożonymi, które byłyby najmniejszymi nośnikami właściwości ciał.
W średniowieczu nastąpił gwałtowny spadek zainteresowania starożytnym atomizmem. Kościół oskarżał starożytnych Greków nauki filozoficzne w twierdzeniu, że świat powstał z przypadkowych kombinacji atomów, a nie z woli Boga, jak tego wymaga dogmat chrześcijański.
W XVI–XVII w. W atmosferze ogólnego ożywienia kulturalnego i naukowego rozpoczyna się odrodzenie atomizmu. W tym okresie zaawansowani naukowcy różne kraje: G. Galileo (1564–1642) we Włoszech, P. Gassendi (1592–1655) we Francji, R. Boyle (1627–1691) w Anglii i inni – głosili zasadę: nie szukać prawdy w Piśmie Świętym, lecz „bezpośrednio” przeczytać księgę natury
Główną zasługę dalszego rozwoju starożytnego atomizmu zawdzięczają P. Gassendi i R. Boyle. Gassendi wprowadził pojęcie cząsteczki, przez które rozumiał jakościowo nową formację złożoną z połączenia kilku atomów. Szeroki program stworzenia korpuskularnej filozofii przyrody zaproponował R. Boyle. Świat ciałek, ich ruchu i „splotu” zdaniem angielskiego naukowca jest bardzo złożony. Świat jako całość i jego najmniejsze cząstki są celowo ułożonymi mechanizmami. Ciałka Boyle'a nie są już pierwotnymi, niezniszczalnymi atomami starożytni filozofowie, ale złożoną całość zdolną do zmiany swojej struktury poprzez ruch.
„Odkąd przeczytałem Boyle’a” – napisał M.V. Łomonosow – „owłada mnie namiętne pragnienie badania najmniejszych cząstek”. Wielki rosyjski uczony M.V. Łomonosow (1711–1765) rozwinął i uzasadnił doktrynę o materialnych atomach i korpuskułach. Przypisywał atomom nie tylko niepodzielność, ale także zasadę czynną – zdolność do poruszania się i interakcji. „Niewrażliwe cząstki muszą różnić się masą, kształtem, ruchem, siłą bezwładności lub położeniem”. Korpuskuły ciał jednorodnych według Łomonosowa „składają się z tej samej liczby tych samych elementów, połączonych w ten sam sposób... Korpuskuły są niejednorodne, gdy ich elementy są różne lub połączone w różny sposób lub w różnej liczbie”. Tylko dlatego, że badania stosunków masowych na początku XVIII wieku. dopiero się zaczynał, Łomonosow nie był w stanie stworzyć ilościowego atomu nauki molekularne.
Dokonał tego angielski naukowiec D. Dalton (1766–1844). Uważał atom za najmniejszą cząstkę pierwiastka chemicznego, różniącą się od atomów innych pierwiastków przede wszystkim masą. Związek chemiczny według jego nauczania to zbiór atomów „złożonych” (lub „złożonych”), zawierający pewną liczbę atomów każdego pierwiastka, charakterystyczną tylko dla danej substancji złożonej. Pierwszą tabelę sporządził angielski naukowiec masy atomowe, ale ze względu na to, że jego poglądy na temat składu cząsteczek często opierały się na arbitralnych założeniach opartych na zasadzie „największej prostoty” (na przykład dla wody przyjął wzór OH), tabela ta okazała się niedokładna.
Ponadto w pierwszej połowie XIX w. wielu chemików nie wierzyło w możliwość określenia prawdziwych mas atomowych i wolało posługiwać się odpowiednikami, które można było znaleźć eksperymentalnie. Dlatego przypisano to samo połączenie różne formuły, co doprowadziło do ustalenia nieprawidłowych mas atomowych i molekularnych.
Jednymi z pierwszych, którzy rozpoczęli walkę o reformę chemii teoretycznej, byli francuscy uczeni C. Gerard (1816–1856) i O. Laurent (1807–1853), którzy stworzyli prawidłowy układ mas atomowych i wzory chemiczne. W 1856 r. rosyjski naukowiec D. I. Mendelejew (1834–1907), a następnie niezależnie od niego włoski chemik S. Cannizzaro (1826–1910) zaproponowali metodę obliczania masy cząsteczkowej związków na podstawie podwójnej gęstości ich par względnych do wodoru. Do roku 1860 metoda ta została przyjęta w chemii, co miało kluczowe znaczenie dla powstania teorii atomowo-molekularnej. W swoim przemówieniu na Międzynarodowym Kongresie Chemików w Karlsruhe (1860) Cannizzaro przekonująco udowodnił słuszność idei Avogadra, Gerarda i Laurenta, potrzebę ich przyjęcia dla prawidłowego wyznaczania mas atomowych i molekularnych oraz składu związki chemiczne. Dzięki pracom Laurenta i Cannizzaro chemicy zrozumieli różnicę między formą, w której pierwiastek istnieje i reaguje (na przykład w przypadku wodoru jest to H 2), a formą, w jakiej jest on obecny w związku (HCl, H2O, NH3 itd.). W rezultacie Kongres przyjął następujące definicje atomu i cząsteczki: cząsteczka – „ilość ciała, która wchodzi w reakcje i określa Właściwości chemiczne"; atom - „najmniejsza ilość pierwiastka zawarta w cząsteczkach (cząsteczkach) związków.” Przyjęto także, że pojęcie „równoważnika” należy traktować jako empiryczne, a nie pokrywające się z pojęciami „atom” i „cząsteczka”.
Masy atomowe ustalone przez S. Cannizzaro posłużyły D. I. Mendelejewowi za podstawę odkrycia okresowego prawa pierwiastków chemicznych. Decyzje kongresu wywarły korzystny wpływ na rozwój chemii organicznej, ponieważ ustalenie wzorów związków otworzyło drogę do powstania chemii strukturalnej.
Tak więc na początku lat 60. XIX w. Doktryna atomowo-molekularna została uformowana w formie następujących postanowień.
1. Substancje składają się z cząsteczek. Cząsteczka to najmniejsza cząsteczka substancji, która ma swoje właściwości chemiczne. Wiele właściwości fizycznych substancji - temperatura wrzenia i topnienia, wytrzymałość mechaniczna, twardość itp. - zależy od zachowania dużej liczby cząsteczek i działania sił międzycząsteczkowych.
2. Cząsteczki składają się z atomów, które są ze sobą połączone w określonych związkach (patrz Cząsteczka; Wiązanie chemiczne; Stechiometria).
3. Atomy i cząsteczki znajdują się w ciągłym, spontanicznym ruchu.
4. Cząsteczki prostych substancji składają się z identycznych atomów (O 2, O 3, P 4, N 2 itp.); cząsteczki substancji złożonych - z różnych atomów (H 2 O, HCl).
6. Właściwości cząsteczek zależą nie tylko od ich składu, ale także od sposobu, w jaki atomy są ze sobą połączone (patrz Teoria budowy chemicznej; Izomeria).
Współczesna nauka rozwinęła klasyczną teorię atomowo-molekularną, a niektóre jej postanowienia zostały zrewidowane.
Ustalono, że atom nie jest niepodzielną formacją bez struktury. Jednak wielu naukowców w ubiegłym stuleciu również się o tym domyślało.
Okazało się, że nie we wszystkich przypadkach cząstki tworzące substancję są cząsteczkami. Wiele związków chemicznych, szczególnie w stanie stałym i ciekłym, ma struktury jonowe, takie jak sole. Niektóre substancje, takie jak gazy szlachetne, składają się z pojedynczych atomów, które słabo oddziałują ze sobą nawet w stanie ciekłym i stałym. Ponadto substancja może składać się z cząstek powstałych w wyniku połączenia (połączenia) kilku cząsteczek. Tak, chemicznie czysta woda tworzone nie tylko przez pojedyncze cząsteczki H 2 O, ale także przez cząsteczki polimeru (H 2 O)n, gdzie n = 2–16; Jednocześnie zawiera uwodnione jony H+ i OH-. Grupa specjalna związki tworzą roztwory koloidalne. I wreszcie, po podgrzaniu do temperatur rzędu tysięcy i milionów stopni, substancja przechodzi w specjalny stan - osocze, który jest mieszaniną atomów, jonów dodatnich, elektronów i jąder atomowych.
Okazało się, że skład ilościowy cząsteczek o tym samym składzie jakościowym może czasami zmieniać się w szerokich granicach (na przykład tlenek azotu może mieć wzór N 2 O, NO, N 2 O 3, NO 2, N 2 O 4, N 2 O 5, NO 3 ), natomiast jeśli weźmiemy pod uwagę nie tylko cząsteczki obojętne, ale także jony molekularne, granice możliwych kompozycji rozszerzają się. Zatem cząsteczka NO 4 jest nieznana, ale niedawno odkryto jon NO 3-4; nie ma cząsteczki CH 5, ale znany jest kation CH + 5 itp.
Odkryto tzw. związki o zmiennym składzie, w których na jednostkę masy danego pierwiastka przypada inna masa innego pierwiastka, np.: Fe 0,89–0,95 O, TiO 0,7–1,3 itd.
Wyjaśniono stanowisko, że cząsteczki składają się z atomów. Według współczesnych koncepcji mechaniki kwantowej (patrz Chemia kwantowa) jedynie rdzeń atomów w cząsteczce pozostaje mniej więcej niezmieniony, czyli rdzeń i wewnętrzne powłoki elektronowe, natomiast charakter ruchu elektronów zewnętrznych (walencyjnych) ulega radykalnym zmianom, tj. że powstaje nowa, molekularna powłoka elektronowa pokrywająca całą cząsteczkę (patrz Wiązanie chemiczne). W tym sensie w cząsteczkach nie ma niezmiennych atomów.
Biorąc pod uwagę te wyjaśnienia i uzupełnienia, należy pamiętać, że współczesna nauka zachowała racjonalne ziarno klasycznej nauki atomowo-molekularnej: idee dotyczące dyskretnej struktury materii, zdolności atomów do wytwarzania poprzez łączenie się ze sobą w pewnym porządku, jakościowo nowe i bardziej złożone formacje oraz o ciągłym ruchu cząstek tworzących materię.
Nauka atomowo-molekularna
Pojęcie materii i ruchu
Współczesna chemia jest jednym z nich nauki przyrodnicze, którego przedmiotem badań jest materia i stanowi system poszczególnych dyscyplin chemicznych - nieorganicznych, analitycznych, fizycznych, organicznych, koloidalnych itp.
Cały różnorodny świat wokół nas, cały zbiór przedmiotów i zjawisk jest zjednoczony ogólna koncepcja- materia, dla której znane są dwie formy istnienia - substancja i pole.
Materia to formacja materialna składająca się z cząstek, które mają własną masę lub masę spoczynkową. Nowoczesna nauka Znane są różne typy układów materialnych i odpowiadające im poziomy strukturalne materii. Należą do nich zarówno cząstki elementarne (elektrony, protony, neutrony itp.), jak i ciała makroskopowe różnej wielkości (układy geologiczne, planety, gwiazdy, gromady gwiazd, Galaktyka, układy galaktyk itp.) Współczesna wiedza o budowie materii poszerza się z 10-14cm zanim 10 28cm(około 13 miliardów lata świetlne).
W odróżnieniu od materii pole jest ośrodkiem materialnym, w którym oddziałują cząstki. Na przykład w polu elektronicznym interakcja zachodzi między naładowanymi cząstkami, a w polu jądrowym interakcja zachodzi między protonami i neutronami.
Uniwersalnymi formami istnienia materii są przestrzeń i czas, które nie istnieją poza materią, tak jak nie mogą istnieć przedmioty materialne, które nie posiadają właściwości czasoprzestrzennych.
Podstawową i integralną właściwością materii jest ruch – sposób jej istnienia. Formy ruchu materii są bardzo różnorodne, są ze sobą powiązane i mogą przemieszczać się między sobą. Na przykład mechaniczna forma ruchu materii może przekształcić się w formę elektryczną, formę elektryczną w formę termiczną itp. Miarą ruchu materii, jej cechą ilościową jest energia.
Definicja chemii
Różne kształty ruchami materii zajmują się różne nauki - fizyka, chemia, biologia itp. Chemia bada chemiczną postać ruchu materii, rozumianą jako jakościowa zmiana substancji, przemiana jednych substancji w inne. W tym przypadku wiązania chemiczne między atomami tworzącymi substancję zostają zerwane, powstają ponownie lub ulegają ponownemu rozmieszczeniu. W wyniku procesów chemicznych powstają nowe substancje o nowych właściwościach fizykochemicznych.
Zatem chemia jest nauką badającą procesy przemian substancji, którym towarzyszą zmiany składu, struktury i właściwości, a także wzajemne przejścia między tymi procesami a innymi formami ruchu materii.
Przedmiotem badań w chemii są pierwiastki chemiczne i ich związki. Badając właściwości substancji i ich przemiany, chemia odkrywa prawa natury, poznaje materię i jej ruch. Studiowanie chemii jako jednej z najważniejszych podstawowych nauk przyrodniczych jest niezbędne do kształtowania naukowego światopoglądu.
Nauka atomowo-molekularna
Nauka atomowo-molekularna została opracowana i po raz pierwszy zastosowana w chemii przez wielkiego rosyjskiego naukowca M.V. Łomonosow. Główne postanowienia jego nauczania zostały określone w pracy „Elementy chemii matematycznej”. Istota nauk M.V. Łomonosow sprowadza się do następujących kwestii.
1. Wszystkie substancje składają się z „cząsteczek” (jak M.V. Łomonosow nazywał cząsteczkami). 2. Cząsteczki składają się z pierwiastków (atomów). 3. Cząstki - cząsteczki i atomy są w ciągłym ruchu. 4. Cząsteczki prostych substancji składają się z identycznych atomów, cząsteczki substancji złożonych - z różnych atomów.
Doktryna ta została później rozwinięta w pracach D. Daltona i J. Berzeliusa. Teoria atomowo-molekularna w chemii została ostatecznie ustalona w połowie XIX wieku. Na Międzynarodowym Kongresie Chemików w Karlsruhe w 1860 roku przyjęto definicje pojęć pierwiastka chemicznego, atomu i cząsteczki.
Atom to najmniejsza cząstka pierwiastka chemicznego, która ma swoje właściwości chemiczne i jest niepodzielna reakcje chemiczne.
Cząsteczka to najmniejsza cząsteczka substancji, która ma swoje właściwości chemiczne. Właściwości chemiczne cząsteczki zależą od jej składu i struktury chemicznej.
Wszystkie substancje dzielą się na proste i złożone.
Prosta substancja składa się z atomów tego samego pierwiastka.
Złożona substancja składa się z atomów różnych pierwiastków. Na przykład tlenek miedzi (II) utworzone przez atomy pierwiastków miedzi i tlenu.
Zaledwie 100 lat temu atom był postrzegany jako niepodzielna jednostka. Jednak zgodnie ze współczesnymi koncepcjami atom ma złożoną budowę i składa się z trzech cząstek subatomowych: protonów, neutronów i elektronów. Protony mają ładunek dodatni; Neutrony nie mają ładunku, ale elektrony tak ładunek ujemny. Ładunki protonu i elektronu są tej samej wielkości. Protony i neutrony zajmują razem bardzo małą objętość atomu, zwaną jądrem. Bardzo Pozostała część objętości atomu to przestrzeń, w której poruszają się elektrony. Ponieważ atomy nie mają ładunku elektrycznego netto, każdy atom zawiera równa liczba elektrony i protony. Ładunek jądra zależy od liczby protonów.
Pierwiastek chemiczny to rodzaj atomów charakteryzujących się tym samym ładunkiem jądrowym i odpowiednio charakteryzującym się pewnym zestawem właściwości. Atomy tego samego pierwiastka, które różnią się liczbą neutronów, a tym samym masą, nazywane są izotopami. Symbol 12 6 C lub po prostu 12 C oznacza atom węgla z sześcioma protonami i sześcioma neutronami. Liczbę protonów w jądrze atomu nazywa się liczbą atomową. Napisany u góry (12) nazywa się liczbą masową i wskazuje całkowitą liczbę protonów i neutronów w jądrze atomu.
Pojęcia „pierwiastek chemiczny” nie można utożsamiać z pojęciem „substancji prostej”. Substancja prosta charakteryzuje się określoną gęstością, rozpuszczalnością, temperaturą topnienia, wrzenia itp. Właściwości te odnoszą się do zbioru atomów i są różne dla różnych substancji prostych.
Pierwiastek chemiczny charakteryzuje się określonym ładunkiem jądrowym, składem izotopowym itp. Właściwości pierwiastka odnoszą się do jego poszczególnych atomów.
Substancje złożone nie składają się z substancji prostych, ale z pierwiastków. Na przykład woda nie składa się z prostych substancji, wodoru i tlenu, ale z pierwiastków, wodoru i tlenu.
Wiele pierwiastków chemicznych tworzy kilka prostych substancji, które różnią się budową i właściwościami. Zjawisko to nazywa się alotropią, a powstałe substancje nazywane są modyfikacjami lub modyfikacjami alotropowymi. Zatem pierwiastek tlen tworzy dwie modyfikacje alotropowe: tlen O 2 i ozon O 3; pierwiastek węgla - trzy: diament, grafit i karabinek.
Chemiczną formę ruchu materii bada się i poznaje poprzez pomiar właściwości fizycznych i wielkości fizycznych właściwych dla każdej substancji. Fizyczny rozmiar to na przykład masa substancji, jej gęstość, temperatura topnienia. W chemii powszechnie stosuje się pojęcia względnej masy atomowej i cząsteczkowej substancji.
Względna masa atomowa. Masy atomów są niezwykle małe. Zatem masa atomu wodoru wynosi 1,674×10 -27 kg, tlen - 2,667×10 -26 kg. W chemii tradycyjnie stosuje się względne, a nie bezwzględne wartości masy. Jednostką masy względnej jest jednostka masy atomowej (w skrócie rano), które reprezentuje 1/12 masa atomu węgla - 12 , tj. izotop węgla 6 C - 1,66×10 -27 kg. Ponieważ większość pierwiastków ma atomy o różnych masach, względna masa atomowa pierwiastka chemicznego jest wielkością bezwymiarową równą stosunkowi średniej masy atomu naturalnego składu izotopowego pierwiastka do 1/12 masa atomu węgla.
Względna masa atomowa pierwiastka jest oznaczona przez A r. Na przykład,
Gdzie 1,993·10 -26 kg– masa atomu węgla.
Względna masa cząsteczkowa. Względne masy cząsteczkowe, podobnie jak masy atomowe, wyrażane są w jednostkach masy atomowej. Względna masa cząsteczkowa substancji jest bezwymiarową wielkością równą stosunkowi średniej masy cząsteczki naturalnego składu izotopowego substancji do 1/12 masa atomu węgla 12 6 C.
Względna masa cząsteczkowa jest oznaczona jako Pan. Jest liczbowo równy sumie względnych mas atomowych wszystkich atomów tworzących cząsteczkę substancji i jest obliczany przy użyciu wzoru substancji. Na przykład, Mr (H 2 O) będzie się składać z 2 A r (N)» 2; ZA r (O) = 1 × 16 = 16; M r (H 2 O) = 2 + 16 = 18.
Mol. W międzynarodowym układzie jednostek (SI) Mol przyjmuje się jako jednostkę ilości substancji. Mol to ilość substancji zawierająca tak wiele substancji strukturalnych lub formułowych (FE) jednostki (cząsteczki, atomy, jony, elektrony i inne), ile jest tam atomów 0,012 kg izotop węgla 12 6 C.
| |
Znając masę jednego atomu węgla 12 C (1,993×10 -26 kg), oblicz liczbę atomów NIE V 0,012 kg węgiel.
Liczba cząstek w 1 mol każda substancja jest taka sama. To jest równe 6,02×10 23 i nazywana jest stałą Avogadra (oznaczoną NIE, wymiar 1/mol Lub mol -1). Jasne, w 2 mole węgiel będzie zawarty 2 × 6,02 × 10 23 atomy, w 3 mole - 3 × 6,02 × 10 23 atomy.
Masa cząsteczkowa. Zwykle jest wyznaczony M. Masa molowa to wartość równa stosunkowi masy substancji do ilości substancji. Ma wymiar kg/mol Lub g/mol. Na przykład, M = m/n Lub M = m/n, Gdzie M- masa w gramach; N(nago) lub N- ilość substancji w molach, M- masa molowa w g/mol- stała wartość dla każdej danej substancji. Jeśli więc masa cząsteczki wody jest równa 2,99×10 -26 kg, a następnie masa molowa M(H2O) = 2,99×10 -26 kg × 6,02×10 23 mol -1 = 0,018 kg/mol Lub 18 g/mol. Ogólnie masa molowa substancji wyrażona w g/mol, jest liczbowo równa względnej masie atomowej lub względnej masie cząsteczkowej tej substancji.
Na przykład względne masy atomowe i molekularne C, O2, H2S odpowiednio równe 12, 32, 34, i ich masy molowe wynoszą odpowiednio 12, 32, 34 g/mol.
Pojęcie i budowa atomu
Jednym z podstawowych pojęć chemii i innych nauk przyrodniczych jest atom. Termin ten ma długie pochodzenie; sięga około 2500 lat. Pojęcie atomu pojawiło się po raz pierwszy w r Starożytna Grecja, około V wieku. pne mi. Założycielami doktryny atomistycznej byli starożytni greccy filozofowie Leucippos i jego uczeń Demokryt. To oni wysunęli ideę dyskretnej struktury materii i wprowadzili termin „ATOM”. Demokryt zdefiniował atom jako najmniejszą, niepodzielną cząstkę materii.
Nauki Demokryta nie upowszechniły się i przez długi okres historyczny w chemii (a w średniowieczu – alchemii) dominowała teoria Arystotelesa (384 – 322 p.n.e.). Według nauk Arystotelesa głównymi zasadami natury są abstrakcyjne „zasady”: zimno, ciepło, suchość i wilgotność, których połączenie tworzy cztery główne „elementy”: ziemię, powietrze, ogień i wodę.
Dopiero na początku XIX wieku angielski naukowiec John Dalton powrócił do atomów jako najmniejszych cząstek materii i wprowadził to określenie do nauki. Poprzedziły to prace tak wybitnych naukowców, jak R. Boyle (w książce „The Skeptical Chemist” zadał miażdżący cios ideom alchemików), J. Priestley i C.W. Scheele (odkrycie tlenu), G. Cavendish (odkrycie wodoru), A. L. Lavoisier (próba sporządzenia pierwszej tabeli prostych substancji), M. V. Łomonosow (podstawowe zasady nauk atomowo-molekularnych, prawo zachowania masy), J. L. Proust (prawo stałości składu ) i wiele innych.
Atom(Grecki ατομος - niepodzielny) to najmniejsza cząstka pierwiastka chemicznego zdolna do samodzielnego istnienia i będąca nośnikiem jego właściwości. Atom jest elektrycznie obojętnym mikroukładem składającym się z dodatnio naładowanego jądra i odpowiedniej liczby elektronów.
Rodzaj atomu zależy od składu jego jądra. Atomy każdego typu są do siebie podobne, ale różnią się od atomów dowolnego innego typu. Zatem atomy węgla, azotu i tlenu mają różną wielkość i różnią się właściwościami fizycznymi i chemicznymi. Jądro składa się z elektronów, protonów i neutronów, zwanych łącznie nukleonami.
Elektron[starożytna greka ηλεκτρον - bursztyn (jest dobrze naelektryzowany przez tarcie)] - stabilna cząstka elementarna o masie spoczynkowej równej 9,109·10 -31 kg = 5,486,10 -4 amu. , i niosący elementarny ładunek ujemny równy 1,6·10 -19 C.
W chemii i fizyce przy rozwiązywaniu wielu problemów przyjmuje się, że ładunek elektronu wynosi -1, a ładunki wszystkich pozostałych cząstek wyrażane są w tych jednostkach. Elektrony są częścią wszystkich atomów.
Proton(Grecki πρωτοσ - po pierwsze) - cząstka elementarna, która jest integralną częścią jąder atomowych wszystkich pierwiastków chemicznych, ma masę spoczynkową Pan= 1,672·10 -27 kg = 1,007 a.m.u. oraz elementarny dodatni ładunek elektryczny równy ładunkowi elektronu, tj. 1,6·10 -19 kl.
Liczba protonów w jądrze określa liczbę atomową pierwiastka chemicznego.
Neutron(łac. neutralny- ani jedno, ani drugie) - elektrycznie obojętna cząstka elementarna o masie spoczynkowej nieco większej niż masa spoczynkowa protonu m n= 1,65·10 -27 kg = 1,009 rano
Wraz z protonem neutron jest częścią wszystkich jąder atomowych (z wyjątkiem jądra izotopu wodoru 1H, które stanowi jeden proton).
Charakterystyka indywidualna cząstki elementarne
| Cząstka elementarna | Przeznaczenie | Waga | Ładunek elektryczny | ||
| w jednostkach SI (kg) | w UAM | w Kl | w ładunkach elektronowych | ||
| Elektron | mi- | 9.109 10 -31 | 5,486·10 -4 | 1,6·10 -19 | -1 |
| Proton | P | 1,672·10 -27 | 1,007 | 1,6·10 -19 | 1 |
| Neutron | N | 1,675·10 -27 | 1,009 | 0 | 0 |
Ogólna (grupowa) nazwa protonów i neutronów to nukleony.
Pojęcie i formy istnienia pierwiastka chemicznego
Pierwiastek chemiczny- rodzaj atomów o tym samym ładunku jądrowym.
Pierwiastek chemiczny jest pojęciem, a nie cząstką materialną. To nie jest atom, ale zbiór atomów charakteryzujący się pewną cechą - tym samym ładunkiem jądrowym.
Atomy pierwiastka mogą mieć różną liczbę neutronów w jądrze, a co za tym idzie, różne masy.
Liczba masowa - Łączna nukleony (protony i neutrony) w jądrze.
Jądro atomu składa się z protonów, których liczba jest równa liczbie atomowej pierwiastka (Z) i neutrony (N). A = Z + N, Gdzie A- Liczba masowa.
Nuklidy(łac. jądro- rdzeń) - Nazwa zwyczajowa jądra atomowe charakteryzują się określoną liczbą protonów i neutronów (ilość ładunku dodatniego i liczba masowa).
Aby wskazać pierwiastek chemiczny, wystarczy podać tylko jedną wielkość - ładunek jądra, tj. numer seryjny pierwiastka w układzie okresowym. Aby określić nuklid, to nie wystarczy - należy podać także jego liczbę masową.
Czasami, nie do końca dokładnie, pojęcie „nuklidu” odnosi się nie do samego jądra, ale do całego atomu.
Izotopy(Grecki ισος - identyczny + τοπος - miejsce) - nuklidy, które mają tę samą liczbę protonów, ale różnią się liczbą masową.
Izotopy to nuklidy zajmujące to samo miejsce w układzie okresowym, to znaczy atomy tego samego pierwiastka chemicznego.
Na przykład: 11 22 Nie, 11 23 Nie, 11 24 Nie.
Izobary(Grecki ιςο - równy + βαροσ - masa) - nuklidy, które mają tę samą liczbę masową, ale różną liczbę protonów (tj. są związane z różnymi pierwiastkami chemicznymi).
Na przykład: 90 seniorów, 90 lat, 90 zr.
Izotony- nuklidy o tej samej liczbie neutronów.
Kiedy atomy oddziałują chemicznie, powstają cząsteczki.
Cząsteczka(zdrobnienie od łac. mole- masa) to najmniejsza cząsteczka substancji, która określa jej właściwości. Składa się z atomów jednego lub różnych pierwiastków chemicznych i istnieje jako jeden system jądra atomowe i elektrony. W przypadku cząsteczek jednoatomowych (na przykład gazów szlachetnych) pojęcia atomu i cząsteczki są takie same.
Cząsteczki są jednoatomowe (na przykład cząsteczki helu Nie), dwuatomowy (azot N 2, tlenek węgla WSPÓŁ), wieloatomowy (woda H2O, benzen C 6 H 6) i polimerowe (zawierające do setek tysięcy lub więcej atomów - cząsteczki metali w stanie zwartym, białka, kwarc).
Atomy są utrzymywane w cząsteczce za pomocą wiązań chemicznych.
W chemii oprócz atomów i cząsteczek musimy wziąć pod uwagę inne jednostki strukturalne: jony i rodniki.
Jony(Grecki ιον - chodzenie) - cząstki naładowane elektrycznie powstałe z atomów (lub grup atomowych) w wyniku dodania lub utraty elektronów.
Nazywa się jony naładowane dodatnio kationy(Grecki κατα dół + jon), naładowany ujemnie - aniony(Grecki ανα - góra + jon).
Na przykład: K+- kation potasu, Fe2+- kation żelaza, NH4+- kation amonowy, Cl - - anion chlorowy (anion chlorkowy), S 2-- anion siarkowy (anion siarczkowy), SO 4 2-- anion siarczanowy.
Radykałowie(łac. radykalny- rodnik) - cząstki (atomy lub grupy atomów) z niesparowanymi elektronami.
Są wysoce reaktywne.
Na przykład: N- rodnik wodorowy, C1- rodnik chloru, CH 3- rodnik metylowy.
Jednocześnie cząsteczki paramagnetyczne, np. O 2, NIE, NIE 2 posiadające niesparowane elektrony nie są rodnikami.
Prosta substancja- substancja składająca się z atomów jednego pierwiastka chemicznego.
Substancja prosta jest formą istnienia pierwiastka chemicznego. Wiele pierwiastków może występować w postaci kilku prostych substancji, np. węgla (grafit, diament, karbyn, fulereny), fosforu (biały, czerwony, czarny), tlenu (ozon, tlen).
Znanych jest około 400 prostych substancji.
Alotropia(Grecki αλλοσ - inne + τροπε - rotacja) - zdolność pierwiastka chemicznego do istnienia w postaci dwóch lub więcej prostych substancji różniących się liczbą atomów w cząsteczce (na przykład O 2 I O 3) lub różne struktury krystaliczne (grafit i diament).
Wielopostaciowość(Grecki πολιμορφοσ - różnorodne) - umiejętności ciała stałe istnieją w dwóch lub większej liczbie postaci o różnych strukturach krystalicznych i różnych właściwościach. Takie formy nazywane są modyfikacjami polimorficznymi.
Na przykład: FeS 2 może tworzyć dwie substancje o różnych strukturach krystalicznych (polimorfach): jedna nazywa się pirytem, a druga markasytem. Czy te substancje są modyfikacjami alotropowymi? Oni nie są.
Alotropia dotyczy tylko prostych substancji i uwzględnia zarówno różnicę w składzie ich cząsteczek, jak i różnicę w strukturze sieci krystalicznych. Jeśli mówimy o różnicach w budowie sieci krystalicznych prostych substancji, to pojęcia polimorfizmu i alotropii pokrywają się, na przykład o graficie i diamencie możemy powiedzieć, że są to formy alotropowe lub możemy powiedzieć, że są to formy polimorficzne .
1.Chemia jako przedmiot nauk przyrodniczych Studia chemiczne ta forma ruchu materii, w której zachodzi interakcja atomów z tworzeniem nowych określonych substancji. Chemia-nauka o strukturze, strukturze i właściwości substancji, ich przemiany lub zjawiska towarzyszące tym przemianom. Współczesna chemia obejmuje: ogólna, organiczna, koloidalna, analityczna, fizyczna, geologiczna, biochemia, chemia materiałów budowlanych. Przedmiot chemii- pierwiastki chemiczne i ich związki oraz prawa rządzące różnymi reakcjami chemicznymi. łączy nauki fizyko-matematyczne i biologiczno-społeczne.
2.Klasa związki nieorganiczne. Podstawowe właściwości chemiczne kwasów, zasad, soli. Zgodnie z właściwościami związków nieorganicznych są podzielone na ślady. Zajęcia: tlenki, zasady, kwasy, sole. Tlenki- połączenie pierwiastków z tlenem, w którym ten ostatni jest pierwiastkiem bardziej elektroujemnym, czyli wykazuje stopień utlenienia -2. i podłączony jest tylko element O2.Ogólny wzór to CxOy. Tam są:kwaśny e-zdolny do tworzenia soli z zasadowymi tlenkami i zasadami (SO3+Na2O=Na2SO4; So3+2NaOH=Na2SO4=H2O), główny- zdolny do tworzenia soli z kwaśnymi tlenkami i kwasami (CaO+CO2=CaCO3; CaO+2HCl=CaCl2+H2O ), amfoteryczny(do Ciebie i podstawy) i z tym i z tamtym (ZnO, BeO, Cr2O3, SnO, PbO, MnO2). i nie tworzący soli(CO, NO, N2O) Teren - substancje, podczas których dysocjacja elektrolityczna może spowodować anion tylko grupa hydroksylowa OH. Kwasowość zasady to liczba jonów OH powstałych podczas dysocjacji wodorotlenku. Wodorotlenki to substancje zawierające grupę OH, powstałe w wyniku połączenia tlenków z wodą 3 typy: podstawowy(podstawy)kwaśny(kwasy zawierające tlen) iamfoteryczny(amfolity - wykazują właściwości zasadowe i kwasowe Cr(OH)3,Zn(OH)2,Be(OH)2,Al(OH)3) Kwasy-substancje podczas dysocjacji elektrolitycznej kat. Kation m.b. tylko + naładowany jon H. Wyróżnia się: beztlenowe, zawierające tlen Liczba H oznacza zasadowość kwasu. formy meta i orto cząsteczek wody. Sole-substancje, podczas dysocjacji elektrolitycznej, których kationem może być jon amonowy (NH4) lub jon metalu, a anionem może być dowolna reszta kwasowa Są: średnie(całkowite podstawienie. składa się z reszty kwasowej i jonu metalu), kwaśny e (niepełne podstawienie. obecność niepodstawionego H), zasadowe (niepełne podstawienie. obecność niepodstawionego OH) Według składu substancje nieorganiczne Są podzielone na dwójkowy– składający się tylko z dwóch elementów, i wieloelementowy– składający się z kilku elementów.
3. Podstawowe założenia nauczania atomowo-molekularnego
1. Wszystkie substancje składają się z cząsteczek (cząsteczek): podczas zjawisk fizycznych cząsteczki są zachowywane, ale podczas zjawisk chemicznych ulegają zniszczeniu.
2. Cząsteczki składają się z atomów (pierwiastków), podczas reakcji chemicznych atomy zostają zachowane.
3. Atomy każdego typu (pierwiastka) są ze sobą identyczne, ale różnią się od atomów dowolnego innego typu.
4. Kiedy atomy oddziałują, powstają cząsteczki: homojądrowe (kiedy oddziałują atomy jednego pierwiastka) lub heterojądrowe (kiedy oddziałują atomy różnych pierwiastków).
5. Reakcje chemiczne polegają na tworzeniu nowych substancji z tych samych atomów, które tworzą pierwotne substancje + 6. cząsteczki. a atomy są w ciągłym ruchu, a ciepło polega na wewnętrznym ruchu tych cząstek
. Atom- najmniejsza cząstka pierwiastka, która zachowuje swoje właściwości chemiczne. Atomy różnią się ładunkami jądrowymi, masą i rozmiarem
Pierwiastek chemiczny- rodzaj atomów o tej samej pozycji. Opłata za rdzeń. Właściwości fizyczne, charakterystyczne dla prostej substancji, nie można przypisać pierwiastkowi chemicznemu. Proste substancje- są to substancje składające się z atomów tego samego pierwiastka chemicznego. 4.Podstawowe prawa chemii (prawo zachowania, stałość składu, stosunki wielokrotne, prawo Avagadro) Prawo konserwatorskie: Masa substancji, które reagują, jest równa masie substancji powstałych w wyniku reakcji. Prawo stałości składu : (każdy związek chemiczny ma ten sam skład ilościowy, niezależnie od sposobu jego przygotowania) Stosunki mas pierwiastków wchodzących w skład danego związku są stałe i nie zależą od sposobu otrzymania tego związku.
Prawo wielokrotności : Jeżeli dwa pierwiastki tworzą ze sobą kilka związków chemicznych, wówczas masy jednego z pierwiastków w tych związkach przypadające na tę samą masę drugiego pierwiastka odnoszą się do siebie jako małe liczby całkowite.
Prawo Avogadra. Równe objętości dowolnych gazów pobranych w tej samej temperaturze i pod tym samym ciśnieniem zawierają tę samą liczbę cząsteczek.
5. Prawo równoważności . Odpowiednik substancji- jest to ilość substancji, która oddziałuje z 1 molem atomu wodoru lub wypiera tę samą liczbę atomów H w substancji chemicznej. Reakcje. Ve (L/Mol) to równoważna objętość substancji, to znaczy objętość jednego równoważnika substancji w stanie gazowym PRAWO: Wszystkie substancje reagują w reakcjach chemicznych i powstają w równoważnych ilościach. Stosunek równoważnych mas, objętości, reagujących lub tworzących się substancji jest wprost proporcjonalny do stosunku ich mas (objętości) lub E (prosty) = A (masa atomowa) / B (wartościowość pierwiastka) E (kwasy) = M ( masa molowa) / zasadowy (kwas zasada) E(wodorotlenek)=M/kwas)Kwasowość wodorotlenku) E(tlenki soli) = M/a (liczba atomów pierwiastka w próbce. Tlenki (sole) * in (wartościowość tego pierwiastka lub metalu)
6. Budowa atomów. Rdzeń. Reakcje jądrowe. Rodzaje promieniowania. Model Rutherforda: 1.prawie cała masa jest skupiona w jądrze 2.+ są kompensowane – 3.ładunek jest równy liczbie grup. Najprostszy to wodór H Nowoczesne pojęcie chemii. Element to rodzaj atomu o tej samej pozycji. Według ładunku jądrowego atom składa się z dodatnio naładowanego jądra i powłoki elektronowej. Powłokę elektronową tworzą elektrony. Liczba elektronów jest równa liczbie protonów, zatem ładunek atomu jako całości wynosi 0. Liczba protonów, ładunek jądra i liczba elektronów są liczbowo równe liczbie atomowej pierwiastka chemicznego . Prawie cała masa atomu skupia się w jądrze. Elektrony poruszają się po jądrze atomu nie losowo, ale w zależności od posiadanej energii, tworząc tzw. warstwę elektronową. Każda warstwa elektronowa może zawierać określoną liczbę elektronów: na pierwszej - nie więcej niż 2, na drugiej - nie więcej niż 8, na trzeciej - nie więcej niż 18. Liczbę warstw elektronicznych określa się na podstawie numeru okresu. Liczba elektronów na ostatniej (zewnętrznej) warstwie jest określona przez numer grupy.w tym okresie następuje stopniowe osłabienie właściwości metalicznych i wzrost właściwości niemetali Reakcja jądrowa to proces powstawania nowych jąder lub cząstek podczas zderzeń jąder lub cząstek. Radioaktywność zwane spontaniczną przemianą niestabilnego izotopu jednego pierwiastka chemicznego w izotop innego pierwiastka, której towarzyszy emisja cząstek elementarnych lub jąder.Rodzaje promieniowania: alfa, beta (ujemne i dodatnie) oraz gamma. Cząstka alfa jest jądrem atomu helu 4/2He. Kiedy emitowane są cząstki alfa, jądro traci dwa protony i dwa neutrony, w związku z czym ładunek zmniejsza się o 2, a liczba masowa o 4. Ujemną cząstką beta jest elektron. Kiedy emitowany jest elektron, ładunek jądrowy wzrasta o jeden, ale liczba masowa się nie zmienia. Jeżeli niestabilny izotop zostanie tak wzbudzony, że emisja cząstki nie doprowadzi do całkowitego usunięcia wzbudzenia, wówczas emituje część czystej energii zwanej promieniowaniem gamma. Atomy o tym samym ładunku jądrowym, ale różnych liczbach masowych nazywane są izotopami (na przykład 35/17 Cl i 37/17 Cl) Atomy o tych samych liczbach masowych, ale inny numer protony w jądrze nazywane są izobarami (na przykład 40/19K i 40/20Ca) Okres półtrwania (T ½) to czas, w którym rozpada się połowa pierwotnej ilości izotopu promieniotwórczego.