Do cytowania: Schwartz G.Ya. Niedobór witaminy D i jego korekta farmakologiczna // BC. 2009. Nr 7. S. 477
Naruszenie tworzenia się hormonów i ich niedobór są ważnymi przyczynami wielu chorób człowieka. Niedobór jednego z nich – hormonu D (powszechniej określanego jako niedobór witaminy D), który ma szeroki zakres właściwości biologicznych i bierze udział w regulacji wielu ważnych funkcji fizjologicznych, ma również negatywne konsekwencje i leży u podstaw wielu rodzajów stanów i chorób patologicznych. Poniżej rozważamy zarówno cechy charakterystyczne witaminy D, jej niedobór, rolę tej ostatniej w powstawaniu i rozwoju wielu powszechnych chorób, jak i współczesne możliwości farmakologicznej korekcji stanów niedoboru D.
Charakterystyka witaminy D, hormonu D i układu hormonalnego D
Termin „witamina D” łączy w sobie grupę o podobnej budowie chemicznej (sekosteroidy) oraz kilka form witaminy D, które występują w przyrodzie:
- witamina D1 (tak nazywała się substancja odkryta w 1913 roku przez E.V. McColluma w oleju z wątroby dorsza, która jest związkiem ergokalcyferolu i lumisterolu w stosunku 1:1);
- Witamina D2 – ergokalcyferol, powstający z ergosterolu pod wpływem światła słonecznego, głównie w roślinach; reprezentuje, wraz z witaminą D3, jedną z dwóch najczęstszych naturalnych form witaminy D;
- Witamina D3 – cholekalcyferol, powstający w organizmie zwierząt i ludzi pod wpływem światła słonecznego z 7-dehydrocholesterolu; to on jest uważany za „prawdziwą” witaminę D, podczas gdy inni przedstawiciele tej grupy uważają zmodyfikowane pochodne witaminy D;
- Witamina D4 - dihydrotachysterol lub 22,23-dihydroergokalcyferol;
- Witamina D5 - sitokalcyferol (utworzony z 7-dehydrositosterolu).
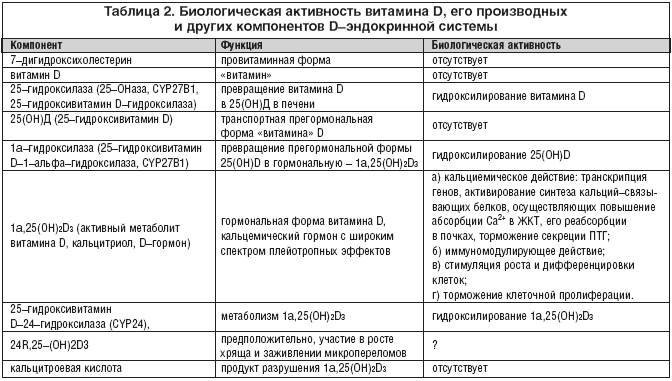
Witamina D jest tradycyjnie klasyfikowana jako witamina rozpuszczalna w tłuszczach. Jednak w przeciwieństwie do wszystkich innych witamin, witamina D nie jest właściwie witaminą w klasycznym znaczeniu tego terminu, ponieważ: a) nie jest biologicznie aktywna; b) na skutek dwuetapowego metabolizmu w organizmie przybiera postać aktywno - hormonalną oraz c) ma zróżnicowane działanie biologiczne dzięki oddziaływaniu ze specyficznymi receptorami zlokalizowanymi w jądrach komórkowych wielu tkanek i narządów. Pod tym względem aktywny metabolit witaminy D zachowuje się jak prawdziwy hormon, stąd nazwa D-hormon. Jednocześnie, zgodnie z tradycją historyczną, w literaturze naukowej nazywana jest witaminą D.
Witamina D2 dostaje się do organizmu człowieka w stosunkowo niewielkich ilościach – nie więcej niż 20-30% zapotrzebowania. Jej głównymi dostawcami są produkty zbożowe, olej rybny, masło, margaryna, mleko, żółtko jaj itp. (tab. 1). Witamina D2 jest metabolizowana z wytworzeniem pochodnych, które mają działanie podobne do metabolitów witaminy D3.
Druga naturalna forma witaminy D – witamina D3, czyli cholekalcyferol, jest najbliższym analogiem witaminy D2, który jest w niewielkim stopniu uzależniony od spożycia z zewnątrz. Cholekalcyferol powstaje w organizmie kręgowców, w tym płazów, gadów, ptaków i ssaków, przez co odgrywa znacznie większą rolę w procesach życiowych człowieka niż witamina D2 dostarczana w niewielkich ilościach z pożywieniem. W organizmie witamina D3 powstaje z prekursora znajdującego się w warstwie skóry właściwej - prowitaminy D3 (7-dehydrocholesterol) pod wpływem krótkofalowego promieniowania ultrafioletowego z widmem B (UV-B/światło słoneczne, długość fali 290-315 nm ) w temperaturze ciała w wyniku fotochemicznej reakcji otwarcia pierścieni rdzenia steroidowego oraz charakterystycznej dla sekosteroidów izomeryzacji termicznej.
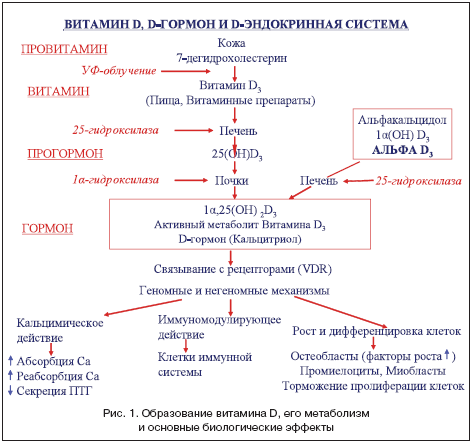
Witamina D (dostarczana z pożywieniem lub powstająca w organizmie w procesie endogennej syntezy) w wyniku dwóch następujących po sobie reakcji hydroksylacji biologicznie nieaktywnych form prehormonalnych przekształca się w aktywne formy hormonalne: najważniejszą, istotną jakościowo i ilościowo – 1a, 25-dihydroksywitamina D3 (1a,25(OH)2D3; zwana również D-hormonem, kalcytriolem) i drugorzędna - 24.25(OH)2D3 (ryc. 1).
Poziom powstawania hormonu D w ciele dorosłej zdrowej osoby wynosi około 0,3-1,0 mcg/dobę. Pierwsza reakcja hydroksylacji zachodzi głównie w wątrobie (do 90%) i około 10% - pozawątrobowa z udziałem enzymu mikrosomalnego 25-hydroksylazy z utworzeniem pośredniej biologicznie nieaktywnej formy transportowej - 25(OH)D ( kalcydol).
Hydroksylacja witaminy D3 w wątrobie nie podlega pozawątrobowym wpływom regulacyjnym i jest procesem całkowicie zależnym od substratów. Reakcja 25-hydroksylacji przebiega bardzo szybko i prowadzi do wzrostu poziomu 25(OH)D w surowicy krwi. Poziom tej substancji odzwierciedla zarówno powstawanie witaminy D w skórze, jak i jej przyjmowanie z pożywieniem, dlatego może być wykorzystany jako marker statusu witaminy D. Transportowa forma 25(OH)D częściowo wnika do tkanki tłuszczowej i mięśniowej, gdzie może tworzyć magazyn tkanek o nieskończonej żywotności. Kolejna reakcja 1a-hydroksylacji 25(OH)D zachodzi głównie w komórkach kanalików proksymalnych kory nerkowej przy udziale enzymu 1a-hydroksylazy (25-hydroksywitamina D-1-a-hydroksylaza, CYP27B1). W mniejszej objętości niż w nerkach, 1a-hydroksylacja jest również przeprowadzana przez komórki układu limfohemopoetycznego, w tkance kostnej oraz, jak ostatnio ustalono, przez komórki niektórych innych tkanek zawierających zarówno 25(OH)D, jak i 1a -hydroksylaza. Zarówno 25-hydroksylaza (CYP27B1 i jej inne izoformy), jak i 1a-hydroksylaza są klasycznymi oksydazami mitochondrialnymi i mikrosomalnymi o mieszanych funkcjach i biorą udział w przenoszeniu elektronów z NADP przez flawoproteiny i ferrodoksynę do cytochromu P450. Powstawanie 1,25-dihydroksywitaminy D3 w nerkach jest ściśle regulowane przez szereg czynników endogennych i egzogennych.
W szczególności regulacja syntezy 1a,25(OH)2D3 w nerkach jest bezpośrednią funkcją parathormonu (PTH), którego na stężenie we krwi z kolei wpływa mechanizm sprzężenia zwrotnego zarówno na poziomie najbardziej aktywny metabolit witaminy D3 oraz stężenie wapnia i fosforu w osoczu krwi. Ponadto aktywujący wpływ na 1a-hydroksylazę i proces 1a-hydroksylacji mają inne czynniki, w tym hormony płciowe (estrogeny i androgeny), kalcytonina, prolaktyna, hormon wzrostu (poprzez IPFR-1) itp.; Inhibitory 1a-hydroksylazy to 1a,25(OH)2D3 oraz szereg jego syntetycznych analogów, hormony glikokortykosteroidowe (GCS) itp. Wydzielany w komórkach kostnych czynnik wzrostu fibroblastów (FGF23) powoduje powstawanie kotransportera sodowo-fosforanowego, który działa w komórkach nerek i jelita cienkiego, działa hamująco na syntezę 1,25-dihydroksywitaminy D3. Na metabolizm witaminy D mają również wpływ niektóre leki (np. leki przeciwpadaczkowe).
1α,25-dihydroksywitamina D3 zwiększa ekspresję 25-hydroksywitaminy D-24-hydroksylazy (24-OHaza) - enzymu katalizującego jej dalszy metabolizm, co prowadzi do powstania rozpuszczalnego w wodzie, nieaktywnego biologicznie kwasu kalcytroowego, który jest wydalany w żółć.
Wszystkie wymienione składniki metabolizmu witaminy D, a także jądrowe receptory tkankowe dla 1α,25-dihydroksywitaminy D3 (hormonu D), zwane receptorami witaminy D (RVD), są połączone w układ hormonalny witaminy D, którego funkcje to zdolność do generowania reakcji biologicznych w ponad 40 tkankach docelowych dzięki regulacji transkrypcji genów przez PBD (mechanizm genomowy) oraz szybkim reakcjom pozagenomowym realizowanym poprzez interakcję z PBD zlokalizowanymi na powierzchni wielu komórek. Dzięki mechanizmom genomowym i pozagenomowym układ D-endokrynny realizuje reakcje utrzymywania homeostazy mineralnej (przede wszystkim w ramach gospodarki wapniowo-fosforowej), koncentracji elektrolitów i wymiany energii. Ponadto bierze udział w utrzymaniu odpowiedniej gęstości mineralnej kości, metabolizmie lipidów, regulacji ciśnienia krwi, porostu włosów, stymulacji różnicowania komórek, zahamowaniu proliferacji komórek oraz realizacji reakcji immunologicznych (działanie immunosupresyjne).
Jednak tylko sam hormon D i enzymy hydroksylujące są aktywnymi składnikami układu D-endokrynologicznego (tab. 2).
Najważniejszymi reakcjami, w których uczestniczy 1α,25(OH)2D3 jako hormon kalcemiczny, są wchłanianie wapnia w przewodzie pokarmowym oraz jego reabsorpcja w nerkach. Hormon D wzmaga jelitowe wchłanianie wapnia w jelicie cienkim poprzez interakcję ze specyficznym RBD – reprezentującym kompleks receptorów X kwasu retinowego (RBD-CRC), prowadzący do ekspresji kanałów wapniowych w nabłonku jelitowym. Te przejściowe (tj. nietrwałe) bramkowane napięciem kanały kationowe należą do szóstego członka podrodziny V (TRPV6). W enterocytach jelitowych aktywacji RVD towarzyszy efekt anaboliczny - wzrost syntezy kalbidyny 9K, białka wiążącego wapń (CaBP), które przedostaje się do światła jelita, wiąże Ca2+ i transportuje go przez ścianę jelita do naczyń limfatycznych, a następnie do układu naczyniowego. O skuteczności tego mechanizmu świadczy fakt, że bez udziału witaminy D w jelicie wchłaniane jest tylko 10–15% wapnia z diety i 60% fosforu. Oddziaływanie 1α,25-dihydroksywitaminy D3 z PBD zwiększa efektywność jelitowego wchłaniania Ca2+ nawet o 30-40%, tj. 2-4 razy i fosfor - do 80%. Podobne mechanizmy działania hormonu D leżą u podstaw reabsorpcji Ca2+ w nerkach pod jego wpływem.
W kościach 1α,25(OH)2D3 wiąże się z receptorami na komórkach kościotwórczych, osteoblastach (OB), powodując w nich zwiększenie ekspresji liganda receptora aktywatora czynnika jądrowego kB (RANKL). Receptor aktywatora jądrowego czynnika kB (RANK), który jest zlokalizowanym w preosteoklastach receptorem RANKL (preOK), wiąże RANKL, co powoduje szybkie dojrzewanie preOK i ich transformację w dojrzałą TK. W procesach przebudowy kości dojrzałe OC resorbują kość, czemu towarzyszy uwalnianie wapnia i fosforu ze składnika mineralnego (hydroksyapatytu) oraz utrzymuje poziom wapnia i fosforu we krwi. Z kolei odpowiedni poziom wapnia (Ca2+) i fosforu (w postaci fosforanu (HPO42–) jest niezbędny do prawidłowej mineralizacji kośćca.
Niedobór D
W warunkach fizjologicznych zapotrzebowanie na witaminę D waha się od 200 IU (u dorosłych) do 400 IU (u dzieci) na dzień. Uważa się, że krótkotrwała ekspozycja twarzy i gołych rąk na słońce (10–30 min.) odpowiada około 200 IU witaminy D, podczas gdy wielokrotna ekspozycja na słońce nago z umiarkowanym rumieniem skóry powoduje wzrost 25 ( Poziomy OH)D, wyższe niż obserwowane przy wielokrotnym podawaniu w dawce 10 000 IU (250 mcg) dziennie.
Chociaż nie ma zgody co do optymalnego poziomu 25(OH)D mierzonego w surowicy, większość ekspertów uważa, że niedobór witaminy D (VDD) występuje, gdy 25(OH)D jest poniżej 20 ng/ml (tj. poniżej 50 nmol). /l). Poziom 25(OH)D jest odwrotnie proporcjonalny do poziomu PTH w zakresie, w którym poziom tego ostatniego (PTH) osiąga przedział od 30 do 40 ng/ml (czyli od 75 do 100 nmol/l), przy wskazanych wartości, stężenie PTH zaczyna spadać (od maksimum). Ponadto transport jelitowy Ca2+ był zwiększony nawet o 45–65% u kobiet, gdy poziom 25(OH)D wzrósł średnio z 20 do 32 ng/mL (50 do 80 nmol/L). Na podstawie tych danych poziom 25(OH)D wynoszący od 21 do 29 ng/ml (tj. od 52 do 72 nmol/l) można uznać za wskaźnik względnego niedoboru witaminy D, a poziom 30 ng/ml i powyżej jest wystarczające (tj. blisko normy). Toksyczność witaminy D występuje, gdy poziom 25(OH)D jest wyższy niż 150 ng/mL (374 nmol/L).
Korzystając z wyników oznaczeń 25(OH)D uzyskanych w licznych badaniach i ich ekstrapolacji, można stwierdzić, że według dostępnych obliczeń około 1 miliarda ludzi na Ziemi ma VDD lub niedobór witaminy D, co odzwierciedla zarówno demograficzne (starzenie się populacji). ) i środowiskowe (zmiany klimatyczne, zmniejszenie nasłonecznienia) zachodzące na planecie w ostatnich latach. Według kilku badań, od 40 do 100% osób starszych w Stanach Zjednoczonych i Europie żyjących w normalnych warunkach (nie w domach opieki) cierpi na VDD. Ponad 50% kobiet po menopauzie przyjmujących leki w leczeniu OP ma suboptymalny (niewystarczający) poziom 25(OH)D, tj. poniżej 30 ng/ml (75 nmol/l).
Znaczna liczba dzieci i młodych dorosłych również jest narażona na potencjalne ryzyko VDD. Na przykład, 52% nastolatków pochodzenia latynoskiego i czarnego (Afroamerykanie) w badaniu Boston (USA) i 48% nastoletnich dziewcząt rasy białej w badaniu Maine (USA) miało poziom 25(OH)D poniżej 20 ng/ ml. W innych badaniach późną zimą 42% amerykańskich dziewcząt i kobiet rasy czarnej w wieku od 15 do 49 lat miało poziom 25(OH)D poniżej 20 ng/ml, a 32% zdrowych studentów i lekarzy w szpitalu Boston VDD wykryto VDD pomimo ich dziennego spożycia. 1 szklanki mleka i preparatów multiwitaminowych, a także włączenie łososia do diety co najmniej 1 raz w tygodniu.
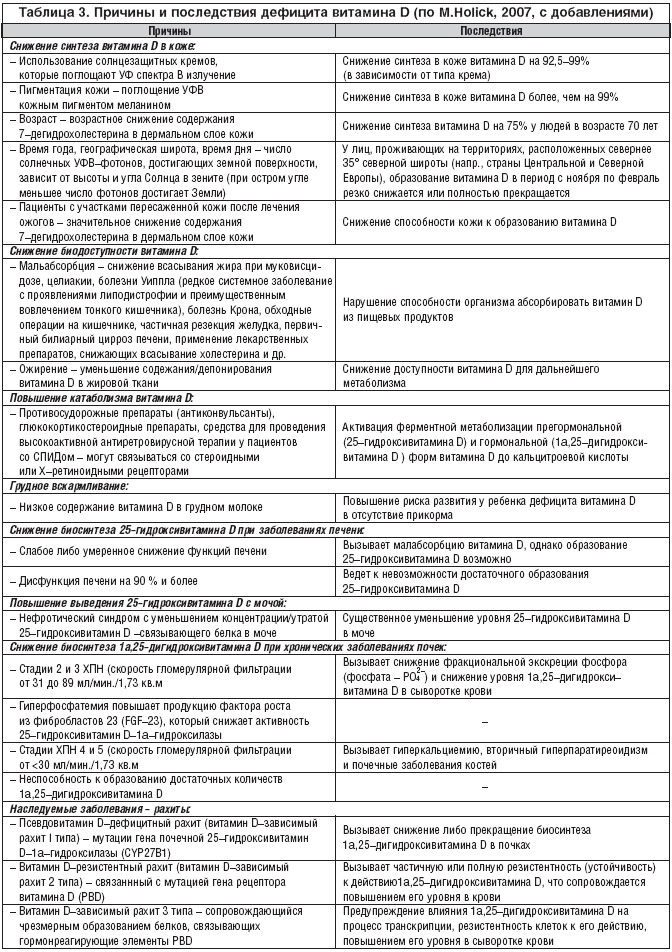
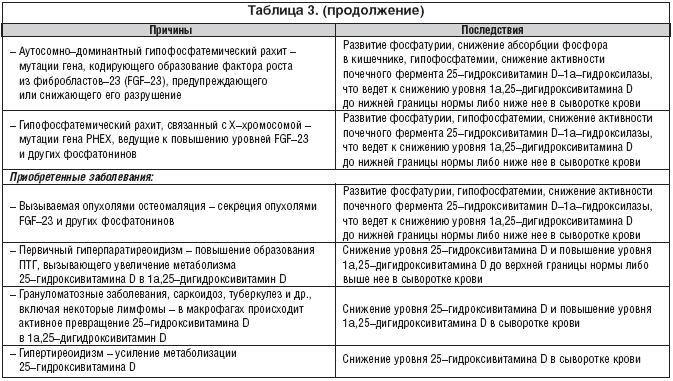
W Europie, gdzie bardzo rzadkie produkty spożywcze są sztucznie wzbogacane witaminą D, dzieci i dorośli są szczególnie narażeni na VDD. Osoby mieszkające w rejonie równikowym o wysokim poziomie naturalnego nasłonecznienia mają poziom 25(OH)D zbliżony do normy - powyżej 30 ng/ml. Jednak w najbardziej słonecznych regionach Ziemi DDD nie jest rzadkością z powodu noszenia odzieży na całe ciało. W badaniach przeprowadzonych w Arabii Saudyjskiej, Zjednoczonych Emiratach Arabskich, Australii, Turcji, Indiach i Libanie 30 do 50% dzieci i dorosłych ma poziom 25(OH)D poniżej 20 ng/ml. Tabela 3 podsumowuje główne przyczyny i konsekwencje VDD.
Niedobór hormonu D (często reprezentowany przez hipowitaminozę D lub niedobór witaminy D, ponieważ w przeciwieństwie do dramatycznego spadku poziomu estrogenów po menopauzie, termin ten odnosi się głównie do obniżenia poziomu tworzenia w organizmie 25 (OH) D i 1a,25(OH)2D3), a także zaburzenia jego odbioru odgrywają istotną rolę w patogenezie nie tylko chorób układu kostnego (krzywica, osteomalacja, osteoporoza), ale także znacznej liczby powszechnych chorób pozaszkieletowych (patologia układu sercowo-naczyniowego, nowotwory, choroby autoimmunologiczne itp.).
Istnieją dwa główne rodzaje niedoboru hormonu D, czasami nazywane również „zespołem niedoboru D”. Pierwsza z nich wynika z niedoboru/niedoboru witaminy D3 – naturalnej formy prohormonalnej, z której powstaje aktywny (e) metabolit(y). Ten rodzaj niedoboru witaminy D wiąże się z niedostateczną ekspozycją na słońce, a także niedostatecznym przyjmowaniem tej witaminy z pożywienia, ciągłym noszeniem odzieży zakrywającej ciało, co ogranicza tworzenie się naturalnej witaminy w skórze i prowadzi do spadek poziomu 25 (OH) D w surowicy krwi. Podobną sytuację zaobserwowano wcześniej, głównie u dzieci, i była ona de facto synonimem krzywicy. Obecnie w większości uprzemysłowionych krajów świata, ze względu na sztuczne wzbogacanie żywności dla niemowląt witaminą D, jej niedobór/niedobór u dzieci występuje stosunkowo rzadko. Jednak ze względu na sytuację demograficzną, która zmieniła się w drugiej połowie XX wieku, niedobór witaminy D często występuje u osób starszych, zwłaszcza żyjących w krajach i terytoriach o niskim naturalnym nasłonecznieniu (północ lub południe od 40° długości geograficznej północnej i północnej). Półkule południowe), które mają nieodpowiednią lub niezbilansowaną dietę i niską aktywność fizyczną. Wykazano, że u osób w wieku 65 lat i starszych następuje 4-krotny spadek zdolności do tworzenia witaminy D w skórze. Ze względu na fakt, że 25(OH)D jest substratem dla enzymu 1a-hydroksylazy, a szybkość jego przemiany w aktywny metabolit jest proporcjonalna do poziomu substratu w surowicy krwi, spadek tego wskaźnika<30 нг/мл нарушает образование адекватных количеств 1a,25(ОН)2D3. Именно такой уровень снижения 25(ОН)D в сыворотке крови был выявлен у 36% мужчин и 47% женщин пожилого возраста в ходе исследования (Euronut Seneca Program), проведенного в 11 странах Западной Европы. И хотя нижний предел концентрации 25(ОН)D в сыворотке крови, необходимый для поддержания нормального уровня образования 1a,25(ОН)2D3, неизвестен, его пороговые значения, по–видимому, составляют от 12 до 15 нг/мл (30–35 нмол/л).
Wraz z powyższymi danymi w ostatnich latach pojawiły się dokładniejsze ilościowe kryteria niedoboru D. Według autorów hipowitaminozę D definiuje się jako poziom 25(OH)D w surowicy 100 nmol/l (40 ng/ml), niedobór witaminy D 50 nmol/l, a niedobór D przy<25 нмол/л (10 нг/мл). Последствием этого типа дефицита витамина D являются снижение абсорбции и уровня Са2+, а также повышение уровня ПТГ в сыворотке крови (вторичный гиперпаратиреоидизм), нарушение процессов ремоделирования и минерализации костной ткани. Дефицит 25(ОН)D рассматривают в тесной связи с нарушениями функций почек и возрастом, в том числе с количеством лет, прожитых после наступления менопаузы. При этом отмечены как географические и возрастные различия в уровне этого показателя, так и его зависимость от времени года, т.е. от уровня солнечной инсоляции/количества солнечных дней (УФ), что необходимо принимать во внимание при проведении соответствующих исследований и анализе полученных данных.
Niedobór 25(OH)D ujawnił się również w zespole złego wchłaniania, chorobie Leśniowskiego-Crohna, stanach po subtotalnej gastrektomii lub operacjach pomostowania jelit, niedostatecznym wydzielaniu soku trzustkowego, marskości wątroby, wrodzonej atrezji przewodu żółciowego, długotrwałym stosowaniu leki przeciwdrgawkowe (przeciwpadaczkowe), nerczyca.
Inny rodzaj niedoboru witaminy D nie zawsze jest definiowany przez zmniejszenie produkcji hormonu D w nerkach (przy tym typie niedoboru można zaobserwować normalne lub nieznacznie podwyższone poziomy w surowicy), ale charakteryzuje się zmniejszeniem jego odbiór w tkankach (odporność na hormony), co jest uważane za funkcję wieku. Niemniej jednak wielu autorów odnotowało spadek poziomu 1a,25(OH)2D3 w osoczu krwi w okresie starzenia, zwłaszcza w grupie wiekowej powyżej 65 lat. Zmniejszona produkcja nerkowa 1a,25(OH)2D3 jest często obserwowana w AP, chorobach nerek (PChN itp.), u osób starszych (>65 lat), z niedoborem hormonów płciowych, osteomalacji hipofosfatowej pochodzenia nowotworowego, z PTH -niedoczynność przytarczyc z niedoborem i opornością na PTH, cukrzyca, pod wpływem stosowania kortykosteroidów itp. Uważa się, że rozwój oporności na 1a,25(OH)2D3 jest spowodowany zmniejszeniem liczby PBD w tkankach docelowych, a przede wszystkim w jelitach, nerkach i mięśniach szkieletowych. Oba warianty niedoboru witaminy D są istotnym ogniwem w patogenezie OP, upadków i złamań.
Przeprowadzone w ostatnich latach zakrojone na szeroką skalę badania wykazały istotną statystycznie korelację między VDD a występowaniem szeregu chorób. Jednocześnie ważne informacje uzyskano w szczególności w badaniu związku VDD z chorobami sercowo-naczyniowymi i onkologicznymi.
Dwa prospektywne badania kohortowe obejmowały 613 mężczyzn z Health Professionals Follow-Up Study i 1198 kobiet z Nurses Health Study, w których zmierzono poziom 25(OH)D i prowadzono obserwację przez 4 do 8 lat. Ponadto 2 prospektywne badania kohortowe obejmowały 38 338 mężczyzn i 77 531 kobiet z przewidywanym poziomem 25(OH)D w okresie od 16 do 18 lat. W ciągu 4 lat obserwacji wieloczynnikowe względne ryzyko nadciśnienia tętniczego wśród mężczyzn ze zmierzonym stężeniem 25(OH)D wynosiło<15 нг/мл (т.е. состояние D–дефицита), в сравнении с теми, у кого этот уровень составлял ³30 нг/мл был определен в 6,13 (!) (95% ДИ 1,00 до 37,8). Среди женщин такое же сравнение выявило показатель относительного риска, равный 2,67 (95% ДИ от 1,05 до 6,79). Группировка данных, касающихся общего относительного риска у мужчин и у женщин, у которых был измерен уровень 25(ОН)D, проведенная с использованием модели дисперсии случайных процессов, позволила получить значение этого риска, близкое к 3,18 (95% ДИ от 1,39 до 7,29). Используя данные об уровне 25(ОН)D в больших когортах, многовариантный и относительные риски сравнивали по наиболее низким и наиболее высоким децилям среди мужчин, где он составил 2,31 (95% ДИ от 2,03 до 2,63) и среди женщин – 1,57 (95% ДИ 1,44 до 1,72). Таким ообразом, уровень 25(ОН)D в плазме крови обратно пропорционален риску развития артериальной гипертензии.
Opisano 16 różnych typów nowotworów złośliwych, których rozwój koreluje z niskim nasłonecznieniem/promieniowaniem UV, a częstość ich występowania wzrasta wraz z niedoborem/niedoborem D. Wśród nich: rak piersi, okrężnicy i odbytnicy, macicy, przełyku, jajników, chłoniak Hodgkina i nieziarniczy, rak pęcherza moczowego, pęcherzyka żółciowego, żołądka, trzustki i prostaty, nerek, jąder i pochwy. Dane dotyczące związku niedoboru/niedoboru D z niektórymi typami patologii onkologicznej uzyskano w wielu badaniach kohortowych lub przy użyciu metodologii kliniczno-kontrolnej.
Badania te potwierdziły istnienie korelacji między częstością występowania i umieralnością z powodu nowotworów złośliwych piersi, okrężnicy, jajników i prostaty a natężeniem promieniowania słonecznego w miejscu stałego zamieszkania pacjentów, czasem ich ekspozycji na słońce oraz poziom witaminy D w surowicy krwi.
Amerykańskie badanie zmierzyło poziomy 25(OH)D w osoczu u 1095 mężczyzn w ramach badania kontrolnego pracowników służby zdrowia i wykorzystało model regresji liniowej do oceny 6 indywidualnych cech (spożycie witaminy D z pożywienia i suplementów witaminy D, rasa, masa ciała indeks, położenie geograficzne, aktywność fizyczna) jako predyktory poziomu 25(OH)D w osoczu. Do analizy wyników wykorzystano komputerowy model statystyczny, w którym obliczono poziom 25(OH)D u 47 800 mężczyzn w kohorcie i jego związek z ryzykiem raka o dowolnej lokalizacji. Stwierdzono, że wzrost lub wzrost obliczonego 25(OH)D o 25 nmol/l (10 ng/ml) jest związany z 17% redukcją całkowitej liczby nowotworów (RR=0,83, 95% CI=0,73 do 0,94) oraz 29% zmniejszenie ogólnej śmiertelności z powodu nowotworów złośliwych (RR = 0,71, 95% CI 0,60 do 0,83) z dominującym wpływem na nowotwory przewodu pokarmowego. Podobne dane uzyskano w wielu innych badaniach, w których ustalono korelację między VDD a ryzykiem rozwoju cukrzycy typu I, innych chorób autoimmunologicznych (stwardnienie rozsiane, reumatoidalne zapalenie stawów), śmiertelności z powodu CRF itp., chorób ośrodkowego układu nerwowego (padaczka, choroba Parkinsona). choroba Alzheimera itp.), gruźlica.
Wszystkie te dane, zarówno specjalistów, jak i organy ds. zdrowia w Stanach Zjednoczonych i Europie Zachodniej, są uważane za „epidemię VDD”, która ma poważne konsekwencje medyczne i medyczne oraz społeczne.
Farmakologiczna korekta niedoboru D
Jak pokazano powyżej, VDD jest jednym z istotnych czynników ryzyka wielu przewlekłych chorób człowieka. Uzupełnianie tego niedoboru poprzez odpowiednią ekspozycję na słońce lub sztuczną ekspozycję na promieniowanie UV jest ważnym elementem profilaktyki tych chorób. Stosowanie preparatów witaminy D, zwłaszcza jej aktywnych metabolitów, jest obiecującym kierunkiem w leczeniu powszechnych typów patologii: wraz z tradycyjnymi metodami terapii otwierają nowe możliwości dla medycyny praktycznej.
Ze względu na aktywność farmakologiczną preparaty witaminy D dzielą się na dwie grupy. Pierwsza z nich łączy umiarkowanie aktywne natywne witaminy D2 (ergokalcyferol) i D3 (cholekalcyferol), a także strukturalny analog witaminy D3, dihydrotachysterol. Witamina D2 jest najczęściej stosowana w preparatach multiwitaminowych dla dzieci i dorosłych. Pod względem aktywności 1 mg witaminy D2 odpowiada 40 000 IU witaminy D. Zazwyczaj witamina D2 jest dostępna w kapsułkach lub tabletkach 50 000 IU (1,25 mg) lub w oleistym roztworze do wstrzykiwań w 500 000 IU/ml (12,5 mg). ) w ampułkach. Preparaty doustne OTC (roztwory) zawierają 8000 IU/ml (0,2 mg) witaminy D2. Ze względu na zawartość substancji czynnych preparaty z tej grupy zaliczane są do mikroelementów (dodatków do żywności).
Druga grupa obejmuje aktywny metabolit witaminy D3 i jej analogi: kalcytriol, alfakalcydol itp.
Mechanizm działania leków obu grup jest podobny do naturalnej witaminy D i polega na wiązaniu się z RBD w narządach docelowych oraz działaniu farmakologicznym w wyniku ich aktywacji (zwiększona absorpcja wapnia w jelicie itp.). Różnice w działaniu poszczególnych leków mają głównie charakter ilościowy i zależą od specyfiki ich farmakokinetyki i metabolizmu. Tak więc preparaty natywnych witamin D2 i D3 ulegają 25-hydroksylacji w wątrobie, a następnie w nerkach przekształcają się w aktywne metabolity, które wykazują odpowiednie działanie farmakologiczne. W związku z tym i zgodnie z powyższymi przyczynami procesy metabolizmu tych leków z reguły zmniejszają się u osób starszych, z różnymi typami i postaciami pierwotnego i wtórnego AP, u pacjentów cierpiących na choroby przewodu pokarmowego, wątroba, trzustka i nerki (CRF) , a także na tle przyjmowania np. leków przeciwdrgawkowych i innych leków zwiększających metabolizm 25 (OH) D do nieaktywnych pochodnych. Ponadto dawki witamin D2 i D3 oraz ich analogów w postaciach dawkowania (zwykle zbliżone do fizjologicznego zapotrzebowania na witaminę D - 200-800 IU/dobę) są w stanie w warunkach fizjologicznych zwiększyć wchłanianie wapnia w jelicie, ale nie pozwalają przezwyciężyć jego złe wchłanianie z różnymi postaciami OP, powodując zahamowanie wydzielania PTH i nie mają wyraźnego pozytywnego wpływu na tkankę kostną.
Braki te pozbawione są preparatów zawierających aktywne metabolity witaminy D3 (w ostatnich latach znacznie szerzej stosowane są w celach terapeutycznych niż preparaty witamin natywnych): pochodna 1a - 1a(OH)D3 (INN - alfakalcydol). Oba leki są podobne pod względem spektrum właściwości farmakologicznych i mechanizmu działania, ale różnią się parametrami farmakokinetycznymi, tolerancją i niektórymi innymi cechami.
Istnieją istotne różnice w farmakokinetyce preparatów opartych na natywnych formach witaminy D, ich aktywnych metabolitach i pochodnych, które w dużej mierze determinują ich praktyczne zastosowanie. Natywne witaminy D2 i D3 są wchłaniane w górnej części jelita cienkiego, przedostając się do układu limfatycznego, wątroby i dalej do krwioobiegu jako część chylomikronów. Ich maksymalne stężenie w surowicy krwi obserwuje się średnio po 12 godzinach od przyjęcia pojedynczej dawki i powraca do wyjściowego poziomu po 72 h. Na tle długotrwałego stosowania tych leków (szczególnie w dużych dawkach) ich eliminacja z krążenia spowalnia znacznie i może sięgać miesięcy, co wiąże się z możliwością odkładania się witamin D2 i D3 w tkance tłuszczowej i mięśniowej.
Witamina D jest wydalana z żółcią w postaci bardziej polarnych metabolitów. Szczegółowo zbadano farmakokinetykę aktywnego metabolitu witaminy D, kalcytriolu. Po podaniu doustnym jest szybko wchłaniany w jelicie cienkim. Maksymalne stężenie kalcytriolu w surowicy krwi osiąga się po 2-6 godzinach i znacznie spada po 4-8 godzinach. Okres półtrwania wynosi 3-6 godzin. Przy wielokrotnym podawaniu stężenia równowagi osiągane są w ciągu 7 dni. W przeciwieństwie do naturalnej witaminy D3 kalcytriol, który nie wymaga dalszego metabolizowania do postaci aktywnej, po podaniu doustnym w dawkach 0,25–0,5 μg, na skutek interakcji z pozajądrowymi receptorami enterocytów błony śluzowej jelit, powoduje wzrost wchłanianie wapnia. Przypuszcza się, że egzogenny kalcytriol przenika z krwi matki do krążenia płodowego i jest wydzielany z mlekiem matki. Jest wydalany z żółcią i podlega krążeniu jelitowo-wątrobowemu. Zidentyfikowano kilka metabolitów kalcytriolu, które wykazują różny stopień właściwości witaminy D; obejmują one 1a,25-dihydroksy-24-oksocholekalcyferol, 1a,23,25-trihydroksy-24-oksocholekalcyferol itp.
Pomimo znacznego podobieństwa właściwości i mechanizmów działania pomiędzy preparatami aktywnych metabolitów witaminy D, zauważalne są również różnice. Cechą alfakalcydolu jako proleku jest to, że, jak już wspomniano, jest przekształcany do postaci aktywnej, metabolizowany w wątrobie do 1a,25(OH)2D3 i w przeciwieństwie do natywnych preparatów witaminy D nie wymaga hydroksylacji nerkowej, co pozwala na stosowanie go u pacjentów z chorobami nerek, a także u osób starszych z upośledzoną czynnością nerek. Jednocześnie stwierdzono, że działanie kalcytriolu rozwija się szybciej i towarzyszy mu wyraźniejsze działanie hiperkalcemiczne niż alfakalcydolu (najczęściej stosowanym lekiem alfakalcydolowym w Rosji jest Alpha D3-Teva), podczas gdy ten drugi ma lepszą wpływ na tkankę kostną. Cechy farmakokinetyki i farmakodynamiki tych leków determinują sposób ich dawkowania i częstość podawania. Tak więc, ponieważ okres półtrwania kalcytriolu jest stosunkowo krótki, należy go podawać co najmniej 2-3 razy dziennie, aby utrzymać stabilne stężenie terapeutyczne. Działanie alfakalcydolu rozwija się wolniej, ale po jednorazowym wstrzyknięciu jest dłuższe, co determinuje jego powołanie w dawkach 0,25–1 μg 1-2 razy dziennie.
Preparaty natywnych witamin D2 i D3 oraz ich aktywnych metabolitów należą do najlepiej tolerowanych i bezpiecznych leków stosowanych w profilaktyce i leczeniu OP. Zapis ten ma duże znaczenie praktyczne ze względu na fakt, że ich użytkowanie jest zwykle dość długie (wiele miesięcy, a nawet lat). Obserwacje kliniczne wskazują, że przy indywidualnym doborze dawek preparatów witaminy D na podstawie oceny poziomu wapnia w osoczu krwi ryzyko wystąpienia działań niepożądanych jest minimalne. Wynika to z szerokiego zakresu działania terapeutycznego związanego z tymi lekami. Niemniej jednak przy stosowaniu aktywnych metabolitów witaminy D u około 2-4% pacjentów może wystąpić szereg działań niepożądanych, z których najczęstsze to hiperkalcemia i hiperfosfatemia, która związana jest z jednym z głównych mechanizmów ich działania – zwiększonym wchłanianie jelitowe wapnia i fosforu. Oba te efekty mogą objawiać się złym samopoczuciem, osłabieniem, sennością, bólami głowy, nudnościami, suchością w ustach, zaparciami lub biegunką, dyskomfortem w nadbrzuszu, bólami mięśni i stawów, swędzeniem skóry, kołataniem serca. Przy indywidualnie dobranej dawce te skutki uboczne obserwuje się dość rzadko.
Doświadczenia międzynarodowe i krajowe w stosowaniu preparatów aktywnego metabolitu witaminy D – kalcytriolu i alfakalcydolu w profilaktyce i leczeniu różnych typów i postaci OP, a także w zapobieganiu upadkom i złamaniom podsumowano w wytycznych klinicznych” Osteoporoza. Diagnoza, profilaktyka i leczenie” 2008, przygotowany przez Rosyjskie Stowarzyszenie Osteoporozy. Wnioski i zalecenia dotyczące stosowania leków opartych na aktywnych metabolitach witaminy D w leczeniu osteoporozy zawarte w niniejszym dokumencie przedstawiono w tabelach 4 i 5.
Tym samym preparaty witaminy D stanowią grupę skutecznych i bezpiecznych leków stosowanych głównie w chorobach, w których patogenezie wiodącą rolę odgrywają niedobory/niedobór D i związane z nimi zaburzenia metabolizmu mineralnego. Natywne preparaty witaminy D, zwłaszcza w dawkach fizjologicznych, dzięki korekcji endogennego niedoboru/niedoboru D, działają zapobiegawczo w krzywicy, a także w stosunku do procesu osteoporotycznego, mogą zmniejszać jego intensywność i zapobiegać powstawaniu złamań. Stosowanie natywnych preparatów witaminy D jest wskazane głównie w przypadku niedoboru typu 1 D, ze względu na brak nasłonecznienia i pobierania witaminy D z pożywienia. Preparaty aktywnych metabolitów witaminy D (alfakalcydol i kalcytriol) są wskazane zarówno w przypadku niedoboru typu 1, jak i typu 2 D. Ze względu na znacznie wyższą aktywność farmakologiczną niż preparaty natywne witaminy D, są w stanie przezwyciężyć oporność tkankowej PBD na agonistę i nie muszą być metabolizowane w nerkach, aby przekształcić się w formę aktywną. Preparaty aktywnych metabolitów witaminy D mają działanie profilaktyczne i terapeutyczne w różnych typach i postaciach OP, zmniejszają ryzyko upadków; mogą być stosowane zarówno w monoterapii, jak iw połączeniu z innymi środkami przeciw osteoporozie (np. bisfosfoniany, środki HRT) oraz solami wapnia. Indywidualny dobór dawek kalcytriolu i alfakalcydolu minimalizuje ryzyko wystąpienia działań niepożądanych, co wraz z zapobieganiem nowym złamaniom, likwidacją bólu i poprawą aktywności ruchowej poprawia jakość życia pacjentów, zwłaszcza starszych i starczych.
Wysoki poziom niedoboru D w populacji i ustalenie jego związku z szeregiem powszechnych chorób pozaszkieletowych (sercowo-naczyniowych, onkologicznych, neurologicznych itp.) sprawia, że wskazane są dalsze badania w celu ustalenia możliwości ich leczenia lekami z grupa aktywnych metabolitów witaminy D.

Literatura
1. Dambacher M.A., Shakht E. Osteoporoza i aktywne metabolity witaminy D: myśli, które przychodzą na myśl. Eular Publishers, Bazylea, 1996 - 139 s.
2. E. I. Marova, S. S. Rodionova, L. Ya Rozhinskaya i G. Ya. Alfacalcidol (Alpha-D3) w profilaktyce i leczeniu osteoporozy. Metoda. zalecenia. M., 1998. - 35 s.
3. Rozhinskaya L.Ya. Osteoporoza ogólnoustrojowa. Praktyczny przewodnik. 2. wyd. M.: Wydawnictwo Mokeev, 2000, -196 s.
4. Nasonov E.L., Skripnikova I.A., Nasonova V.A. Problem osteoporozy w reumatologii, M.: Steen, 1997. - 429 s.
5. Osteoporoza. / Wyd. OM Lesnyak, LI Benevolenskoy - wyd. 2, poprawione. i dodatkowe - M.: GEOTAR-Media, 2009. - 272 s. (Seria „Zalecenia kliniczne”).
6. Schwartz G.Ya. Witamina D, D-hormon i alfakalcydol: aspekty biologii molekularnej i farmakologicznej.//Osteoporoza i osteopatia, 1998, - Nr 3, - P.2-7.
7. Schwartz G.Ya. Farmakoterapia osteoporozy. M.: Agencja Informacji Medycznej, 2002r. - 368 s.
8. Schwartz G.Ya. Witamina D i D-hormon. M.: Anacharsis, 2005. - 152 s.
9. Schwartz G.Ya. Osteoporoza, upadki i złamania u osób starszych: rola układu D-endokrynologicznego. // RMJ, 2008 - v.17, nr 10. - S. 660-669.
10. Autier P., Gaudini S. Suplementacja witaminą D i całkowita śmiertelność. // Arch Intern Med, 2007, 167 (16): 1730–1737.
11. Holik M.F. Witamina D: znaczenie w zapobieganiu nowotworom, cukrzycy typu 1, chorobom serca i osteoporozie. // Jestem J Clin Nutr., 2004; 79(3): 362–371.
12. Holik M.F. Niedobór witaminy D. // Nowy Engl J Med., 2007; 357:266–281.
13. Forman J.P., Giovannucci E., Holmes MD. i in. Poziom 25-hydroksywitaminy D w osoczu i ryzyko incydentów nadciśnienie. //Nadciśnienie, 2007; 49:1063-1069.
14. Vervloet M.G., Twisk J.W.R. Zmniejszenie śmiertelności przez aktywację receptora witaminy D w schyłkowej niewydolności nerek: komentarz na temat wiarygodności aktualnych danych. //Nefrolowy przeszczep tarczy. 2009; 24:703–706.


