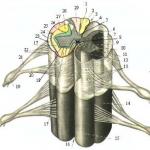
Omurilik, omurilik kanalında bulunur ve servikal ve lomber bölgelerde genişlemiş, kesitte yuvarlak bir kordon görünümündedir. Önde medyan fissür ile arkada medyan oluk ile ayrılan iki simetrik yarıdan oluşur ve segmental bir yapı ile karakterize edilir. Her segment bir çift ön (ventral) ve bir çift arka (dorsal) kök ile ilişkilidir. Omurilik merkezi olarak yerleşmiş gri madde ve onu çevreleyen beyaz maddeden oluşur. Kesitteki gri madde kelebek şeklindedir. Omurilik boyunca uzanan gri maddenin çıkıntılarına sütun denir. Arka, yan ve ön sütunlar vardır. Kesitteki sütunlara boynuz denir. Gri madde, çok kutuplu nöronlar ve nörogliosit gruplarından, miyelinsiz ve ince miyelinli liflerden oluşur.
Ortak bir morfoloji ve işlevi paylaşan nöron kümelerine çekirdek denir. . Arka boynuzlarda şunlar bulunur:
· marjinal Lissauer bölgesi - sırt köklerinin liflerinin omuriliğe girdiklerinde dallanma yeri;
· süngerimsi madde büyük nöronlara sahip geniş halkalı bir glial iskelet ile temsil edilir;
· jelatinimsi (Jöle gibi) maddeler o, küçük sinir hücrelerine sahip nöroglia tarafından oluşturulur;
· sırt boynuzunun kendi çekirdeği ön komissürden omuriliğin karşı tarafındaki yan korda geçen süreçleri ön spinoserebellar sistemin bir parçası olarak beyinciklere ulaşan tutam hücrelerinden oluşan;
· Clarke çekirdeği ayrıca aksonları arka spinoserebellar yolun bir parçası olarak geçen, beyincik ile bağlantılı olan tutam hücrelerden oluşur.
Gri maddenin ara bölgesi, ependimoglia ile kaplı omurga kanalını çevreler. Ara bölgede çekirdekler vardır:
· orta nöronları ön spinoserebellar yola katılan tutam hücrelerden oluşan;
· yanal, Yan boynuzlarda bulunur ve efferent sempatik yolun ilk nöronu olan bir grup asosiasyon hücresinden oluşur.
En büyük sinir hücreleri, aksonları ön köklerin bir parçası olarak omurilikten çıkan ve gövde kaslarını innerve eden motor (kök) nöronlar tarafından oluşturulan arka ve ön medial çekirdeklerin bir parçası olarak ön boynuzlarda bulunur. Arka ve ön yan çekirdekler ayrıca üst ve alt ekstremite kaslarını innerve eden motor nöronlar tarafından oluşturulur.

Beyaz madde, omuriliğin iletken yollarını oluşturan, demetler halinde toplanan uzunlamasına uzanan pulpa sinir lifleri ile temsil edilir. Beyaz madde ikiye ayrılır: arka, yan ve ön kord.

Demetler iki gruba ayrılır: bazıları omuriliğin yalnızca ayrı bölümlerini birbirine bağlar ve ön ve yan kordlarda doğrudan gri maddenin yanında yer alır ve omuriliğin kendi yollarını oluşturur. Başka bir grup demet omuriliği ve beyni birbirine bağlar.
Yükselen ve alçalan yollar var. Yükselen yollar arka kordu oluşturur ve medulla oblongataya doğru yükselir.
Ayırt etmek nazik Gaulle çöreği, Reseptörleri vücudun alt yarısında bulunan duyu hücrelerinin aksonları tarafından oluşturulur ve kama şeklindeki Burdach demeti reseptörleri vücudun üst yarısındaki uyarımı algılar. Bu demetler medulla oblongatanın çekirdeklerinde sonlanır. Bunlar dokunma, acı ve sıcaklık hassasiyetinin yollarıdır.
Lateral kord, spinoserebellar anterior ve spinoserebellar posteriorun artan yollarından oluşur. Bu yollardaki uyarılar beyinciğin ön kısmına ulaşır ve beyincikten kırmızı çekirdeğe kadar uzanan motor yollara geçer.
Azalan yollar şunları içerir:
1. Omuriliği serebral kortekse bağlayan yollar: piramidal, kortikospinal yol ve ön kortikospinal ön funikulusta uzanan yol. Bu yollar vücudun bilinçli, koordineli hareketlerinin gerçekleştirilmesinde büyük önem taşımaktadır. Bu hareketlerin tüm motor uyarıları piramidal yollar aracılığıyla iletilir. Bulbospinal yol aynı zamanda serebral korteksten gelen uyarıları da taşır.
2. Medulla oblongata ile iletişim şu şekilde gerçekleştirilir: vestibulospinal Çekirdeğin hücrelerine kadar vücudun uzayda korunması ve doğru yönlendirilmesi için büyük önem taşıyan yol (deuterospinal) Deiterler vestibüler aparatın yarım dairelerinde reseptör aparatlarına sahip nöronların süreçleri uygundur.
3. Beyincik ve orta beyin ile bağlantı kurar rubrospinal sistem omuriliğin kırmızı çekirdeğindeki hücrelerden geliyor. Bu yol boyunca ilerleyen impulslar tüm otomatik hareketleri kontrol eder.
4. Omurilik ile kuadrigeminal orta beyin arasındaki bağlantı daha az önemli değildir. tektospinal Ve retikülospinal yollar. Kuadrigeminal bölge, optik sinirden ve korteksin oksipital bölgesinden lifler alır ve bu yol boyunca motor nöronlara giden impulslar, hareketlerin netleştirilmesini ve yönünü sağlar.
Omurilik, omurgalıların merkezi sinir sisteminin en eski ve ilkel oluşumu olup, en yüksek düzeyde organize olmuş hayvanlarda morfolojik ve fonksiyonel segmentasyonunu korur. Omuriliğin organizasyonunun karakteristik bir özelliği, sırt kökleri şeklinde girdiler, nöronlardan oluşan bir hücre kütlesi (gri madde) ve ön kökler şeklinde çıktılar içeren bölümler biçimindeki yapısının periyodikliğidir.
İnsan omuriliğinin 31-33 segmenti vardır: 8 servikal, 12 torasik, 5 lomber. 5 sakral, 1-3 koksigeal.
Omuriliğin bölümleri arasında morfolojik sınırlar yoktur, bu nedenle bölümlere bölünme işlevseldir ve içindeki sırt kök liflerinin dağılım bölgesi ve ön köklerin çıkışını oluşturan hücre bölgesi tarafından belirlenir. Her segment, kökleri aracılığıyla üç vücut metamerini innerve eder ve ayrıca üç vücut metamerinden bilgi alır. Üst üste binmenin bir sonucu olarak, vücudun her metameri üç bölüm tarafından innerve edilir ve omuriliğin üç bölümüne sinyaller iletir.
İnsan omuriliğinin iki kalınlaşması vardır: servikal ve lomber - diğer bölümlerine göre daha fazla sayıda nöron içerirler. Omuriliğin arka kökleri boyunca ilerleyen lifler, bu liflerin nerede ve hangi nöronlarda bittiğine göre belirlenen işlevleri yerine getirir. Sırt kökleri afferent, hassas ve merkezcildir. Ön - efferent, motor, santrifüj.
Omuriliğe afferent girdiler, omuriliğin dışında yer alan omurilik ganglionlarının aksonları, otonom sinir sisteminin sempatik ve parasempatik bölümlerinin ekstra ve intramural ganglionlarının aksonları tarafından organize edilir.
Omuriliğin ilk afferent girdi grubunu kas reseptörleri, tendon reseptörleri, periosteum ve eklem membranlarından gelen duyu lifleri oluşturur. Bu reseptör grubu propriyoseptif duyarlılığın başlangıcını oluşturur.
Omuriliğin ikinci grup afferent girdileri deri reseptörlerinden başlar: ağrı, sıcaklık, dokunma, basınç ve deri alıcı sistemini temsil eder.
Omuriliğin üçüncü grup aferent girdileri, iç organlardan gelen alıcı girdilerle temsil edilir; Bu viskozeptif sistemdir.
Efferent (motor) nöronlar omuriliğin ön boynuzlarında bulunur; lifleri tüm iskelet kaslarını innerve eder.
Omuriliğin iki işlevi vardır: iletken ve refleks.
Omurilik, omuriliğin beyaz maddesinden geçen çıkan ve inen yollar nedeniyle iletken bir işlev görür. Bu yollar omuriliğin bireysel bölümlerini birbirine bağlar. Omurilik, uzun yükselen ve alçalan yollar aracılığıyla çevreyi beyne bağlar. Omurilik yolları boyunca afferent uyarılar beyne taşınarak vücudun dış ve iç ortamındaki değişiklikler hakkında bilgi taşır. İnen yollar boyunca, beyinden gelen uyarılar omuriliğin efektör nöronlarına iletilir ve onların aktivitelerine neden olur veya onları düzenler.
Bir refleks merkezi olarak omurilik, karmaşık motor ve otonomik refleksleri gerçekleştirme kapasitesine sahiptir. Duyarlı aferent yollarla reseptörlere, efferent yollarla ise iskelet kaslarına ve tüm iç organlara bağlanır.
Omuriliğin gri maddesi, omurilik sinirlerinin arka ve ön kökleri ve beyaz maddenin içsel demetleri, omuriliğin segmental aparatını oluşturur. Omuriliğin refleks (segmental) fonksiyonunu sağlar.
Omuriliğin sinir merkezleri segmental veya çalışan merkezlerdir. Nöronları doğrudan reseptörlere ve çalışan organlara bağlıdır. Omurilik nöronlarının fonksiyonel çeşitliliği, afferent nöronların, internöronların, motor nöronların ve otonom sinir sisteminin nöronlarının varlığı, ayrıca çok sayıda doğrudan ve ters, segmental, segmentler arası bağlantı ve beyin yapılarıyla bağlantılar - tüm bunlar, Omuriliğin refleks aktivitesi hem kendi yapılarının hem de beynin katılımıyla gerçekleşir.
Bu organizasyon vücudun, diyaframın, genitoüriner sistemin ve rektumun tüm motor reflekslerinin, termoregülasyonun, vasküler reflekslerin vb. uygulanmasına izin verir.
Sinir sistemi refleks prensiplerine göre çalışır. Refleks, vücudun dış veya iç etkiye verdiği tepkidir ve bir refleks yayı boyunca yayılır, yani. Omuriliğin kendi refleks aktivitesi segmental refleks yayları tarafından gerçekleştirilir. Refleks yayları sinir hücrelerinden oluşan devrelerdir.
Refleks yayında beş bağlantı vardır:
reseptör;
merkezlere uyarı ileten hassas lif;
uyarılmanın duyu hücrelerinden motor hücrelere geçişinin gerçekleştiği sinir merkezi;
sinir uyarılarını çevreye taşıyan motor lifi;
oyunculuk organı bir kas veya bezdir.
En basit refleks arkı, sinir uyarısının menşe yerinden (reseptör) çalışma organına (efektör) doğru hareket ettiği hassas ve efferent nöronları içerir.İlk hassas (sözde tek kutuplu) nöronun gövdesi, omurga ganglionunda bulunur. . Dendrit, dış veya iç uyarıları (mekanik, kimyasal vb.) algılayan ve bunu sinir hücresinin gövdesine ulaşan bir sinir uyarısına dönüştüren bir reseptörle başlar. Akson boyunca nöronun gövdesinden, sinir impulsu, omurilik sinirlerinin duyusal kökleri yoluyla, efektör nöronların gövdeleri ile sinapsların oluşturulduğu omuriliğe gönderilir. Her bir internöron sinapsında, biyolojik olarak aktif maddelerin (aracılar) yardımıyla dürtü iletimi gerçekleşir. Efektör nöronun aksonu, omuriliği, omurilik sinirlerinin (motor veya salgı sinir lifleri) ön köklerinin bir parçası olarak terk eder ve çalışan organa yönlendirilerek kas kasılmasına ve bez salgısının artmasına (engellenmesine) neden olur.
Fonksiyonel olarak, omurilik reflekslerinin refleks merkezleri omuriliğin çekirdekleridir. Servikal omurilikte frenik sinirin merkezi, gözbebeği daralmasının merkezi bulunur. Servikal ve torasik bölgelerde üst ekstremite, göğüs, karın ve sırt kasları için motor merkezleri vardır. Lomber bölgede alt ekstremite kaslarının merkezleri vardır. Sakral bölge idrara çıkma, dışkılama ve cinsel aktivite merkezlerini içerir. Torasik ve lomber bölgelerin yan boynuzlarında terleme merkezleri ve vazomotor merkezleri vardır.
Omurilik segmental bir yapıya sahiptir. Bir segment, iki çift köke yol açan bir segmenttir. Kurbağanın arka kökleri bir taraftan, ön kökleri diğer taraftan kesilirse, arka köklerin kesildiği taraftaki bacaklar hassasiyetini kaybeder, ön köklerin kesildiği karşı taraftaki bacaklar ise hassasiyetini kaybeder. felç olacak. Sonuç olarak, omuriliğin dorsal kökleri hassastır ve ön kökleri motordur.
Omuriliğin refleks reaksiyonları, konuma, stimülasyonun gücüne, tahriş olmuş refleks bölgesinin alanına, afferent ve efferent lifler boyunca iletim hızına ve son olarak beynin etkisine bağlıdır. Tekrarlanan uyarılarla omurilik reflekslerinin gücü ve süresi artar. Her omurga refleksinin kendi alıcı alanı, kendi lokalizasyonu (konumu), kendi seviyesi vardır. Örneğin cilt refleksinin merkezi II-IV lomber segmentte bulunur; Aşil - V lomber ve I-II sakral segmentlerde; plantar - I-II sakralda, karın kaslarının merkezi - VIII-XII torasik segmentlerde. Omuriliğin en önemli hayati merkezi, III-IV servikal segmentlerde yer alan diyaframın motor merkezidir. Hasarı solunum durması nedeniyle ölüme yol açar.
Omurilik, önde derin medyan fissür ve arkada medyan sulkus ile birbirinden ayrılan iki simetrik yarıdan oluşur. Omurilik, segmental (metamerik) bir yapıyla (31-33 segment) karakterize edilir; her segment bir çift ön (ventral) ve bir çift arka (dorsal) kök ile ilişkilidir.
Omurilikte var gri madde, orta kısımda bulunur ve Beyaz madde, çevrede yatıyor.
Omuriliğin beyaz maddesinin dış sınırı şu şekilde oluşur: sınırlayıcı glial membran Astrositlerin kaynaşmış düzleştirilmiş süreçlerinden oluşan. Bu zar, ön ve arka kökleri oluşturan sinir lifleri tarafından delinir.
Tüm omurilik boyunca, gri maddenin ortasında, beynin ventrikülleriyle iletişim kuran omuriliğin merkezi kanalı geçer.
Enine kesitteki gri madde bir kelebeğin görünümündedir ve şunları içerir: ön veya ventral, arka, veya sırt ve yanal veya yanal boynuzlar. Gri madde, nöronların gövdelerini, dendritlerini ve (kısmen) aksonlarını ve ayrıca glial hücreleri içerir. Gri maddeyi beyaz maddeden ayıran ana bileşen çok kutuplu nöronlardır. Nöronların hücre gövdeleri arasında nöropil- sinir lifleri ve glial hücrelerin süreçlerinden oluşan bir ağ.
Omuriliğin tüm nöronları arasında üç tip hücre ayırt edilebilir:
radiküler,
· dahili,
· paketlenmiş.
Aksonlar radiküler hücreler omuriliği ön köklerinin bir parçası olarak bırakın; bunlar yan ve ön boynuzların hücreleridir. Süreçler iç hücreler Omuriliğin gri maddesi içindeki sinapslarla (esas olarak sırt boynuzlarındaki nöronlar) sona erer. Aksonlar tutam hücreleri Beyaz maddeden ayrı lif demetleri halinde geçerek omuriliğin belirli çekirdeklerinden sinir uyarılarını diğer bölümlerine veya beynin karşılık gelen bölümlerine taşıyarak yollar oluşturur.
Nöral tüpten omuriliğin gelişimi sırasında nöronlar izogenetik olarak 10 katman halinde gruplanır veya Rexed plakalar. Bu durumda, I-V plakaları arka boynuzlara, VI-VII plakaları - ara bölgeye, VIII-IX plakaları - ön boynuzlara, plaka X - merkezi kanalın yakınındaki bölgeye karşılık gelir. Enine kesitlerde, nükleer nöron grupları daha net bir şekilde görülebilir ve sagittal kesitlerde, nöronların Rexed sütunları halinde gruplandırıldığı katmanlı yapı daha iyi görünür.
Boyut, yapı ve işlevsel önem bakımından benzer hücreler, gri maddede adı verilen gruplar halinde bulunur. çekirdekler.
İÇİNDE arka boynuzlar süngerimsi tabakayı, jelatinimsi maddeyi, sırt boynuzunun çekirdeğini ve Clark'ın torasik çekirdeğini, Roland'ın çekirdeğini inhibitör nöronlarla, Lissauer alanını ayırt eder.
Nöronlar süngerimsi bölge ve jelatinimsi madde Spinal gangliyonların duyu hücreleri ile ön boynuzların motor hücreleri arasında iletişim kurarak lokal refleks yaylarını kapatırlar.
Nöronlar Clarke çekirdekleri En kalın radiküler lifler boyunca kas, tendon ve eklem reseptörlerinden (propriyoseptif duyarlılık) bilgi alır ve bunu beyinciğe iletir; bunlar büyük çok kutuplu nöronlardır.
Nöronlar kendi çekirdeği Sırt boynuzu, aksonları omuriliğin gri maddesi içinde aynı tarafta (birleştirici hücreler) veya karşı tarafta (kommissural hücreler) biten, interkalar küçük çok kutuplu hücrelerdir.
Arka ve yan boynuzlar arasında, gri madde beyaz maddeye şeritler halinde çıkıntı yapar, bunun sonucunda ağ benzeri gevşeme oluşur, buna retiküler oluşum veya omuriliğin retiküler oluşumu adı verilir.
Ara bölgede (yan boynuzlar) otonom (otonom) sinir sisteminin merkezleri bulunur - sempatik ve parasempatik bölümlerinin preganglionik kolinerjik nöronları.
İÇİNDE ön boynuzlar Omuriliğin en büyük nöronları bulunur. Bunlar radiküler hücrelerdir çünkü aksonları ön köklerin liflerinin büyük kısmını oluşturur. Ön boynuzlarda, hacim açısından önemli olan 5 çekirdek grubu oluşturan 3 tip nöron vardır (yanal - ön ve arka grup, medial - ön ve arka grup ve merkezi veya orta çekirdek).
Alfa motor nöronları- büyük nöronlar 100-140 mikron. İşlevsel olarak motordurlar ve ön köklerin bir parçası olan aksonları omurilikten çıkar ve çizgili kaslara yönlendirilir.
Gama motor nöronları– daha küçük olanlar, kasılma kuvvetini ve hızını kontrol eden hücrelerdir.
Renshaw hücreleri - inhibitör hücreler, fleksör ve ekstansör motor nöronlarının karşılıklı inhibisyonunu gerçekleştirir ve ayrıca karşılıklı inhibisyon gerçekleştirir.
Beyaz madde Beynin boynuzları sütunlara bölünmüştür: ön (azalan), orta (karışık) ve arka (artan). Omuriliğin beyaz maddesi, uzunlamasına yönelimli, ağırlıklı olarak miyelinli sinir liflerinin bir koleksiyonudur. Sinir sisteminin farklı bölümleri arasında iletişim kuran sinir lifi demetlerine omuriliğin yolları veya yolları denir.
4. Omuriliğin refleks aparatı (somatik refleks yayları))
Omuriliğin kendi aparatının temel refleks arkı iki nöronla temsil edilir. İlkinin cesedi afferent nöron omurga gangliyonunda bulunur. Dendriti çevreye yöneliktir ve bir reseptörle biter. Sırt köklerinin bir parçası olan afferent nöronun aksonu omuriliğe, sırt boynuzlarına girer ve omuriliğin ön boynuzlarının hücrelerine geçer. Ön boynuzlarda gövdeler bulunur motor efferent hücreleri– üzerinde hassas hücrenin aksonunun aksosomatik bir sinaps ile bittiği büyük alfa motor nöronları. Efferent nöronun aksonu omuriliği terk eder, ventral köklere girer, ardından omurilik sinirine, pleksusa girer ve son olarak somatik sinire ulaşır. efektör organ(kaslar, bezler).
Tahriş uygulandığında (parmak batması), reseptör aparatı (deri nosiseptörleri) tahriş olur ve dendrit, aferent nöronun gövdesi ve aksonu boyunca sinaptik bir bağlantı yoluyla merkezcil olarak taşınan bir sinir impulsu üretilir. İkinci efferent nöronun gövdesi. Buradan, sinir uyarısı omuriliği, ön kökü ve siniri hücre aksonu boyunca santrifüjlü olarak terk eder ve efektör organda (biceps brachii kası) uyarılmaya neden olur, bu da beklenen etkiye - elin geri çekilmesine yol açar.
Bitkisel refleks yaylarının yapısı ve çalışma prensibi bağımsız olarak anlaşılmıştır.
1.1. Sinir sistemi: genel yapı
Sinir sistemi, dış ve iç ortamın değişen koşullarına uygun olarak çeşitli fizyolojik süreçleri bütünleştiren ve düzenleyen bir vücut sistemidir. Sinir sistemi, çevreden gelen uyaranlara yanıt veren duyusal bileşenlerden, duyusal ve diğer verileri işleyen ve depolayan bütünleyici bileşenlerden ve bezlerin hareketlerini ve salgılama aktivitesini kontrol eden motor bileşenlerden oluşur.
Sinir sistemi duyusal uyaranları algılar, bilgiyi işler ve davranışı oluşturur. Özel bilgi işleme türleri öğrenme ve hafızadır; bu sayede ortam değiştiğinde davranış önceki deneyimleri dikkate alarak uyum sağlar. Endokrin ve bağışıklık sistemi gibi diğer sistemler de bu işlevlerde görev alır ancak sinir sistemi bu işlevleri yerine getirmek için uzmanlaşmıştır. Bilgi işleme, bilginin sinir ağlarında iletilmesini, sinyallerin diğer sinyallerle birleştirilerek dönüştürülmesini (nöral entegrasyon), bilginin hafızada saklanmasını ve hafızadan bilginin geri getirilmesini, duyusal bilginin algılama, düşünme için kullanılmasını ifade eder. Motor hareketlerin öğrenilmesi, planlanması (hazırlanması) ve yürütülmesi, komutlar, duyguların oluşumu. Nöronlar arasındaki etkileşimler hem elektriksel hem de kimyasal süreçlerle gerçekleşir.
Davranış, vücudun dış ve iç çevrenin değişen koşullarına verdiği tepkilerin bir kompleksidir. Davranış tamamen içsel, gizli bir süreç (biliş) veya dış gözlemle erişilebilir (motor veya otonomik reaksiyonlar) olabilir. İnsanlarda konuşmayla ilişkili davranışsal eylemler dizisi özellikle önemlidir. Basit veya karmaşık her reaksiyon, sinir ağları (sinir toplulukları ve yolları) halinde organize edilen sinir hücreleri tarafından sağlanır.
Sinir sistemi merkezi ve periferik olarak bölünmüştür (Şekil 1.1). Merkezi sinir sistemi (CNS) beyin ve omurilikten oluşur. Periferik sinir sistemi kökleri, pleksusları ve sinirleri içerir.
Pirinç. 1.1. Sinir sisteminin genel yapısı.
A- Merkezi sinir sistemi. B- Beyin sapı: 1 - telensefalon; 2 - diensefalon; 3 - orta beyin; 4 - pons ve beyincik, 5 - medulla oblongata, 6 - telensefalon medyan yapıları. İÇİNDE- Omurilik: 7 - omurilik konusu; 8 - terminal dişleri. G- Periferik sinir sistemi: 9 - ventral kök; 10- sırt kökü; 11 - omurga ganglionu; 12 - omurilik siniri; 13 - karışık periferik sinir; 14 - epinöryum; 15 - perinöryum; 16 - miyelin siniri; 17 - fibrosit; 18 - endonöryum; 19 - kılcal; 20 - miyelinsiz sinir; 21 - cilt reseptörleri; 22 - motor nöronunun sonu; 23 - kılcal; 24 - kas lifleri; 25 - Schwann hücre çekirdeği; 26 - Ranvier'in durdurulması; 27 - sempatik gövde; 28 - bağlantı kolu
Merkezi sinir sistemi
Merkezi sinir sistemi, reseptörlerden gelen çevreyle ilgili bilgileri toplar ve işler, refleksleri ve diğer davranışsal reaksiyonları oluşturur, istemli hareketleri planlar ve gerçekleştirir. Ek olarak, merkezi sinir sistemi yüksek bilişsel (bilişsel) işlevler olarak adlandırılan işlevleri sağlar. Bellek, öğrenme ve düşünme ile ilgili süreçler merkezi sinir sisteminde meydana gelir.
Ontogenez süreci sırasında beyin, medüller tüpün ön bölümlerinin eşit olmayan büyümesinin bir sonucu olarak ortaya çıkan beyin keseciklerinden oluşur (Şekil 1.2). Ön beyin bu keseciklerden oluşur (prosensefalon), orta beyin (mezensefalon) ve eşkenar dörtgen (rombensefalon). Daha sonra ön beyinden terminal beyin oluşur. (telensefalon) ve orta (diensefalon) beyin ve eşkenar dörtgen, arka beyine bölünmüştür (metensefalon) ve dikdörtgen (miyelensefalon, veya medulla oblongata) beyin. Telensefalondan sırasıyla serebral hemisferler, bazal ganglionlar, diensefalondan - talamus, epitalamus, hipotalamus, metatalamus, optik yollar ve sinirler ve retina oluşur. Optik sinirler ve retina, merkezi sinir sisteminin parçalarıdır ve görünüşe göre beynin dışında yer almaktadır. Lamina quadrigemina ve serebral pedinküller orta beyinden oluşur. Pons ve beyincik arka beyinden oluşur. Pons beyni aşağıda medulla oblongata ile sınır komşusudur.
Medüller tüpün arka kısmı omuriliği oluşturur ve boşluğu omuriliğin merkezi kanalı haline gelir. Omurilik, her biri sırayla bölümlerden oluşan servikal, torasik, lomber, sakral ve koksigeal bölümlerden oluşur.
Merkezi sinir sistemi gri ve beyaz maddeye ayrılmıştır. Gri madde nöron gövdelerinin bir koleksiyonudur, beyaz madde ise miyelin kılıfıyla kaplı nöronların süreçleridir. Beyinde gri madde serebral korteks, subkortikal ganglionlar, beyin sapı çekirdekleri, serebellar korteks ve çekirdeklerinde bulunur. Omurilikte gri madde ortada, beyaz madde ise çevrede yoğunlaşmıştır.
Periferik sinir sistemi
Periferik sinir sistemi (PNS), çevre (veya uyarılabilir hücreler) ile merkezi sinir sistemi arasındaki arayüzden sorumludur. PNS, duyusal (reseptörler ve birincil aferent nöronlar) ve motor (somatik ve otonomik motor nöronlar) bileşenleri içerir.
 Pirinç. 1.2. Memeli sinir sisteminin embriyonik gelişimi. Üçüncü aşamada sinir bölmesinin gelişim şeması (A) ve beş (B) beyin kabarcıkları. A. ben- Genel yandan görünüm: 1 - kafatası kıvrımı; 2 - servikal kıvrım; 3 - omurga düğümü. II- Üstten görünüm: 4 - ön beyin; 5 - orta beyin; 6 - eşkenar dörtgen beyin; 7 - nörosel; 8 - nöral tüpün duvarı; 9 - ilkel omurilik.
Pirinç. 1.2. Memeli sinir sisteminin embriyonik gelişimi. Üçüncü aşamada sinir bölmesinin gelişim şeması (A) ve beş (B) beyin kabarcıkları. A. ben- Genel yandan görünüm: 1 - kafatası kıvrımı; 2 - servikal kıvrım; 3 - omurga düğümü. II- Üstten görünüm: 4 - ön beyin; 5 - orta beyin; 6 - eşkenar dörtgen beyin; 7 - nörosel; 8 - nöral tüpün duvarı; 9 - ilkel omurilik.
B. ben- Genel yandan görünüm. B.II- Üstten görünüm: 10 - telensefalon; 11 - yan ventrikül; 12 - diensefalon; 13 - göz sapı; 14 - mercek; 15 - optik sinir; 16 - orta beyin; 17 - arka beyin; 18 - medulla oblongata; 19 - omurilik; 20 - merkezi kanal; 21 - dördüncü ventrikül; 22 - beyin su kemeri; 23 - üçüncü ventrikül. III- Yan görünüm: 24 - neobark; 25 - interventriküler septum; 26 - striatum; 27 - globus pallidus; 28 - hipokampus; 29 - talamus; 30 - epifiz gövdesi; 31 - üst ve alt koliküller; 32 - beyincik; 33 - arka beyin; 34 - omurilik; 35 - medulla oblongata; 36 - köprü; 37 - orta beyin; 38 - nörohipofiz; 39 - hipotalamus; 40 - amigdala; 41 - koku alma yolu; 42 - koku korteksi
PNS'nin duyusal kısmı. Duyusal algı, dış bir uyaranın enerjisinin sinirsel bir sinyale dönüştürülmesidir. Mekanik, ışık, ses, kimyasal uyaranlar ve sıcaklık değişiklikleri dahil olmak üzere çeşitli dış enerji türlerinin vücut üzerindeki etkilerini algılayan özel yapılar - reseptörler tarafından gerçekleştirilir. Reseptörler, alınan bilgiyi sinirlerin, pleksusların, omurilik sinirlerinin duyusal lifleri boyunca ve son olarak omuriliğin (veya kranyal sinirlerin) dorsal kökleri boyunca merkezi sinir sistemine ileten birincil aferent nöronların periferik uçlarında bulunur. Dorsal köklerin ve kranyal sinirlerin hücre gövdeleri, omurilik ganglionlarında veya kranyal sinirlerin ganglionlarında bulunur.
PNS'nin motor kısmı. PNS'nin motor bileşeni somatik ve otonomik (otonomik) motor nöronları içerir. Somatik motor nöronlar çizgili kasları innerve eder. Hücre gövdeleri omuriliğin ön boynuzunda veya beyin sapında bulunur ve birçok sinaptik "girdi" alan uzun dendritlere sahiptir. Her kasın motor nöronları, benzer işlevlere sahip bir grup merkezi sinir sistemi nöronu olan belirli bir motor çekirdeğini oluşturur. Örneğin yüz kasları, fasiyal sinirin çekirdeğinden innerve edilir. Somatik motor nöronların aksonları, merkezi sinir sistemini ön kök veya kranyal sinir yoluyla terk eder.
Otonom (otonom) motor nöronlar sinirleri düz kas liflerine ve bezlerine (sempatik ve parasempatik sinir sisteminin preganglionik ve postganglionik nöronları) gönderir. Preganglionik nöronlar merkezi sinir sisteminde, omurilikte veya beyin sapında bulunur. Somatik motor nöronların aksine, otonomik preganglionik nöronlar, efektör hücreler (düz kas veya bezler) üzerinde değil, postganglionik nöronlar üzerinde sinapslar oluşturur ve bunlar da doğrudan efektörlerle sinaps yapar.
1.2. Sinir sisteminin mikroskobik yapısı
Sinir sistemi, gelen sinyalleri alma ve sinyalleri diğer nöronlara veya efektör hücrelere iletme konusunda uzmanlaşmış sinir hücrelerinden veya nöronlardan oluşur. Sinir sistemi, sinir hücrelerine ek olarak glial hücreleri ve bağ dokusu elemanlarını da içerir. Nöroglial hücreler (Yunanca "glia" - yapıştırıcıdan)
Sinir sisteminde destekleyici, trofik ve düzenleyici işlevleri yerine getirir ve hemen hemen her türlü nöronal aktiviteye katılır. Kantitatif olarak nöronlara hakimdirler ve damarlar ile sinir hücreleri arasındaki hacmin tamamını kaplarlar.
Sinir hücresi
Sinir sisteminin ana yapısal ve fonksiyonel birimi nörondur (Şekil 1.3). Bir nöronun bir gövdesi (soma) ve süreçleri vardır: dendritler ve akson. Soma ve dendritler hücrenin alıcı yüzeyini temsil eder. Bir sinir hücresinin aksonu diğer nöronlarla veya efektör hücrelerle sinaptik bağlantılar oluşturur. Sinir uyarısı her zaman tek yönde yayılır: dendritler boyunca hücre gövdesine, akson boyunca hücre gövdesinden (Ramon y Cajal'ın sinir hücresinin dinamik polarizasyonu yasası). Tipik olarak, bir nöronun dendritler tarafından yapılan birçok "girdisi" ve yalnızca bir "çıktısı" (akson) vardır (bkz. Şekil 1.3).
Nöronlar aksonlar boyunca ilerleyen aksiyon potansiyellerini kullanarak birbirleriyle iletişim kurarlar. Aksiyon potansiyelleri sinaptik iletim yoluyla bir nörondan diğerine geçer. Presinaptik terminale ulaşan bir aksiyon potansiyeli genellikle bir nörotransmiterin salınmasını tetikler; bu nörotransmitter, ya postsinaptik hücreyi uyararak bir veya daha fazla aksiyon potansiyelinin boşalmasını sağlar ya da aktivitesini inhibe eder. Aksonlar sadece sinirlerde bilgi iletmez
 Pirinç. 1.3. Bir nöronun yapısı. A- Vücudun kendisi, dendritler ve bir aksondan oluşan tipik bir nöron: 1 - aksonun başlangıcı; 2 - dendritler; 3 - nöron gövdesi; 4 - akson; 5 - Schwann hücresi; 6 - akson dallanması. B- Genişlemiş nöron gövdesi. Aksonal tepecik Nissl maddesini içermez: 7 - çekirdek; 8 - Golgi aygıtı; 9 - mitokondri; 10 - aksonal tepecik; 11 - Nissl maddesi
Pirinç. 1.3. Bir nöronun yapısı. A- Vücudun kendisi, dendritler ve bir aksondan oluşan tipik bir nöron: 1 - aksonun başlangıcı; 2 - dendritler; 3 - nöron gövdesi; 4 - akson; 5 - Schwann hücresi; 6 - akson dallanması. B- Genişlemiş nöron gövdesi. Aksonal tepecik Nissl maddesini içermez: 7 - çekirdek; 8 - Golgi aygıtı; 9 - mitokondri; 10 - aksonal tepecik; 11 - Nissl maddesi
zincirler, aynı zamanda kimyasalları aksonal taşıma yoluyla sinaptik terminallere iletir.
Vücutlarının şekline, dendritlerin uzunluğuna ve şekline ve diğer özelliklerine göre çok sayıda nöron sınıflandırması vardır (Şekil 1.4). Fonksiyonel önemlerine göre sinir hücreleri, merkeze impuls ileten afferent (hassas, duyusal), merkezden çevreye bilgi taşıyan efferent (motor, motor) ve impulsların iletildiği internöronlara (internöronlar) ayrılır. işlenir ve teminat bağlantıları düzenlenir.
Bir sinir hücresi iki ana işlevi yerine getirir: gelen bilgilerin spesifik olarak işlenmesi ve sinir uyarılarının iletilmesi ve hayati işlevlerini sürdürmeyi amaçlayan biyosentetik. Bu aynı zamanda sinir hücresinin üst yapısında da ifade edilir. Bilginin bir sinir hücresinden diğerine iletilmesi, sinir hücrelerinin farklı karmaşıklıktaki sistemler ve kompleksler halinde birleştirilmesi nöron yapıları tarafından gerçekleştirilir: aksonlar, dendritler ve sinapslar. Enerji metabolizması ve hücrenin protein sentezleme işleviyle ilişkili organeller çoğu hücrede bulunur; sinir hücrelerinde hücreye enerji sağlama, bilginin işlenmesi ve iletilmesi işlevlerini yerine getirirler (bkz. Şekil 1.3).
Nöron yapısı. Soma. Sinir hücresinin gövdesi, merkezde (veya biraz eksantrik) bulunan bir çekirdeğe sahip, yuvarlak veya oval bir şekle sahiptir. Nükleolus içerir ve her biri yaklaşık 70 Å kalınlığında, periferik zarlarla ayrılmış dış ve iç nükleer membranlarla çevrilidir.
 Pirinç. 1.4. Farklı şekillerdeki nöronların çeşitleri.
Pirinç. 1.4. Farklı şekillerdeki nöronların çeşitleri.
A- Psödounipolar nöron. B- Purkinje hücresi (dendritler, akson). İÇİNDE- piramidal hücre (akson). G- ön boynuzun motor nöronu (akson)
boyutları değişken olan nükleer uzay. Kromatin topakları, esas olarak iç nükleer membranda lokalize olan karyoplazmada dağıtılır. Sinir hücrelerinin sitoplazmasında granüler ve granüler olmayan sitoplazmik retikulum, polisomlar, ribozomlar, mitokondri, lizozomlar, multivesiküler cisimler ve diğer organellerin elemanları bulunur (Şekil 1.5).
Nöronlardaki biyosentez aparatı, granüler endoplazmik retikulumun sıkıca bitişik düzleştirilmiş sarnıçları ve ayrıca iyi tanımlanmış bir Golgi aparatı olan Nissl cisimciklerini içerir. Ek olarak soma, enerji metabolizmasını belirleyen çok sayıda mitokondri ve nörofilamentler ve mikrotübüller dahil olmak üzere hücre iskeleti elemanlarını içerir. Lizozomlar ve fagozomlar “hücre içi sindirim sisteminin” ana organelleridir.
Dendritler. Dendritler ve dalları, belirli bir hücrenin alıcı alanını belirler (bkz. Şekil 1.5). Elektron mikroskobu incelendiğinde, nöron gövdesinin yavaş yavaş dendrite dönüştüğü görülür. Somanın üst yapısında ve büyük dendritin başlangıç bölümünde keskin sınırlar veya belirgin farklılıklar yoktur. Dendritler şekil, boyut, dallanma ve üst yapı bakımından oldukça değişkendir. Tipik olarak hücre gövdesinden birkaç dendrit uzanır. Dendritin uzunluğu 1 mm'yi aşabilir, nöronun yüzey alanının %90'ından fazlasını oluştururlar.
Dendritlerin sitoplazmasının ana bileşenleri mikrotübüller ve nörofilamentlerdir; dendritlerin yakın kısımları (hücre gövdesine daha yakın) Nissl gövdelerini ve Golgi aygıtının bölümlerini içerir. Daha önce dendritlerin elektriksel olarak uyarılamaz olduğuna inanılıyordu; şimdi birçok dendritin dendritlerinin elektriksel olarak uyarılamaz olduğu kanıtlandı.
 Pirinç. 1.5. Bir sinir hücresinin ultra yapısı.
Pirinç. 1.5. Bir sinir hücresinin ultra yapısı.
1 - çekirdek; 2 - granüler endoplazmik retikulum; 3 - katmanlı kompleks (Golgi); 4 - mitokondri; 5 - lizozomlar; 6 - multivesiküler gövde; 7 - polisomlar
nöronlar, aktivasyonu üzerine aksiyon potansiyellerinin üretildiği, membranlarında kalsiyum kanallarının varlığından kaynaklanan voltaja bağlı iletkenliğe sahiptir.
Akson. Akson, hücrenin özel bir kısmı olan akson tepeciğinden kaynaklanır (genellikle soma, ancak bazen dendrit) (bkz. Şekil 1.3). Akson ve akson tepeciği, granüler endoplazmik retikulum, serbest ribozomlar ve Golgi aparatının yokluğunda soma ve proksimal dendritlerden farklıdır. Akson, pürüzsüz bir endoplazmik retikulum ve belirgin bir hücre iskeleti içerir.
Aksonlar, miyelin liflerini oluşturan bir miyelin kılıfıyla kaplıdır. Lif demetleri (bireysel miyelinsiz lifler içerebilir) beynin, kranial ve periferik sinirlerin beyaz maddesini oluşturur. Akson, sinaptik veziküllerle dolu presinaptik terminale geçtiğinde, akson şişe şeklinde bir uzantı oluşturur.
Aksonların, dendritlerin ve glial hücrelerin süreçlerinin iç içe geçmesi, nöropilin karmaşık, tekrarlanmayan modellerini oluşturur. Akson ve dendritlerin dağılımı, göreceli konumları, afferent-efferent ilişkileri ve sinapto mimari kalıpları, beynin bütünleyici fonksiyon mekanizmalarını belirler.
Nöron türleri. Nöronların yapısındaki polimorfizm, bir bütün olarak beynin sistemik aktivitesindeki farklı rolleriyle belirlenir. Böylece, omuriliğin dorsal kök ganglionlarının (spinal ganglionlar) nöronları, sinaptik iletim yoluyla değil, reseptör organlardaki duyusal sinir uçlarından bilgi alır. Buna göre, bu nöronların hücre gövdeleri dendritlerden yoksundur ve sinaptik sonlanmalar (bipolar hücreler; Şekil 1.6) almazlar. Hücre gövdesini terk eden böyle bir nöronun aksonu, biri (periferik süreç) periferik sinirin bir parçası olarak reseptöre gönderilen ve diğer dal (merkezi süreç) omuriliğe giren iki dala ayrılır ( sırt kökünün bir parçası olarak) veya beyin sapı (kranyal sinirin bir parçası olarak). Serebral korteksin piramidal hücreleri ve serebellar korteksin Purkinje hücreleri gibi başka türdeki nöronlar bilgiyi işlemekle meşguldür. Dendritleri dendritik dikenlerle kaplıdır ve geniş bir yüzeye sahiptir; çok sayıda sinaptik girdi alırlar (çok kutuplu hücreler; bkz. Şekil 1.4, 1.6). Nöronları akson uzunluklarına göre sınıflandırmak mümkündür. Golgi tip 1 nöronları, somaya yakın dendritler gibi biten kısa aksonlara sahiptir. Tip 2 nöronların aksonları uzundur, bazen 1 metreden uzundur.
Nöroglia
Sinir sisteminin başka bir hücresel element grubu nörogliadır (Şekil 1.7). İnsan merkezi sinir sisteminde, nöroglial hücrelerin sayısı nöron sayısından çok daha fazladır: sırasıyla 10 13 ve 10 12. Yakın morfolojik ilişki, glia ve nöronlar arasındaki fizyolojik ve patolojik etkileşimlerin temelini oluşturur. İlişkileri, dinamik nöronal-glial sinyalleşme süreçleri kavramıyla tanımlanır. Sinyalleri nöronlardan glia'ya ve dolayısıyla diğer nöronlara iletme yeteneği, hücreler arası "çapraz konuşma" için birçok seçeneğin önünü açıyor.
Nöroglia'nın birkaç türü vardır; CNS'de nöroglia, astrositler ve oligodendrositler tarafından ve PNS'de Schwann hücreleri ve uydu hücreleri tarafından temsil edilir. Ayrıca mikroglial hücreler ve ependimal hücreler merkezi glial hücreler olarak kabul edilir.
Astrositler(yıldız şeklinden dolayı adlandırılır) CNS nöronlarının etrafındaki mikro ortamı düzenler. Süreçleri, sonuç olarak komşu sinapslardan izole edilen sinaptik terminal grupları tarafından çevrelenmiştir. Özel süreçler - astrositlerin "bacakları", beyin ve omurilik yüzeyindeki (pia mater) kılcal damarlar ve bağ dokusu ile temaslar oluşturur (Şekil 1.8). Bacaklar, maddelerin merkezi sinir sistemine serbestçe yayılmasını sınırlar. Astrositler aktif olarak K+ ve nörotransmiterleri alıp daha sonra bunları metabolize edebilir. Astroglia, K+ iyonlarına karşı seçici olarak artan geçirgenlik sayesinde, nöronal metabolizmayı sürdürmek için gerekli olan enzimlerin aktivasyonunu ve ayrıca nöronal süreç sırasında salınan aracıları ve diğer ajanları ortadan kaldırır.
 Pirinç. 1.6. Nöronların hücre gövdesinden uzanan işlem sayısına göre sınıflandırılması.
Pirinç. 1.6. Nöronların hücre gövdesinden uzanan işlem sayısına göre sınıflandırılması.
A - iki kutuplu. B- yalancı tek kutuplu. İÇİNDE- çok kutuplu. 1 - dendritler; 2 - akson
 Pirinç. 1.7. Başlıca glial hücre türleri.
Pirinç. 1.7. Başlıca glial hücre türleri.
A- Protoplazmik astrosit. B- mikroglial hücre. İÇİNDE- oligoderdrosit. G- lifli astrosit
son aktivite. Astroglia, bağışıklık aracılarının sentezinde rol oynar: sitokinler, diğer sinyal molekülleri (siklik guanozin monofosfat - cOMP, nitrik oksit - NO), daha sonra nöronlara iletilir, - glial büyüme faktörlerinin sentezinde ( GDNF), Trofizme ve nöronların onarımına katılmak. Astrositler, nörotransmiterlerin sinaptik konsantrasyonundaki bir artışa ve hücre içi Ca2+ konsantrasyonundaki değişikliklerle nöronların elektriksel aktivitesindeki değişikliklere yanıt verebilir. Bu, astrositler arasında bir Ca2+ göçü "dalgası" yaratır ve bu, birçok nöronun durumunu modüle edebilir.
Böylece astroglia, sinir sisteminin yalnızca trofik bir bileşeni olmakla kalmayıp, sinir dokusunun spesifik işleyişine de katılır. Astrositlerin sitoplazmasında, merkezi sinir sistemi dokusunda mekanik destek işlevi gören glial filamentler bulunur. Hasar gördüğünde, glial filamentleri içeren astrosit süreçleri hipertrofiye uğrar ve bir glial yara izi oluşturur.
Ana işlev oligodendrositler miyelin kılıfını oluşturarak aksonların elektriksel yalıtımını sağlamaktır (Şekil 1.9). Aksonların plazma zarı üzerine sarmal olarak sarılmış çok katmanlı bir sargıdır. PNS'de miyelin kılıfı Schwann hücrelerinin zarları tarafından oluşturulur (bkz. Şekil 1.18). Miyelin temsil eder
Fosfolipidler açısından zengin spesifik plazma membranlarından oluşan bir pakettir ve aynı zamanda CNS ve PNS'de farklı olan çeşitli protein türlerini içerir. Protein yapıları plazma membranlarının birbirine sıkı bir şekilde sarılmasını sağlar. Glial hücre zarı büyüdükçe, nöronun aksonunun etrafında dönerek aksonun etrafında çift plazma membranlı katmanlı bir sarmal oluşturur. Miyelin kılıfının kalınlığı, aksonun elektriksel yalıtkanı rolünü oynayan, akson sitosol ile hücre dışı ortam arasındaki iyon değişimini önleyen 50-100 membran olabilir.
Buna ek olarak nöroglia, omurilik ve kraniyal sinir ganglionlarının nöronlarını kapsülleyen ve bu nöronların etrafındaki mikroçevreyi astrositlerin yaptığına benzer şekilde düzenleyen uydu hücreleri içerir (Şekil 1.10).
Başka bir hücre türü - mikroglia, veya gizli fagositler. Mikroglia, merkezi sinir sistemindeki bağışıklık sistemi yeterli hücrelerin tek temsilidir. İnsan beyin dokusunda yaygın olarak temsil edilir ve toplam glial popülasyonun gri maddede %9-12'sini, beyaz maddede ise %7,5-9'unu oluşturur. Astrositlerden farklı olarak mikroglial hücreler kök hücrelerden kaynaklanır ve normal koşullar altında dallanmıştır.
 Pirinç. 1.8. Astrositlerin çevredeki hücresel elementlerle etkileşimi.
Pirinç. 1.8. Astrositlerin çevredeki hücresel elementlerle etkileşimi.
1 - tanisit; 2 - ventriküler boşluk; 3 - ependimal hücreler; 4 - kılcal; 5 - nöron; 6 - miyelinli akson; 7 - pia mater; 8 - subaraknoid boşluk.
Şekilde iki astrosit ve bunların ventrikül, perikaryon, nöron dendritleri, kılcal damar ve pia mater'in skuamöz epitelini kaplayan ependimal hücrelerle ilişkileri gösterilmektedir. Bu şeklin şematik olduğunu ve nöronun hem ventrikül hem de subaraknoid boşlukla bağlantısının olası olmadığını belirtmekte fayda var.
 Pirinç. 1.9. Oligodendrosit: Aksonun miyelin kılıfının oluşumu. 1 - akson; 2 - miyelin; 3 - pürüzsüz endoplazmik retikulum; 4 - nörofilamentler; 5 - mitokondri
Pirinç. 1.9. Oligodendrosit: Aksonun miyelin kılıfının oluşumu. 1 - akson; 2 - miyelin; 3 - pürüzsüz endoplazmik retikulum; 4 - nörofilamentler; 5 - mitokondri
 Pirinç. 1.10. Glia hücreleri ve nöronlar arasındaki etkileşim. Şematik olarak oklarla gösterilmiştir. 1 - uydu glial hücresi; 2 - miyelini sentezleyen glial hücre
Pirinç. 1.10. Glia hücreleri ve nöronlar arasındaki etkileşim. Şematik olarak oklarla gösterilmiştir. 1 - uydu glial hücresi; 2 - miyelini sentezleyen glial hücre
birçok dalı olan kıvırcık şekil. Özellikle hipoksi iskemi koşulları altında mikroglia aktivasyonuna, toksik özelliklere sahip proinflamatuar medyatörlerin üretimi eşlik eder. Destekledikleri beyin dokusundaki kronik inflamatuar yanıt, gecikmiş nöron kayıplarına, mikro dolaşım bozukluklarına ve kan-beyin bariyerinin fonksiyonunda değişikliklere yol açar.
Patolojik koşullar altında, mikroglial hücreler süreçleri geri çeker ve fagositoz durumuna kadar belirgin fonksiyonel aktivasyonlarına karşılık gelen amipoid bir form alır. Beyin dokusu hasar gördüğünde mikroglia, kan dolaşımından merkezi sinir sistemine giren fagositlerle birlikte hücresel bozulma ürünlerinin uzaklaştırılmasına yardımcı olur.
Merkezi sinir sistemi dokusu, beynin ventriküllerini dolduran beyin omurilik sıvısından (BOS), ependimal hücrelerin oluşturduğu epitel ile ayrılır. Ependyma, beynin hücre dışı alanı ile BOS arasında birçok maddenin difüzyonuna izin verir. BOS, ventriküler sistemdeki koroid pleksusların özelleşmiş ependimal hücreleri tarafından salgılanır.
Beyin hücrelerine besin sağlanması ve hücre atık ürünlerinin uzaklaştırılması damar sistemi aracılığıyla gerçekleşir.
sistem. Sinir dokusu kılcal damarlar ve diğer kan damarlarıyla dolu olmasına rağmen kan-beyin bariyeri (BBB), birçok maddenin kan ve CNS dokusu arasındaki difüzyonunu sınırlar.
1.3. Nöronlar arasında bilginin elektriksel iletimi
Sinir sisteminin normal aktivitesi nöronların uyarılabilirliğine bağlıdır. Heyecanlanma- Bu, hücre zarlarının, iyonik iletkenlik ve zar potansiyelindeki spesifik değişikliklerle yeterli uyaranların etkisine yanıt verme yeteneğidir. Uyarma- yalnızca hücrenin sitoplazmik zarında meydana gelen ve her dokuya özgü bir işlevi tetikleyen, elektriksel durumundaki değişikliklerle karakterize edilen elektrokimyasal bir süreç. Böylece kas zarının uyarılması kasılmasına neden olur ve nöron zarının uyarılması aksonlar boyunca bir elektrik sinyalinin iletilmesine neden olur. Nöronlar yalnızca voltaj kontrollü değildir; İyon kanalları elektriksel bir uyarıcının etkisiyle düzenlenir, aynı zamanda kimyasal ve mekanik olarak da kontrol edilir.
Membran potansiyeli/zar geçirgenliği ile uyarı türü arasındaki ilişkide farklılıklar vardır. Elektriksel bir uyarıya maruz kalındığında olaylar zinciri şu şekildedir: uyaran (elektrik akımı) => zar potansiyelinde kayma (kritik bir potansiyele) => voltaj kapılı iyon kanallarının aktivasyonu => zarın iyonik geçirgenliğinde değişiklik => zar boyunca iyonik akımlarda değişiklik => zarda daha fazla kayma potansiyel (aksiyon potansiyeli oluşumu).
Tahriş edici bir kimyasal maddeye maruz kalındığında temelde farklı bir olaylar zinciri meydana gelir: uyaran (kimyasal madde) => uyarının ve kemo-kapılı iyon kanalı reseptörünün kimyasal bağlanması => ligand reseptör kompleksinin yapısında değişiklik ve reseptör-kapılı (kemo-kapılı) iyon kanallarının açılması => değişiklik zarın iyonik geçirgenliğinde => zar boyunca iyon akımlarında değişiklik => zar potansiyelinde kayma (örneğin, lokal potansiyel oluşumu).
Mekanik bir uyaranın etkisi altındaki olaylar zinciri öncekine benzer, çünkü bu durumda reseptörler de etkinleştirilir.
kapılı iyon kanalları: uyaran (mekanik stres) => membran geriliminde değişiklik => reseptör kontrollü (mekanik olarak kontrol edilen) iyon kanallarının açılması => membranın iyonik geçirgenliğinde değişiklik => membran boyunca iyonik akımlarda değişiklik => membran potansiyelinde kayma (oluşum) mekanik olarak indüklenen potansiyel).
Bir hücrenin pasif elektriksel özellikleri, zarının, sitoplazmasının ve dış ortamının elektriksel özellikleriyle ilgilidir. Bir hücre zarının elektriksel özellikleri onun kapasitif ve dirençli özellikleri tarafından belirlenir, çünkü lipit çift katmanı doğrudan hem kapasitöre hem de dirence benzetilebilir. Lipit çift katmanının ve gerçek zarın kapasitif özellikleri benzerdir, ancak direnç özellikleri, öncelikle iyon kanallarını oluşturan proteinlerin varlığı nedeniyle farklılık gösterir. Çoğu hücrede giriş direnci doğrusal olmayan bir davranış gösterir; bir yönde akan akım için bu direnç, ters yönde akan akımdan daha büyüktür. Asimetrinin bu özelliği aktif bir reaksiyonu yansıtır ve düzleştirme olarak adlandırılır. Membrandan akan akım, kapasitif ve dirençli bileşenler tarafından belirlenir. Direnç bileşeni iyonik akımın kendisini tanımlar, çünkü elektrik hücre içinde iyonlar tarafından taşınır. İyonların hücre içine veya dışına hareketi plazma zarı tarafından engellenir. Membran iyonlara karşı geçirimsiz bir lipit çift tabakası olduğundan dirence sahiptir. Bunun yerine membran, iyon kanallarından geçen iyonlar için bir miktar iletkenliğe sahiptir. İyonların serbest hareketinin engellenmesi nedeniyle hücrenin dışında ve içinde aynı iyonlar ancak farklı konsantrasyonlarda bulunur.
Maddelerin zardan hareketi için iki temel mekanizma vardır - basit difüzyon yoluyla (Şekil 1.11) ve ne zaman?
 Pirinç. 1.11. Maddelerin hücre zarından taşınması.
Pirinç. 1.11. Maddelerin hücre zarından taşınması.
A- Basit difüzyon. B- Kolaylaştırılmış difüzyon. İÇİNDE- aktif taşıma: 1- membran
Membranın içine yerleştirilmiş ve zar ötesi integral proteinleri temsil eden spesifik taşıyıcıların gücü. İkinci mekanizma, birincil aktif veya ikincil aktif olabilen kolaylaştırılmış difüzyon ve aktif iyon taşınmasını içerir.
Basit difüzyonla (bir taşıyıcının yardımı olmadan), suda çözünmeyen organik bileşikler ve gazlar (oksijen ve karbon dioksit), hücre zarının lipitlerinde çözülerek lipit çift katmanı boyunca taşınabilir; iyonlar Na + , Ca 2 + , K + , Cl - hücrelerin sitoplazmasını dış çevreye bağlayan hücre zarının iyon kanalları aracılığıyla (elektrokimyasal gradyan tarafından belirlenen ve daha yüksek bir elektrokimyasal potansiyelden yönlendirilen pasif iyon taşınması) daha küçük olanı: Na + iyonları için hücrenin içinde, Ca2+, Cl -, K+ iyonları için dışarı doğru); su moleküllerinin bir zardan geçmesi (ozmoz).
Spesifik taşıyıcıların yardımıyla, bir dizi bileşiğin enerjiden bağımsız kolaylaştırılmış difüzyonu meydana gelir (bkz. Şekil 1.11). Kolaylaştırılmış difüzyonun çarpıcı bir örneği, glikozun nöronal membran boyunca taşınmasıdır. Özel bir astrositik taşıyıcı olmadan glikozun nöronlara girişi, nispeten büyük bir polar molekül olduğundan neredeyse imkansız olurdu. Glikoz-6-fosfata hızlı dönüşümü nedeniyle, hücre içi glikoz seviyesi hücre dışı seviyeden daha düşüktür ve böylece glikozun nöronlara sürekli akışını sağlayacak bir gradyan korunur.
Na+, Ca2+, K+ ve H+ iyonlarının enerjiye bağlı birincil aktif taşınması, maddelerin elektrokimyasal gradyanlarına karşı enerjiye bağımlı transferidir (bkz. Şekil 1.11). Bu sayede hücreler, ortama göre daha yüksek konsantrasyonlarda iyon biriktirebilir. Düşük konsantrasyonlardan yüksek konsantrasyonlara doğru hareket ve sabit bir eğimin sürdürülmesi, yalnızca taşıma sürecine sürekli enerji sağlanmasıyla mümkündür. Birincil aktif taşıma sırasında ATP doğrudan tüketilir. ATP enerji pompaları (ATPazlar), iyonları konsantrasyon gradyanına karşı taşır. Moleküler organizasyonun özelliklerine bağlı olarak 3 sınıf ayırt edilir - P, V ve F (Şekil 1.12). Her üç ATPaz sınıfı da zarın sitozolik yüzeyinde bir veya daha fazla ATP bağlanma bölgesine sahiptir. Sınıf P, Ca 2+ -ATPase ve Na + /K + -ATPase'i içerir. Aktif iyon taşıma taşıyıcıları taşınan maddeye özeldir ve doyurulabilir; taşınan madde için tüm spesifik bağlanma bölgeleri dolduğunda akışları maksimumdur.
Pasif iyon taşınması için gerekli bir koşul olan hücrenin elektrokimyasal potansiyelinin birçok gradyanı, aktif taşınmanın bir sonucu olarak ortaya çıkar. Böylece, Na + /K + - pompası tarafından aktif transferlerinin bir sonucu olarak K + ve Na + gradyanları ortaya çıkar (Şekil 1.13). Hücre içindeki Na + /K + pompasının aktivitesi nedeniyle, K + iyonları daha yüksek konsantrasyonlarda bulunur, ancak bir konsantrasyon gradyanı boyunca hücre dışı ortama difüzyon yoluyla geçme eğilimindedirler. Hücre içindeki pozitif ve negatif yüklerin eşitliğini sağlamak için, K+ iyonlarının dış ortama salınımının hücre içine Na+ iyonlarının girişi ile telafi edilmesi gerekir. Dinlenme halindeki zar, Na + iyonlarına K + iyonlarına göre çok daha az geçirgen olduğundan, potasyumun hücreyi bir konsantrasyon gradyanı boyunca terk etmesi gerekir. Sonuç olarak, zarın dışında pozitif bir yük, iç kısmında ise negatif bir yük birikir. Bu, zarın dinlenme potansiyelini korur.
Bir dizi iyon ve molekülün ikincil aktif taşınması, ATP tüketiminin bir sonucu olarak biriken ve bir konsantrasyon gradyanı oluşturmak için harcanan enerjiyi de kullanır. Membrana göre iyon konsantrasyonu gradyanı, birincil aktif taşıma tarafından oluşturulan bir enerji kaynağı olarak kullanılır (Şekil 1.14). Bu nedenle, ikincil aktif taşıma, ortak taşıma ve karşı taşımayı içerir: iyonların daha yüksek (daha yüksek enerji durumu) konsantrasyonundan daha düşük (düşük enerji durumu) konsantrasyonuna akışı, aktif olarak taşınan maddeyi düşük konsantrasyonlu bir alandan daha yüksek bir alana taşımak için enerji sağlar. yüksek konsantrasyon.
 Pirinç. 1.12. ATP'ye bağımlı iyon pompalarının üç sınıfı. A- P sınıfı. B- F 1 sınıfı İÇİNDE- V 1 sınıfı
Pirinç. 1.12. ATP'ye bağımlı iyon pompalarının üç sınıfı. A- P sınıfı. B- F 1 sınıfı İÇİNDE- V 1 sınıfı
Pasif iyon taşınmasıyla belirlenen hücre potansiyelleri
Eşik altı, eşiğe yakın ve eşik elektrik akımı darbelerine yanıt olarak sırasıyla pasif bir elektrotonik potansiyel, yerel bir yanıt ve bir aksiyon potansiyeli meydana gelir (Şekil 1.15). Tüm bu potansiyeller membran boyunca pasif iyon taşınmasıyla belirlenir. Bunların oluşması, hücre dışı (genellikle sinir liflerinde gözlenir) ve hücre içi (genellikle hücre gövdesinde gözlenir) meydana gelebilen hücre zarının polarizasyonunu gerektirir.
Pasif elektrotonik potansiyelİyon kanallarının açılmasına yol açmayan ve yalnızca hücre zarının kapasitif ve dirençli özellikleriyle belirlenen eşik altı bir darbeye yanıt olarak oluşur. Pasif elektrotonik potansiyel, zarın pasif özelliklerini yansıtan bir zaman sabiti ile karakterize edilir; zar potansiyelindeki değişikliklerin zaman süreci, yani. bir değerden diğerine geçerken değişme hızı. Geçmek-
 Pirinç. 1.13. Na + /K + pompasının çalışma mekanizması
Pirinç. 1.13. Na + /K + pompasının çalışma mekanizması
 Pirinç. 1.14.İkincil aktif taşımanın çalışma mekanizması. A- 1. Aşama. B- 2. aşama. İÇİNDE- Aşama 3: 1 - Na+; 2 - konsantrasyon gradyanına karşı aktarılması gereken bir maddenin molekülü; 3 - konveyör. Na+ taşıyıcıya bağlandığında, taşınan madde molekülü için taşıyıcı proteinin bağlanma merkezinde allosterik değişiklikler meydana gelir, bu da taşıyıcı proteinde konformasyonel değişikliklere neden olarak Na+ iyonlarının ve bağlı maddenin zarın diğer tarafından çıkmasına izin verir.
Pirinç. 1.14.İkincil aktif taşımanın çalışma mekanizması. A- 1. Aşama. B- 2. aşama. İÇİNDE- Aşama 3: 1 - Na+; 2 - konsantrasyon gradyanına karşı aktarılması gereken bir maddenin molekülü; 3 - konveyör. Na+ taşıyıcıya bağlandığında, taşınan madde molekülü için taşıyıcı proteinin bağlanma merkezinde allosterik değişiklikler meydana gelir, bu da taşıyıcı proteinde konformasyonel değişikliklere neden olarak Na+ iyonlarının ve bağlı maddenin zarın diğer tarafından çıkmasına izin verir.
Güçlü bir elektrotonik potansiyel, üstel artış ve azalma oranlarındaki eşitlik ile karakterize edilir. Elektriksel uyarının genlikleri ile pasif elektrotonik potansiyel arasında doğrusal bir ilişki vardır ve darbe süresinin arttırılması bu düzeni değiştirmez. Pasif elektrotonik potansiyel, membranın sabit uzunluğu tarafından belirlenen zayıflama ile akson boyunca yayılır.
Elektriksel darbenin gücü bir eşik değerine yaklaştığında, yerel membran tepkisi bu, pasif elektrotonik potansiyelin şeklindeki bir değişiklik ve S şeklinde bir eğri şeklinde bağımsız bir küçük genlik tepe noktasının gelişmesiyle kendini gösterir (bkz. Şekil 1.15). Yerel bir yanıtın ilk işaretleri, eşik değerinin yaklaşık %75'ini oluşturan uyaranların etkisi altında kaydedilir. Tahriş edici akım arttıkça, yerel tepkinin genliği doğrusal olmayan bir şekilde artar ve yalnızca kritik potansiyele ulaşmakla kalmaz, aynı zamanda onu da aşabilir, ancak bir aksiyon potansiyeline dönüşmez. Lokal bir tepkinin bağımsız gelişimi, bir eşik uyarısında aksiyon potansiyelinin depolarizasyon fazına neden olan gelen bir akımı sağlayan sodyum kanalları yoluyla zarın sodyum geçirgenliğindeki bir artışla ilişkilidir. Ancak eşik altı bir uyarıyla geçirgenlikteki bu artış, sodyum kanallarının yalnızca küçük bir kısmı açıldığı için rejeneratif membran depolarizasyon sürecini tetiklemek için yeterli değildir. De-
 Pirinç. 1.15. Hücre zarı potansiyelleri.
Pirinç. 1.15. Hücre zarı potansiyelleri.
A- Depolarize edici elektrik akımı darbesinin gücüne bağlı olarak membran potansiyelindeki değişikliklerin dinamiği. B- Depolarizasyon dürtüsünün gücünde belirgin artış
kutuplaşma durur. K+ iyonlarının hücreden salınması sonucunda potansiyel dinlenme potansiyeli düzeyine döner. Aksiyon potansiyelinin aksine, yerel yanıtın net bir oluşum eşiği yoktur ve "ya hep ya hiç" yasasına uymaz: elektriksel dürtünün gücü arttıkça, yerel yanıtın genliği de artar. Vücutta lokal bir tepki, lokal uyarılmanın elektrofizyolojik ifadesidir ve genellikle bir aksiyon potansiyelinden önce gelir. Bazen yerel tepki, bağımsız olarak uyarıcı postsinaptik potansiyel şeklinde var olabilir. Lokal potansiyelin bağımsız öneminin örnekleri, retinanın amakrin hücrelerinden (aksonlardan yoksun merkezi sinir sistemi nöronları) sinaptik uçlara uyarımın iletilmesinin yanı sıra kimyasal bir sinapsın postsinaptik zarının tepkisidir. Sinaptik potansiyeller oluşturan sinir hücreleri arasında iletişimsel bilgi aktarımı.
Tahriş edici bir elektriksel darbenin eşik değerinde, Aksiyon potansiyeli, depolarizasyon ve repolarizasyon aşamalarından oluşur (Şekil 1.16). Aksiyon potansiyeli, kare elektrik akımı darbesinin etkisi altında dinlenme potansiyelinden (örneğin -90 mV'den) kritik potansiyel seviyesine (farklı hücre tipleri için farklı) yer değiştirmenin bir sonucu olarak başlar. Depolarizasyon aşaması, tüm voltaj kapılı sodyum kanallarının aktivasyonuna ve ardından
 Pirinç. 1.16. Nöron zarı potansiyelindeki değişiklikler (A) ve iyonların plazmalemma yoluyla iletkenliği (B) Bir aksiyon potansiyeli oluştuğunda. 1 - hızlı depolarizasyon; 2 - aşım; 3 - repolarizasyon; 4 - eşik potansiyeli; 5 - hiperpolarizasyon; 6 - dinlenme potansiyeli; 7 - yavaş depolarizasyon; 8 - aksiyon potansiyeli; 9 - sodyum iyonları için geçirgenlik; 10 - potasyum iyonları için geçirgenlik.
Pirinç. 1.16. Nöron zarı potansiyelindeki değişiklikler (A) ve iyonların plazmalemma yoluyla iletkenliği (B) Bir aksiyon potansiyeli oluştuğunda. 1 - hızlı depolarizasyon; 2 - aşım; 3 - repolarizasyon; 4 - eşik potansiyeli; 5 - hiperpolarizasyon; 6 - dinlenme potansiyeli; 7 - yavaş depolarizasyon; 8 - aksiyon potansiyeli; 9 - sodyum iyonları için geçirgenlik; 10 - potasyum iyonları için geçirgenlik.
İyon iletkenlik eğrileri aksiyon potansiyeli eğrisiyle ilişkilidir
Bunun sonucunda Na+ iyonlarının hücre içerisine pasif taşınması artar ve membran potansiyelinde 35 mV'a kadar bir kayma meydana gelir (bu tepe seviyesi farklı hücre tipleri için farklıdır). Aksiyon potansiyelinin sıfır çizgisinin üzerindeki fazlalığına aşma denir. Zirveye ulaşıldığında potansiyel değeri negatif bölgeye düşerek dinlenme potansiyeline ulaşır (repolarizasyon aşaması). Repolarizasyon, voltaj kapılı sodyum kanallarının inaktivasyonu ve voltaj kapılı potasyum kanallarının aktivasyonuna dayanmaktadır. K+ iyonları pasif taşıma yoluyla hücreyi terk eder ve ortaya çıkan akım, membran potansiyelinin negatif bölgeye kaymasına neden olur. Repolarizasyon fazı, sonraki bir hiperpolarizasyon veya bunu takip eden bir depolarizasyon ile sona erer; membran potansiyelini dinlenme potansiyeli seviyesine döndürmek için alternatif iyonik mekanizmalar (bkz. Şekil 1.16). Birinci mekanizma ile repolarizasyon dinlenme değerine ulaşır ve daha negatif bir bölgeye doğru devam eder, ardından dinlenme potansiyeli seviyesine geri döner (iz hiperpolarizasyon); ikincisinde, repolarizasyon yavaş yavaş gerçekleşir ve dinlenme potansiyeline sorunsuz bir şekilde geçiş yapar (iz depolarizasyonu). Aksiyon potansiyelinin gelişimine, artan uyarılabilirlikten mutlak ve göreceli refrakterliğe kadar hücre uyarılabilirliğindeki faz değişiklikleri eşlik eder.
Nöronların biyoelektrik aktivitesi
Birinci tür biyoelektrik hücre aktivitesi, bağımsız olarak aksiyon potansiyeli üretemeyen sessiz nöronlarda bulunur. Bu hücrelerin dinlenme potansiyeli değişmez (Şekil 1.17).
İkinci tip nöronlar bağımsız olarak aksiyon potansiyelleri üretme yeteneğine sahiptir. Bunlar arasında, düzenli ve düzensiz ritmik veya patlama (bir patlama birkaç aksiyon potansiyelinden oluşur, ardından kısa bir dinlenme periyodu gözlemlenir) aktivitesi üreten hücreler ayırt edilir.
Üçüncü tip biyoelektrik aktivite, kritik potansiyele ulaşmayan sinüzoidal veya testere dişi şeklindeki dinlenme potansiyelinde bağımsız olarak dalgalanmalar oluşturabilen nöronları içerir. Yalnızca nadir salınımlar eşiğe ulaşabilir ve tek aksiyon potansiyellerinin oluşmasına neden olabilir. Bu nöronlara kalp pili nöronları denir (Şekil 1.17).
Bireysel nöronların "davranışı" ve nöronlar arası etkileşimler, postsinaptik hücre zarlarının uzun vadeli polarizasyonundan (depolarizasyon veya hiperpolarizasyon) etkilenir.
Nöronların sürekli depolarize edici bir elektrik akımıyla uyarılması, aksiyon potansiyellerinin ritmik deşarjları ile tepkilere neden olur. Membranın uzun süreli depolarizasyonunun sona ermesinden sonra, aktivasyon sonrası inhibisyon Hücrenin aksiyon potansiyelleri oluşturamadığı durum. Aktivasyon sonrası inhibisyon aşamasının süresi doğrudan uyarıcı akımın genliği ile ilişkilidir. Daha sonra hücre yavaş yavaş potansiyel üretmenin olağan ritmine geri döner.
Aksine, sürekli bir hiperpolarize edici akım, spontan aktiviteye sahip nöronlar açısından özellikle önemli olan aksiyon potansiyelinin gelişimini engeller. Hücre zarının hiperpolarizasyonundaki bir artış, spike aktivitesinin frekansında bir azalmaya ve her bir aksiyon potansiyelinin genliğinde bir artışa yol açar; bir sonraki aşama potansiyel üretiminin tamamen durdurulmasıdır. Membranın uzun süreli hiperpolarizasyonunun sona ermesinden sonra faz başlar engelleme sonrası aktivasyon, Bir hücre kendiliğinden normalden daha yüksek bir frekansta aksiyon potansiyelleri üretmeye başladığında. Aktivasyon sonrası aşamanın süresi doğrudan hiperpolarize edici akımın genliği ile ilişkilidir, bundan sonra hücre yavaş yavaş potansiyel üretimin olağan ritmini geri kazanır.
 Pirinç. 1.17. Sinir hücrelerinin biyoelektrik aktivite türleri
Pirinç. 1.17. Sinir hücrelerinin biyoelektrik aktivite türleri
1.4. Sinir lifi boyunca uyarının iletilmesi
Sinir lifleri boyunca uyarılmanın iletim modelleri, aksonların hem elektriksel hem de morfolojik özellikleri tarafından belirlenir. Sinir gövdeleri miyelinli ve miyelinsiz liflerden oluşur. Miyelinsiz sinir lifinin zarı dış ortamla doğrudan temas halindedir; Hücre içi ve hücre dışı ortam arasındaki iyon değişimi miyelinsiz lifin herhangi bir noktasında gerçekleşebilir. Miyelinli sinir lifi daha uzun bir süre boyunca yalıtkan görevi gören yağlı (miyelin) bir kılıfla kaplanmıştır (bkz. Şekil 1.18).
Bir glial hücreden gelen miyelin, başka bir glial hücrenin oluşturduğu bir sonraki bölgeden, miyelinsiz bir bölgeden - Ranvier düğümünden ayrılan, miyelinli sinir lifinin bir bölgesini oluşturur (Şekil 1.19). Ranvier düğümünün uzunluğu sadece 2 µm'dir ve bitişik Ranvier düğümleri arasındaki miyelinli lif bölümünün uzunluğu 2000 µm'ye ulaşır. Ranvier düğümleri tamamen miyelin içermez ve hücre dışı sıvıyla temas edebilir; miyelinli sinir lifinin elektriksel aktivitesi, iyonların nüfuz edebildiği Ranvier düğümlerinin zarı ile sınırlıdır. Membranın bu alanları, voltaj kapılı sodyum kanallarının en yüksek yoğunluğunu içerir.
Pasif elektrotonik potansiyel sinir lifi boyunca kısa mesafelerde yayılır (Şekil 1.20), amplifikasyonu ise
 Pirinç. 1.18. Periferik sinir lifinin miyelinasyon şeması. A- Miyelinasyonun aşamaları. a - akson, bir Schwann hücresi süreci tarafından yakalanır; b - aksonun etrafını saran bir Schwann hücresi süreci; c - Schwann hücresi sitoplazmasının çoğunu kaybederek akson etrafında katmanlı bir zara dönüşür. B- Schwann hücre süreçleriyle çevrili miyelinsiz aksonlar
Pirinç. 1.18. Periferik sinir lifinin miyelinasyon şeması. A- Miyelinasyonun aşamaları. a - akson, bir Schwann hücresi süreci tarafından yakalanır; b - aksonun etrafını saran bir Schwann hücresi süreci; c - Schwann hücresi sitoplazmasının çoğunu kaybederek akson etrafında katmanlı bir zara dönüşür. B- Schwann hücre süreçleriyle çevrili miyelinsiz aksonlar
 Pirinç. 1.19. Ranvier düğümünün yapısı.
Pirinç. 1.19. Ranvier düğümünün yapısı.
1 - aksonun plazma zarı;
2 - miyelin zarları; 3 - bir Schwann hücresinin sitozolü; 4 - Ranvier müdahale bölgesi; 5 - Schwann hücresinin plazma zarı
orada, yükselme ve düşme hızı mesafeyle birlikte azalır (uyarma azalması olgusu). Bir aksiyon potansiyeli biçiminde uyarımın yayılmasına, potansiyelin şeklinde veya genliğinde bir değişiklik eşlik etmez, çünkü eşik depolarizasyonunda, pasif bir elektrotonik potansiyelin yayılması sırasında meydana gelmeyen, voltaj kapılı iyon kanalları etkinleştirilir. . Aksiyon potansiyelinin yayılma süreci, sinir lifi zarının pasif (kapasitans, direnç) ve aktif (voltaj kapılı kanalların aktivasyonu) özelliklerine bağlıdır.
Aksonun hem iç hem de dış ortamı iyi iletkenlerdir. Akson zarı, yalıtım özelliklerine rağmen iyon "sızıntı" kanallarının varlığı nedeniyle akımı da iletebilir. Miyelinsiz bir lif uyarıldığında, uyarı bölgesinde voltaj kapılı sodyum kanalları açılır, bu da içe doğru bir akımın oluşmasına ve aksonun bu kısmında aksiyon potansiyelinin depolarizasyon fazının oluşmasına neden olur. Gelen Na + akımı, zarın depolarize ve depolarize olmayan bölgeleri arasında yerel akım döngülerine neden olur. Açıklanan mekanizma sayesinde miyelinsiz bir lifte aksiyon potansiyeli, uyarılma bölgesinden her iki yönde yayılır.
Miyelinli sinir liflerinde aksiyon potansiyelleri yalnızca Ranvier düğümlerinde üretilir. Miyelin kılıfının kapladığı alanların elektriksel direnci yüksektir ve aksiyon potansiyeli oluşturmak için gerekli olan yerel dairesel akımların gelişmesine izin vermez. Uyarım miyelinli lif boyunca yayıldığında, sinir impulsu bir Ranvier düğümünden diğerine atlar (saltatuar iletim) (bkz. Şekil 1.20). Bu durumda aksiyon potansiyeli, miyelinsiz bir lifte olduğu gibi tahriş bölgesinden her iki yönde de yayılabilir. Saltatory iletim
 Pirinç. 1.20. Bir sinir lifi boyunca elektriksel potansiyelin yayılımını gösteren diyagram.
Pirinç. 1.20. Bir sinir lifi boyunca elektriksel potansiyelin yayılımını gösteren diyagram.
A- Miyelinsiz bir akson boyunca aksiyon potansiyelinin yayılması: a - dinlenme halindeki akson; b - aksiyon potansiyelinin başlatılması ve yerel akımların ortaya çıkması; c - yerel akımların yayılması; d - aksiyon potansiyelinin akson boyunca yayılması. B- Aksiyon potansiyelinin nöron gövdesinden terminal ucuna kadar yayılması. B- Miyelinli lifler boyunca impulsların sıçramalı iletimi. Ranvier düğümleri aksonun miyelin kılıfının bölümlerini ayırır
İmpulsun genişlemesi, miyelinsiz lifle karşılaştırıldığında 5-50 kat daha yüksek bir uyarılma hızı sağlar. Ek olarak, akson zarının yalnızca Ranvier düğümünde lokal depolarizasyonu, miyelinsiz bir fiberde lokal akımların oluşmasından 100 kat daha az iyon kaybına yol açtığından daha ekonomiktir. Ek olarak, atlamalı iletim sırasında voltaj kapılı potasyum kanalları minimum düzeyde etkilenir, bunun sonucunda miyelinli liflerin aksiyon potansiyelleri sıklıkla bir eser hiperpolarizasyon fazına sahip değildir.
Sinir lifi boyunca uyarılmanın iletilmesine ilişkin yasalar Birinci yasa: Bir sinir lifi tahriş olduğunda sinir boyunca uyarım her iki yönde de yayılır.
İkinci yasa: Uyarımın her iki yönde yayılması aynı hızda gerçekleşir.
Üçüncü yasa: uyarılma, zayıflama veya azalma olmaksızın sinir boyunca yayılır. Dördüncü Kanun: Bir sinir lifi boyunca uyarımın iletilmesi ancak anatomik ve fizyolojik olarak sağlam olması durumunda mümkündür. Sinir lifinin yüzey zarında meydana gelen herhangi bir yaralanma (kesinti, iltihaplanma nedeniyle sıkışma ve çevre dokuların şişmesi) uyarının iletimini bozar. İletim aynı zamanda lifin fizyolojik durumu değiştiğinde de bozulur: iyon kanallarının bloke edilmesi, soğuması vb.
Beşinci Kanun: sinir lifleri boyunca yayılmanın uyarılması izole edilir, yani. bir liften diğerine geçmez, ancak yalnızca belirli bir sinir lifinin uçlarının temas halinde olduğu hücreleri uyarır. Periferik sinirin genellikle birçok farklı lif (motor, duyusal, otonomik) içermesi, farklı organ ve dokuları innerve etmesi ve farklı işlevleri yerine getirmesi nedeniyle, her lif boyunca izole iletim özellikle önemlidir.
Altıncı Kanun: sinir lifi yorulmaz; Fiberin aksiyon potansiyeli çok uzun süre aynı genliğe sahiptir.
Yedinci Kanun: Farklı sinir liflerinde uyarılma hızı farklıdır ve hücre içi ve hücre dışı ortamın, akson zarının elektriksel direncinin yanı sıra sinir lifinin çapı tarafından belirlenir. Fiber çapı arttıkça stimülasyon hızı da artar.
Sinir liflerinin sınıflandırılması
Sinir lifleri boyunca uyarılma hızına, aksiyon potansiyeli fazlarının süresine ve yapısal özelliklere bağlı olarak üç ana sinir lifi türü ayırt edilir: A, B ve C.
Tüm A tipi lifler miyelinlidir; 4 alt gruba ayrılırlar: α, β, γ ve δ. αA lifleri en büyük çapa sahiptir (12-22 µm), bu da içlerindeki yüksek uyarılma hızını (70-170 m/s) belirler. İnsanlarda αA lifleri, omuriliğin ön boynuzlarındaki motor nöronlardan iskelet kaslarına ve ayrıca proprioseptif kas reseptörlerinden merkezi sinir sisteminin duyu merkezlerine uyarımı iletir.
Diğer lifler A tipi(β, γ ve δ) daha küçük bir çapa, daha yavaş bir iletim hızına ve daha uzun bir aksiyon potansiyeline sahiptir. Bu lif grupları ağırlıklı olarak merkezi sinir sistemindeki çeşitli reseptörlerden uyarıları ileten duyusal lifleri içerir; Bunun istisnası, omuriliğin ön boynuzlarındaki γ-nöronlarından intrafüzal kas liflerine uyarımı ileten γA lifleridir.
Lifler B tipi ayrıca miyelinlidir ve esas olarak otonom sinir sisteminin preganglionik liflerine aittir. Bunlar boyunca iletim hızı 3-18 m/s'dir, aksiyon potansiyelinin süresi A tipi liflerinkinden neredeyse 3 kat daha fazladır.İz depolarizasyon aşaması bu liflerin özelliği değildir.
Lifler C tipi miyelinsizdir, küçük bir çapa (yaklaşık 1 µm) ve düşük bir uyarılma hızına (3 m/s'ye kadar) sahiptir. C tipi liflerin çoğu sempatik sinir sisteminin postganglionik lifleridir; bazı C tipi lifler ise ağrı, sıcaklık ve diğer reseptörlerden uyarıların iletilmesinde rol oynar.
1.5. Kodlama
Akson boyunca şu ya da bu şekilde iletilen bilgiler kodlanır. Belirli bir işlevi (örneğin, belirli bir duyusal yöntem) sağlayan bir nöron topluluğu, bir projeksiyon yolu (ilk kodlama yöntemi) oluşturur. Dolayısıyla görsel yol, retinadaki nöronları, talamusun lateral genikulat gövdesini ve serebral korteksin görsel alanlarını içerir. Görsel sinyalleri ileten aksonlar optik sinirin, optik sistemin ve optik radyasyonun bir parçasıdır. Görme sisteminin aktivasyonuna yönelik fizyolojik uyarı, retinaya giren ışıktır. Retinal nöronlar bu bilgiyi dönüştürür ve sinyali görsel yol boyunca iletir. Bununla birlikte, görsel yoldaki nöronların mekanik veya elektriksel olarak uyarılmasıyla, kural olarak çarpık olmasına rağmen görsel bir his de ortaya çıkar. Böylece görsel sistemin nöronları, aktivasyonu üzerine görsel duyumun ortaya çıktığı bir projeksiyon yolu oluşturur. Motor yolları aynı zamanda projeksiyon yapılarını da temsil eder. Örneğin beyin korteksindeki bazı nöronlar aktive edildiğinde, el kaslarının motor nöronlarında deşarjlar oluşur ve bu kaslar kasılır.
İkinci kodlama yöntemi, merkezi sinir sisteminin düzenli mekansal (somatotopik) organizasyonu prensibi ile belirlenir. Somatotopik haritalar duyusal ve motor sistemlerdeki belirli nöron grupları tarafından derlenir. Bu nöron grupları, öncelikle vücut yüzeyinin uygun şekilde lokalize edilmiş alanlarından bilgi alır ve ikinci olarak vücudun belirli bölgelerine motor komutları gönderir. Görme sisteminde, retinanın alanları serebral kortekste retinotopik haritalar oluşturan nöron grupları tarafından temsil edilir. İşitsel sistemde seslerin frekans özellikleri tonotopik haritalara yansıtılır.
Bilgiyi kodlamanın üçüncü yöntemi, sinir uyarılarının dizilerinin (serilerinin) özelliklerinin değiştirilmesine dayanır.
Bir sonraki nöron grubuna sinaptik iletimin bir sonucu olarak düzenlenirken, kodlama mekanizması sinir uyarılarının boşaltılmasının geçici olarak düzenlenmesidir. Bu tür kodlamanın farklı türleri mümkündür. Çoğunlukla kod ortalama ateşleme hızıdır: Birçok duyu sisteminde, uyaran yoğunluğundaki bir artışa duyu nöronlarının ateşleme hızındaki bir artış eşlik eder. Ek olarak kod, deşarjın süresi, deşarjdaki çeşitli darbe grupları, yüksek frekanslı darbe patlamalarının süresi vb. olabilir.
1.6. Hücreler arasında uyarımın yapılması.
Sinir hücreleri arasındaki ilişkiler nöronlar arası temaslar veya sinapslar yoluyla gerçekleştirilir. Bir dizi aksiyon potansiyeli formundaki bilgi, birinci (presinaptik) nörondan ikinciye (postsinaptik) ya komşu hücreler arasında yerel bir akım oluşturarak (elektriksel sinapslar) ya da dolaylı olarak kimyasallar - aracılar, nörotransmiterler (kimyasal sinapslar) aracılığıyla gelir. veya her iki mekanizma aracılığıyla (karma sinapslar). Hızlı sinyal iletimi elektriksel sinapslarla, daha yavaş ise kimyasal sinapslarla gerçekleştirilir.
Tipik sinapslar, bir nöronun akson terminalleri ve diğerinin dendritleri (aksodendritik sinapslar) tarafından oluşturulan oluşumlardır. Ek olarak aksosomatik, akso-aksonal ve dendrodendritik sinapslar da vardır (Şekil 1.21). Bazı asosiasyon nöronlarının çeşitli sinaptik bağlantıları vardır (Şekil 1.22). Bir motor nöron aksonu ile iskelet kası lifi arasındaki sinapsa motor uç plakası veya nöromüsküler kavşak adı verilir.
sen elektriksel sinaps(Şekil 1.23) komşu nöronların hücre zarları birbirine çok yakındır, aralarındaki boşluk yaklaşık 2 nm'dir. Komşu hücrelerin zarlarının boşluk bağlantısını oluşturan alanları, temasın merkezinde su dolu bir gözenek oluşacak şekilde düzenlenmiş 6 alt birimden (konneksonlar) oluşan spesifik protein kompleksleri içerir. Birbirine yaslanan komşu hücrelerin zarlarının bağlantıları, aralarındaki mesafe yaklaşık 8 nm olan açık bir bağlantı - "kanallar" oluşturur.
 Pirinç. 1.21. Başlıca sinaps türleri.
Pirinç. 1.21. Başlıca sinaps türleri.
A- a - elektriksel sinaps; b - elektron yoğun kesecikler içeren dikenli sinaps; V- "tr geçen"-sinaps veya sinaptik "tomurcuk"; d - aksonun ilk kısmında bulunan inhibitör sinaps (elipsoidal kesecikler içerir); d - dendritik omurga; e - dikenli sinaps; g - inhibitör sinaps; h - akso-aksonal sinaps; ve - karşılıklı sinaps; k - uyarıcı sinaps. B- Atipik sinapslar: 1 - akso-aksonal sinaps. Bir aksonun sonu diğerinin aktivitesini düzenleyebilir; 2 - dendrodendritik sinaps; 3 - somasomatik sinaps
Elektriksel sinapslar çoğunlukla gelişimin embriyonik aşamasında oluşur, yetişkinlerde sayıları azalır. Bununla birlikte, yetişkin vücudunda bile, retinanın glial hücreleri ve amakrin hücreleri için elektriksel sinapsların önemi devam etmektedir; elektriksel sinapslar beyin sapında, özellikle alt zeytinlerde, retinada ve vestibüler köklerde bulunabilir.
Presinaptik membranın depolarizasyonu, depolarize olmayan postsinaptik membran ile potansiyel farkının oluşmasına yol açar. Sonuç olarak, konneksonların oluşturduğu kanallar aracılığıyla, pozitif iyonların potansiyel fark gradyanı boyunca postsinaptik hücreye hareketi veya anyonların ters yönde hareketi başlar. Postsinaptik membrana ulaşıldığında
 Pirinç. 1.22.Çoklu sinaptik bağlantılara sahip ilişkisel bir nöron.
Pirinç. 1.22.Çoklu sinaptik bağlantılara sahip ilişkisel bir nöron.
1 - akson tepeciği, aksona dönüşüyor; 2 - miyelin kılıfı; 3 - aksodendritik sinaps; 4 - çekirdek; 5 - dendrit; 6 - aksosomatik sinaps
 Pirinç. 1.23. Bir elektriksel sinapsın yapısı.
Pirinç. 1.23. Bir elektriksel sinapsın yapısı.
A- Komşu hücrelerin zarlarının bölümleri arasındaki boşluk kavşağı. B- Komşu hücrelerin zarlarının bağlantıları nöronlar arası bir “kanal” oluşturur. 1 - protein kompleksi; 2 - iyon kanalı. 3 - kanal; 4 - bağlantı hücresi 1; 5 - her altı alt birim; 6 - bağlantı hücresi 2
Eşik değerinin toplam depolarizasyonu bir aksiyon potansiyeli üretir. Bir elektriksel sinapsta iyonik akımların minimum 10-5 saniyelik bir zaman gecikmesiyle ortaya çıktığına dikkat etmek önemlidir; bu, bir boşluk bağlantısıyla bağlanan çok sayıda hücrenin bile tepkisinin yüksek senkronizasyonunu açıklar. Akımın bir elektriksel sinaps yoluyla iletilmesi de her iki yönde de mümkündür (kimyasal sinapsın aksine).
Elektriksel sinapsların işlevsel durumu, Ca2+ iyonları ve hücre zarı potansiyelinin seviyesi tarafından düzenlenir; bu, uyarılmanın sona ermesine kadar yayılmasını etkilemek için koşullar yaratır. Elektriksel sinapsların aktivitesinin özellikleri arasında, uyarılmanın uzaktaki hücrelere doğrudan aktarılmasının imkansızlığı yer alır, çünkü sadece birkaç tanesi doğrudan uyarılmış hücreye bağlıdır; presinaptik ve postsinaptik hücrelerdeki uyarılma düzeyi aynıdır; yayılmayı yavaşlatmak
uyarılma imkansızdır ve bu nedenle yetişkin beyninden önemli ölçüde daha fazla elektriksel sinaps içeren yenidoğanların ve küçük çocukların beyni, elektriksel süreçler için çok daha uyarılabilir hale gelir: hızla yayılan elektriksel uyarım, engelleyici düzeltmeye tabi değildir ve neredeyse anında olur genelleştirilmiş, bu da onu özel bir güvenlik açığı ve paroksismal aktivitenin gelişimine duyarlılığını açıklıyor.
Bazı demiyelinizan polinöropati formlarında, bir sinir gövdesinin parçası olan aksonların birbirleriyle yakın temasa geçerek, aksiyon potansiyelini "atlamanın" mümkün olduğu patolojik bölgeler (efaplar) oluşturduğuna dikkat edilmelidir. bir akson diğerine. Sonuç olarak, beyindeki "sözde bilginin" alındığını yansıtan semptomlar ortaya çıkabilir - periferik ağrı reseptörlerinin tahrişi olmadan ağrı hissi, vb.
Kimyasal sinaps ayrıca presinaptikten postsinaptik hücreye bir elektrik sinyali iletir, ancak burada postsinaptik membran üzerindeki iyon kanalları, presinaptik membrandan salınan kimyasal taşıyıcılar (vericiler, nörotransmiterler) tarafından açılır veya kapatılır (Şekil 1.24). Belirli iyonları postsinaptik membrandan iletme yeteneğinin değiştirilmesi, kimyasal sinapsların işleyişinin temelini oluşturur. İyonik akımlar postsinaptik membranın potansiyelini değiştirir, yani. postsinaptik potansiyelin gelişmesine neden olur. Bir nörotransmiterin etkisi altında hangi iyon iletkenliğinin değiştiğine bağlı olarak, etkisi inhibitör (ek olarak giden K+ iyonları akımı veya gelen C1 - iyonları akımı nedeniyle postsinaptik membranın hiperpolarizasyonu) veya uyarıcı (postsinaptik membranın depolarizasyonu) olabilir. Ca2+ iyonlarının veya Na+'nın ilave gelen akımı nedeniyle).
Sinapsta (Şekil 1.25), presinaptik vezikülleri (veziküller) ve postsinaptik kısmı (dendrit, hücre gövdesi veya akson) içeren presinaptik bir süreç ayırt edilir. Presinaptik sinir ucunda nörotransmiterler veziküllerde birikir. Sinaptik veziküller, her vezikülün sitoplazmik yüzeyinde lokalize olan sinapsin proteinleri ve hücre iskeletinin F-aktin lifleri üzerinde bulunan spektrin aracılığıyla esas olarak hücre iskeletine sabitlenir (Şekil 1.26). Az sayıda kesecik presle ilişkilidir.
vezikül proteini sinaptobrevin ve presinaptik membran proteini sintaksini yoluyla naptik membran.
Bir kesecik, 1 verici kuantum olan 6000-8000 verici molekül içerir; sinaptik yarığa salınan minimum miktar. Bir dizi aksiyon potansiyeli sinir ucuna (presinaptik membran) ulaştığında, Ca2+ iyonları hücreye hücum eder. Presinaptik membranla ilişkili veziküllerde Ca2+ iyonları sinaptotagmi vezikül proteinine bağlanır
 Pirinç. 1.24. Kimyasal bir sinaps yoluyla aktarımın ana aşamaları: 1 - aksiyon potansiyeli presinaptik sona ulaşır; 2 - presinaptik membranın depolarizasyonu, voltaja bağlı Ca2+ kanallarının açılmasına yol açar; 3 - Ca2+ iyonları veziküllerin presinaptik membran ile füzyonuna aracılık eder; 4 - verici moleküller ekzositoz yoluyla sinaptik yarığa salınır; 5 - verici moleküller postsinaptik reseptörlere bağlanarak iyon kanallarını aktive eder; 6 - membranın iyonlar için iletkenliğinde bir değişiklik meydana gelir ve aracının özelliklerine bağlı olarak, postsinaptik membranın uyarıcı (depolarizasyon) veya inhibe edici (hiperpolarizasyon) potansiyeli ortaya çıkar; 7 - iyon akımı postsinaptik membran boyunca yayılır; 8 - verici moleküller yeniden alım yoluyla presinaptik terminale geri döner veya 9 - hücre dışı sıvıya yayılır
Pirinç. 1.24. Kimyasal bir sinaps yoluyla aktarımın ana aşamaları: 1 - aksiyon potansiyeli presinaptik sona ulaşır; 2 - presinaptik membranın depolarizasyonu, voltaja bağlı Ca2+ kanallarının açılmasına yol açar; 3 - Ca2+ iyonları veziküllerin presinaptik membran ile füzyonuna aracılık eder; 4 - verici moleküller ekzositoz yoluyla sinaptik yarığa salınır; 5 - verici moleküller postsinaptik reseptörlere bağlanarak iyon kanallarını aktive eder; 6 - membranın iyonlar için iletkenliğinde bir değişiklik meydana gelir ve aracının özelliklerine bağlı olarak, postsinaptik membranın uyarıcı (depolarizasyon) veya inhibe edici (hiperpolarizasyon) potansiyeli ortaya çıkar; 7 - iyon akımı postsinaptik membran boyunca yayılır; 8 - verici moleküller yeniden alım yoluyla presinaptik terminale geri döner veya 9 - hücre dışı sıvıya yayılır
nom, vezikül zarının açılmasına neden olur (bkz. Şekil 1.26). Buna paralel olarak, sinaptofizin polipeptit kompleksi, presinaptik membranın tanımlanamayan proteinleri ile birleşir, bu da düzenlenmiş ekzositozun meydana geldiği bir gözenek oluşumuna yol açar, yani. Sinaptik yarığa bir nörotransmiterin salgılanması. Özel kesecik proteinleri (rab3A) bu süreci düzenler.
Presinaptik terminaldeki Ca2+ iyonları, presinaptik membran üzerindeki sinapsini fosforile eden bir enzim olan Ca2+-kalmodulin bağımlı protein kinaz II'yi aktive eder. Sonuç olarak, verici yüklü kesecikler hücre iskeletinden serbest bırakılabilir ve sonraki döngüyü gerçekleştirmek için presinaptik membrana hareket edebilir.
Sinaptik yarığın genişliği yaklaşık 20-50 nm'dir. Serbest bırakıldıktan hemen sonra lokal konsantrasyonu oldukça yüksek ve milimolar aralıkta olan nörotransmitter molekülleri içine salınır. Nörotransmiter molekülleri postsinaptik membrana yaklaşık 0,1 ms içinde yayılır.
Postsinaptik membranda, bir subsinaptik bölge ayırt edilir - presinaptik ve postsinaptik membranlar arasındaki doğrudan temas alanı, aynı zamanda sinapsın aktif bölgesi olarak da adlandırılır. İyon kanallarını oluşturan proteinleri içerir. Dinlenme halindeyken bu kanallar nadiren açılır. Nörotransmiter molekülleri postsinaptik membrana girdiğinde iyon kanalı proteinleri (sinaptik reseptörler) ile etkileşime girerek konformasyonlarını değiştirir ve iyon kanallarının önemli ölçüde daha sık açılmasına yol açar. İyon kanalları bir ligandla (nörotransmitter) doğrudan temas ettiğinde açılan reseptörlere denir. iyonotropik. Açık olan reseptörler
 Pirinç. 1.25. Aksodendritik sinapsın ultra yapısı. 1 - akson; 2 - dendrit; 3 - mitokondri; 4 - sinaptik veziküller; 5 - presinaptik membran; 6 - postsinaptik membran; 7 - sinaptik yarık
Pirinç. 1.25. Aksodendritik sinapsın ultra yapısı. 1 - akson; 2 - dendrit; 3 - mitokondri; 4 - sinaptik veziküller; 5 - presinaptik membran; 6 - postsinaptik membran; 7 - sinaptik yarık
İyon kanallarının oluşumu, adı verilen diğer kimyasal işlemlerin bağlantısıyla ilişkilidir. metabotropik(Şekil 1.27).
Pek çok sinapsta, nörotransmiter reseptörleri yalnızca postsinaptikte değil aynı zamanda presinaptik membranda da bulunur. (otoreseptörler). Bir nörotransmiter, presinaptik membran üzerindeki otoreseptörlerle etkileşime girdiğinde, sinaps tipine bağlı olarak salınımı artar veya zayıflar (pozitif veya negatif geri besleme). Otoreseptörlerin fonksiyonel durumu aynı zamanda Ca2+ iyonlarının konsantrasyonundan da etkilenir.
Nörotransmiter, postsinaptik reseptör ile etkileşime girerek postsinaptikte spesifik olmayan iyon kanallarını açar.
 Pirinç. 1.26. Vezikül presinaptik membrana kenetleniyor. A- Sinaptik vezikül, sinapsin molekülünü kullanarak hücre iskeleti elemanına bağlanır. Yerleştirme kompleksi bir dörtgenle vurgulanır: 1 - samkinaz 2; 2 - sinaps 1; 3 - fodrin; 4 - arabulucu taşıyıcısı; 5 - sinaptofizin; 6 - yerleştirme kompleksi
Pirinç. 1.26. Vezikül presinaptik membrana kenetleniyor. A- Sinaptik vezikül, sinapsin molekülünü kullanarak hücre iskeleti elemanına bağlanır. Yerleştirme kompleksi bir dörtgenle vurgulanır: 1 - samkinaz 2; 2 - sinaps 1; 3 - fodrin; 4 - arabulucu taşıyıcısı; 5 - sinaptofizin; 6 - yerleştirme kompleksi
B- Yerleştirme kompleksinin büyütülmüş diyagramı: 7 - synaptobrevin; 8 - sinaptotagmin; 9 - rab3A; 10 - NSF; 11 - sinaptofizin; 12 - EKLEME; 13 - sözdizimi; 14 - neurexin; 15 - fizyofilin; 16 - a-SNAP; 17 - Ca2+; 18 - n-sn1. CaM kinaz-2 - kalmodulin'e bağımlı protein kinaz 2; n-secl - salgılayıcı protein; NSF - N-etilmaleimide duyarlı füzyon proteini; gab3ZA - ras ailesinden GTPaz; SNAP - presinaptik membran proteini
zar Uyarıcı postsinaptik potansiyel, iyon kanallarının elektrokimyasal gradyanlarına bağlı olarak tek değerlikli katyonları iletme yeteneğindeki artıştan kaynaklanır. Dolayısıyla postsinaptik membranın potansiyeli -60 ile -80 mV arasındadır. Na+ iyonları için denge potansiyeli +55 mV'dir, bu da Na+ iyonlarının hücreye itici güçlü kuvvetini açıklar. K+ iyonları için denge potansiyeli yaklaşık -90 mV'dir; hücre içi ortamdan hücre dışı ortama doğru yönlendirilen hafif bir K+ iyonu akımı kalır. İyon kanallarının çalışması, uyarıcı postsinaptik potansiyel olarak adlandırılan postsinaptik membranın depolarizasyonuna yol açar. İyonik akımlar denge potansiyeli ile zar potansiyeli arasındaki farka bağlı olduğundan, zarın dinlenme potansiyeli azaldığında Na+ iyonlarının akımı zayıflar, K+ iyonlarının akımı artar, bu da membranın dinlenme potansiyelinin azalmasına neden olur. uyarıcı postsinaptik potansiyelin genliği. Uyarıcı postsinaptik oluşumunda rol oynayan Na + ve K + akımları
 Pirinç. 1.27. Reseptör yapı diyagramı.
Pirinç. 1.27. Reseptör yapı diyagramı.
A- Metabotropik. B- İyonotropik: 1 - nöromodülatörler veya ilaçlar; 2 - farklı bağlanma bölgelerine sahip reseptörler (heteroseptör); 3 - nöromodülasyon; 4 - ikincil haberci; 5 - otoreseptör; 6 - geri bildirim; 7 - kesecik zarının yerleştirilmesi; 8 - nöromodülatörler; 9 - verici; 10 - nöromodülasyon; 11-verici G-protein reaksiyonlarını katalize eder; 12 - verici iyon kanalını açar
Farklı özelliklere sahip diğer iyon kanalları postsinaptik depolarizasyon mekanizmasında yer aldığından, hangi potansiyeller bir aksiyon potansiyelinin oluşturulması sırasında olduğundan farklı davranır. Bir aksiyon potansiyelinin oluşturulması sırasında voltaj kapılı iyon kanalları aktive edilirse ve depolarizasyonun artmasıyla birlikte diğer kanallar da açılırsa, bunun sonucunda depolarizasyon süreci kendini güçlendirir, o zaman verici kapılı iyon kanallarının (ligand- kapılı kanallar yalnızca reseptörlerle ilişkili verici moleküllerin sayısına bağlıdır; açık iyon kanallarının sayısı. Uyarıcı postsinaptik potansiyelin genliği, sinapsın türüne bağlı olarak 100 μV ila 10 mV arasında değişir, potansiyelin süresi 4 ila 100 ms arasında değişir.
Sinaps bölgesinde lokal olarak oluşan uyarıcı postsinaptik potansiyel, hücrenin postsinaptik zarı boyunca pasif olarak yayılır. Çok sayıda sinapsın eşzamanlı uyarılmasıyla, postsinaptik potansiyelin toplanması olgusu meydana gelir; bu, genliğinde keskin bir artışla kendini gösterir ve bunun sonucunda tüm postsinaptik hücrenin zarı depolarize olabilir. Depolarizasyonun büyüklüğü bir eşik değerine (10 mV'den fazla) ulaşırsa, postsinaptik nöronun aksonu boyunca yürütülen bir aksiyon potansiyelinin oluşumu başlar. Uyarıcı postsinaptik potansiyelin başlangıcından aksiyon potansiyelinin oluşumuna kadar yaklaşık 0,3 ms geçer, yani. Bir nörotransmitterin yoğun salınımıyla, aksiyon potansiyelinin presinaptik bölgeye ulaştığı andan itibaren 0,5-0,6 ms içinde bir postsinaptik potansiyel ortaya çıkabilir (sözde sinaptik gecikme).
Diğer bileşikler postsinaptik reseptör proteini için yüksek afiniteye sahip olabilir. Reseptöre bağlanmalarının hangi etkiye (nörotransmitter ile ilgili olarak) yol açtığına bağlı olarak, agonistler (nörotransmitter ile tek yönlü etki) ve antagonistler (eylemi nörotransmitterin etkilerine müdahale eden) ayırt edilir.
İyon kanalı olmayan reseptör proteinleri vardır. Nörotransmiter molekülleri onlara bağlandığında, ikincil habercilerin yardımıyla komşu iyon kanallarının açılması sonucunda bir dizi kimyasal reaksiyon meydana gelir. Metabotropik reseptörler. G proteini bunların işleyişinde önemli bir rol oynar. Metabotropik alımı kullanan sinaptik iletim, yaklaşık 100 ms'lik iletim süresiyle çok yavaştır. Sinapslara
Bu tip, postganglionik reseptörleri, parasempatik sinir sistemi reseptörlerini ve otoreseptörleri içerir. Bunun bir örneği, nörotransmitter bağlama bölgesi ve iyon kanalının transmembran proteininin kendisinde lokalize olmadığı muskarinik tipte kolinerjik sinapstır; metabotropik reseptörler doğrudan G proteini ile ilişkilidir. Bir verici bir reseptöre bağlandığında, üç alt birimi olan bir G proteini, reseptör ile bir kompleks oluşturur. G proteinine bağlanan GDP, GTP ile değiştirilir ve G proteini aktive edilir ve potasyum iyon kanalını açma yeteneği kazanır; postsinaptik membranı hiperpolarize eder (bkz. Şekil 1.27).
İkinci haberciler iyon kanallarını açabilir veya kapatabilir. Böylece cAMP/IP 3 yardımıyla veya protein kinaz C'nin fosforilasyonuyla iyon kanalları açılabilir. Bu işlem aynı zamanda fosfolipaz C'yi aktive eden ve inositol trifosfatın (IP 3) oluşumuna yol açan G proteininin yardımıyla da gerçekleşir. . Ek olarak diaçilgliserol (DAG) ve protein kinaz C (PKC) oluşumu da artar (Şekil 1.28).
Her sinir hücresinin yüzeyinde birçok sinaptik son bulunur; bunlardan bazıları uyarıcı, diğerleri ise -
 Pirinç. 1.28.İnositol trifosfat (IP 3) ikinci habercilerinin rolü (A) ve diaçilgliserol (DAG) (B) Metabotropik reseptörün işleyişinde. Bir aracı bir reseptöre (P) bağlandığında, G proteininin yapısında bir değişiklik meydana gelir ve bunu fosfolipaz C'nin (PLC) aktivasyonu izler. Aktive edilmiş PLS, fosfatidilinositol trifosfatı (PIP 2) DAG ve IP 3'e parçalar. DAG, hücre zarının iç tabakasında kalır ve IP3, ikinci haberci olarak sitozole yayılır. DAG, zarın iç katmanına gömülüdür ve burada fosfatidilserin (PS) varlığında protein kinaz C (PKC) ile etkileşime girer.
Pirinç. 1.28.İnositol trifosfat (IP 3) ikinci habercilerinin rolü (A) ve diaçilgliserol (DAG) (B) Metabotropik reseptörün işleyişinde. Bir aracı bir reseptöre (P) bağlandığında, G proteininin yapısında bir değişiklik meydana gelir ve bunu fosfolipaz C'nin (PLC) aktivasyonu izler. Aktive edilmiş PLS, fosfatidilinositol trifosfatı (PIP 2) DAG ve IP 3'e parçalar. DAG, hücre zarının iç tabakasında kalır ve IP3, ikinci haberci olarak sitozole yayılır. DAG, zarın iç katmanına gömülüdür ve burada fosfatidilserin (PS) varlığında protein kinaz C (PKC) ile etkileşime girer.
zeki. Bitişik uyarıcı ve inhibitör sinapslar paralel olarak aktive edilirse, ortaya çıkan akımlar birbirinin üzerine biner ve bunun sonucunda uyarıcı ve inhibitör bileşenlerin ayrı ayrı oluşturduğu genlikten daha küçük bir genliğe sahip postsinaptik potansiyel ortaya çıkar. Bu durumda, K + ve C1 - iyonları için iletkenliğinin artması nedeniyle zarın hiperpolarizasyonu önemlidir.
Böylece, Na + iyonları için geçirgenliğin artması ve Na + iyonlarının gelen akımı nedeniyle uyarıcı postsinaptik potansiyel üretilir ve K + iyonlarının giden akımı veya C1'in gelen akımı nedeniyle inhibitör postsinaptik potansiyel üretilir - iyonlar. K+ iyonlarının iletkenliğindeki azalma hücre zarını depolarize etmelidir. Depolarizasyonun K + iyonları için iletkenliğin azalmasından kaynaklandığı sinapslar, otonom sinir sisteminin gangliyonlarında lokalizedir.
Sinapsın yeni bir aktarıma hazır hale gelmesi için sinaptik aktarımın hızlı bir şekilde tamamlanması gerekir, aksi takdirde yanıt yeni gelen sinyallerin etkisi altında oluşmaz ve gözlemlenir. depolarizasyon bloğu.Önemli bir düzenleyici mekanizma, nörotransmiter molekülleri hala korunurken meydana gelen postsinaptik reseptörün duyarlılığındaki hızlı azalmadır (duyarsızlaştırma). Nörotransmiterin reseptöre sürekli bağlanmasına rağmen kanal oluşturan proteinin yapısı değişir, iyon kanalı iyonlara karşı geçirimsiz hale gelir ve sinaptik akım durur. Birçok sinaps için reseptör duyarsızlaştırması, kanalın yeniden yapılandırılması ve yeniden aktivasyonu gerçekleşene kadar uzatılabilir (birkaç dakikaya kadar).
Alıcının uzun vadeli duyarsızlaşmasını önleyen vericinin etkisini sonlandırmanın diğer yolları, vericinin hızlı bir şekilde kimyasal olarak aktif olmayan bileşenlere bölünmesi veya presinaptik terminal tarafından oldukça seçici bir şekilde yeniden alım yoluyla sinaptik yarıktan çıkarılmasıdır. Etkisizleştirici mekanizmanın doğası sinapsın türüne bağlıdır. Böylece asetilkolin, asetilkolinesteraz tarafından çok hızlı bir şekilde asetat ve koline hidrolize edilir. CNS'de uyarıcı glutamaterjik sinapslar, sinaptik yarıktan nörotransmitteri aktif olarak yakalayan ve onu metabolize eden astrosit süreçleriyle yoğun bir şekilde kaplıdır.
1.7. Nörotransmiterler ve nöromodülatörler
Nörotransmiterler, nöronlar arasındaki veya nöronlar ve yürütme organları (kas, salgı hücreleri) arasındaki sinapslarda sinyalleri iletir. Nöromodülatörler presinaptik olarak salınan nörotransmitter miktarını veya nöron tarafından geri alımını etkiler. Ayrıca nöromodülatörler postsinaptik olarak reseptör duyarlılığını düzenler. Böylece nöromodülatörler sinapslardaki uyarılabilirlik seviyesini düzenleyebilir ve nörotransmitterlerin etkisini değiştirebilir. Nörotransmiterler ve nöromodülatörler birlikte bir grup nöroaktif madde oluşturur.
Birçok nöron birden fazla nöroaktif maddeye maruz kalır ancak uyarıldığında yalnızca bir vericiyi serbest bırakır. Aynı nörotransmitter, postsinaptik reseptörün tipine bağlı olarak uyarıcı veya engelleyici bir etki yaratabilir. Bazı nörotransmiterler (dopamin gibi) aynı zamanda nöromodülatörler olarak da işlev görebilir. Bir nörofonksiyonel sistem genellikle birkaç nöroaktif maddeyi içerir ve bir nöroaktif madde, birçok nörofonksiyonel sistemi etkileyebilir.
Katekolaminerjik nöronlar
Katekolaminerjik nöronlar perikaryalarında bulunur ve tirozin amino asidinden sentezlenen dopamin, norepinefrin veya epinefrin gibi nörotransmitterleri işler. Yetişkin beyninde dopaminerjik, noradrenerjik ve adrenerjik nöronlar lokalizasyon açısından melanin içeren nöronlara karşılık gelir. Noradrenerjik ve dopaminerjik hücreler A1'den A15'e kadar sayılarla ve adrenerjik hücreler - C1'den C3'e kadar, beyin sapındaki konumlarına göre alttan üst bölümlere doğru artan sırada seri numaraları atanır.
Dopaminerjik nöronlar Dopamin sentezleyen hücreler (A8-A15) orta beyinde, diensefalonda ve telensefalonda bulunur (Şekil 1.29). Dopaminerjik hücrelerin en büyük grubu substantia nigra pars kompaktadır (A9). Aksonları, hipotalamusun yan kısmından ve iç kapsülden, saçın nigrostriatal fasiküllerinden geçen artan bir yol oluşturur.
 Pirinç. 1.29. Sıçan beynindeki dopaminerjik nöronların lokalizasyonu ve yolakları.
Pirinç. 1.29. Sıçan beynindeki dopaminerjik nöronların lokalizasyonu ve yolakları.
1 - beyincik; 2 - serebral korteks; 3 - striatum; 4 - çekirdek accumbens; 5 - ön korteks; 6 - koku alma ampulü; 7 - koku alma tüberkülü; 8 - kaudat çekirdeği; 9 - amigdala çekirdeği; 10 - ortanca yükseklik; 11 - nigrostriatal paket. Ana yol (nigrostriatal demet) substantia nigra'da (A8, A9) başlar ve striatuma doğru ilerler.
kaudat çekirdeğe ve putamenlere ulaşır. Substantia reticularis'in (A8) dopaminerjik nöronları ile birlikte nigrostriatal sistemi oluştururlar.
Ana yol (nigrostriatal demet) substantia nigra'da (A8, A9) başlar ve striatuma doğru ilerler.
Dopaminerjik nöronların mezolimbik grubu (A10), mezensefalik bölgelerden limbik sisteme kadar uzanır. Grup A10, orta beyin tegmentumunda interpedinküler çekirdeklerde ventral apeksi oluşturur. Aksonlar sulkus terminalis, septum, koku tüberkülleri ve akümbens çekirdeğinin iç çekirdeklerine yönlendirilir. (n. accumbens), girusu singulat.
Tuberoinfundibular sistem adı verilen üçüncü dopaminerjik sistem (A12), gri tüberozitede yer alan diensefalonda bulunur ve infundibuluma kadar uzanır. Bu sistem nöroendokrin fonksiyonlarla ilişkilidir. Diğer diensefalik hücre grupları (A11, A13 ve A14) ve bunların hedef hücreleri de hipotalamusta bulunur. Küçük A15 grubu koku alma soğanında dağılmıştır ve telensefalondaki tek dopaminerjik nöron grubudur.
Tüm dopamin reseptörleri ikincil haberciler sistemi aracılığıyla hareket eder. Postsinaptik etkileri uyarıcı veya engelleyici olabilir. Dopamin hızla presinaptik terminale geri alınır ve burada monoamin oksidaz (MAO) ve katekol-O-metiltransferaz (COMT) tarafından metabolize edilir.
Noradrenerjik nöronlar Noradrenerjik sinir hücreleri yalnızca medulla oblongata ve ponsun tegmentumunun dar anterolateral bölgesinde bulunur (Şekil 1.30). İçinde-
 Pirinç. 1.30. Sıçan beynindeki noradrenerjik nöronların lokalizasyonu ve bunların yolları (parasagital bölüm).
Pirinç. 1.30. Sıçan beynindeki noradrenerjik nöronların lokalizasyonu ve bunların yolları (parasagital bölüm).
1 - beyincik; 2 - sırt demeti; 3 - ventral paket; 4 - hipokampus; 5 - serebral korteks; 6 - koku alma ampulü; 7 - bölüm; 8 - medial ön beyin demeti; 9 - uç şeridi; 10 - hipotalamus.
Ana yol locus coeruleus'ta (A6) başlar ve birkaç demet halinde ileriye doğru geçerek beynin çeşitli bölgelerine dallar verir. Ayrıca noradrenerjik çekirdekler beyin sapının ventral kısmında (A1, A2, A5 ve A7) bulunur. Liflerinin çoğu locus coeruleus nöronlarının lifleriyle birlikte gider, ancak bazıları dorsal yönde çıkıntı yapar.
bu nöronlardan gelen lifler orta beyne yükselir veya omuriliğe iner. Ayrıca noradrenerjik hücrelerin beyincik ile bağlantıları vardır. Noradrenerjik lifler dopaminerjik liflerden daha geniş dallara ayrılır. Beyin kan akışının düzenlenmesinde rol oynadıkları düşünülmektedir.
Noradrenerjik hücrelerin en büyük grubu (A6) locus coeruleus'ta bulunur. (locus cereleus) ve tüm noradrenerjik hücrelerin neredeyse yarısını içerir (Şekil 1.31). Çekirdek, IV ventrikülün altındaki ponsun üst kısmında bulunur ve alt koliküllere kadar uzanır. Locus coeruleus hücrelerinin aksonları defalarca dallanır, adrenerjik uçları merkezi sinir sisteminin birçok yerinde bulunabilir. Olgunlaşma ve öğrenme, beyindeki bilgi işleme, uyku düzenleme ve ağrının endojen inhibisyonu süreçleri üzerinde modüle edici bir etkiye sahiptirler.
Posterior noradrenerjik demet A6 grubundan kaynaklanır ve orta beyinde posterior rafenin çekirdekleri, üst ve alt kolliküllere bağlanır; diensefalonda - talamusun ön çekirdekleri, medial ve lateral genikülat cisimler ile; telensefalonda - amigdala, hipokampus, neokorteks, singulat girus ile.
A6 grubu hücrelerinden gelen ek lifler, üst pedinkül yoluyla beyinciğe gider (bkz. Şekil 1.31). Locus coeruleus'tan inen lifler, komşu A7 hücre grubunun lifleriyle birlikte vagus sinirinin arka çekirdeğine, alt zeytine ve omuriliğe gider. ön-yan
 Pirinç. 1.31. Pons'un gri maddesinde bulunan nukleus coeruleus'tan (makula) gelen noradrenerjik yolakların diyagramı.
Pirinç. 1.31. Pons'un gri maddesinde bulunan nukleus coeruleus'tan (makula) gelen noradrenerjik yolakların diyagramı.
1 - iletken yolun lifleri; 2 - hipokampus; 3 - talamus; 4 - hipotalamus ve amigdala çekirdeği; 5 - beyincik; 6 - omurilik; 7 - mavi nokta
Locus coeruleus'tan inen fasikül, lifleri omuriliğin ön ve arka boynuzlarına gönderir.
A1 ve A2 gruplarının nöronları medulla oblongata'da bulunur. Pontin hücre grupları (A5 ve A7) ile birlikte önden çıkan noradrenerjik yolakları oluştururlar. Orta beyinde gri periakuaduktal çekirdeğe ve retiküler formasyona, diensefalonda - tüm hipotalamusa, telensefalonda - koku alma ampulüne yansıtılırlar. Ayrıca bu hücre gruplarından (A1, A2, A5, A7) ampulospinal lifler de omuriliğe gider.
PNS'de norepinefrin (ve daha az ölçüde epinefrin), otonom sinir sisteminin sempatik postganglionik uçlarının önemli bir nörotransmitteridir.
Adrenerjik nöronlar
Adrenalin sentezleyen nöronlar yalnızca medulla oblongata'da, dar bir anterolateral bölgede bulunur. En büyük C1 hücre grubu posterior olivary çekirdeğin arkasında yer alır, orta grup C2 hücre grubu soliter sistemin çekirdeğinin yanında yer alır ve C3 hücre grubu doğrudan periakuaduktal gri maddenin altında yer alır. C1-C3'ten gelen efferent yollar vagus sinirinin arka çekirdeğine, soliter traktusun çekirdeğine, locus coeruleus'a, pons ve orta beynin periakuaduktal gri maddesine ve hipotalamusa gider.
Agonistlere veya antagonistlere tepkileri ve postsinaptik etkileri bakımından farklılık gösteren 4 ana tip katekolaminerjik reseptör vardır. α1 reseptörleri, ikinci haberci inositol fosfat-3 yoluyla kalsiyum kanallarını yönlendirir ve aktive edildiklerinde hücre içi iyon konsantrasyonlarını artırır
Ca 2+. β2 reseptörlerinin uyarılması, ikinci haberci cAMP'nin konsantrasyonunda bir azalmaya yol açar ve buna çeşitli etkiler eşlik eder. İkincil haberci cAMP yoluyla reseptörler, K+ iyonları için membran iletkenliğini arttırır ve inhibitör postsinaptik potansiyel oluşturur.
Serotonerjik nöronlar
Serotonin (5-hidroksitriptamin), triptofan amino asidinden oluşur. Serotonerjik nöronların çoğu, beyin sapının orta kısımlarında lokalize olup raphe çekirdekleri adı verilen yapıları oluşturur (Şekil 1.32). B1 ve B2 grupları medulla oblongata'da, B3 - medulla oblongata ile pons arasındaki sınır bölgesinde, B5 - ponsta, B7 - orta beyinde bulunur. Raphe nöronları B6 ve B8, pons ve orta beyindeki tegmentumda bulunur. Raphe çekirdekleri ayrıca dopamin, norepinefrin, GABA, enkefalin ve P maddesi gibi diğer nörotransmiterleri içeren sinir hücrelerini de içerir. Bu nedenle rafe çekirdeklerine çoklu iletici merkezler de denir.
Serotonerjik nöronların projeksiyonları norepinefrin liflerinin seyrine karşılık gelir. Liflerin büyük kısmı limbik sistem yapılarına, retiküler formasyona ve omuriliğe yönlendirilir. Norepinefrin nöronlarının ana konsantrasyonu olan locus coeruleus ile bir bağlantı vardır.
Büyük ön çıkan yol, B6, B7 ve B8 gruplarının hücrelerinden kaynaklanır. Önde orta beyin tegmentumundan ve yanal olarak hipotalamustan geçer, daha sonra forniks ve singulat girusa doğru dallar verir. Bu yol boyunca, B6, B7 ve B8 grupları orta beyinde interpedinküler çekirdekler ve substantia nigra ile, diensefalonda - tasma, talamus ve hipotalamusun çekirdekleri ile, telensefalonda - septumun çekirdekleri ve substantia nigra ile bağlanır. koku ampulü.
Serotonerjik nöronlardan hipotalamusa, singulat kortekse ve koku korteksine, ayrıca striatum ve frontal kortekse bağlantılara kadar çok sayıda projeksiyon vardır. Daha kısa olan arka çıkan yol, B3, B5 ve B7 gruplarının hücrelerini arka uzunlamasına fasikül aracılığıyla periakuaduktal gri madde ve arka hipotalamik bölge ile birleştirir. Ayrıca beyincikte (B6 ve B7) ve omurilikte (B1 ila B3) serotonerjik projeksiyonların yanı sıra retiküler formasyona bağlanan çok sayıda lif vardır.
Serotonin her zamanki gibi salınır. Postsinaptik membran üzerinde ikincil habercilerin yardımıyla K+ ve Ca2+ iyonları için kanalları açan reseptörler bulunur. Agonistlerin ve antagonistlerin etkisine farklı tepki veren 7 sınıf serotonin reseptörü vardır: 5-HT1 - 5-HT7. 5-HT1, 5-HT2 ve 5-HT4 reseptörleri beyinde, 5-HT3 reseptörleri PNS'de bulunur. Serotoninin etkisi, presinaptik terminal tarafından nörotransmiterin geri alımı mekanizması yoluyla sona erer. Veziküllere girmeyen serotonin, MAO tarafından deamine edilir. Omuriliğin ilk sempatik nöronları üzerinde inen serotonerjik liflerin inhibitör etkisi vardır. Bu şekilde medulla oblongata'nın raphe nöronlarının anterolateral sistemdeki ağrı uyarılarının iletimini kontrol ettiği varsayılmaktadır. Serotonin eksikliği depresyonla ilişkilidir.
 Pirinç. 1.32. Sıçan beynindeki serotonerjik nöronların lokalizasyonu ve bunların yolları (parasagital bölüm).
Pirinç. 1.32. Sıçan beynindeki serotonerjik nöronların lokalizasyonu ve bunların yolları (parasagital bölüm).
1 - koku alma ampulü; 2 - kemer; 3 - korpus kallozum; 4 - serebral korteks; 5 - medial uzunlamasına fasikül; 6 - beyincik; 7 - medial ön beyin demeti; 8 - medüller şerit; 9 - uç şeridi; 10 - kasa; 11 - kaudat çekirdeği; 12 - dış kapsül. Serotonerjik nöronlar beyin sapında bulunan dokuz çekirdek halinde gruplandırılmıştır. B6-B9 çekirdekleri anterior olarak diensefalon ve telensefalona doğru uzanırken, kaudal çekirdekler medulla oblongata ve omuriliğe uzanır.
Histaminerjik nöronlar
Histaminerjik sinir hücreleri hipotalamusun alt kısmında infundibulumun yakınında bulunur. Histamin, histidin amino asidinden histidin dekarboksilaz enzimi tarafından metabolize edilir. Hipotalamusun alt kısmındaki uzun ve kısa histaminerjik sinir hücresi lifi demetleri, arka ve periventriküler bölgenin bir parçası olarak beyin sapına gider. Histaminerjik lifler periakuaduktal gri maddeye, posterior rafe çekirdeğine, medial vestibüler çekirdeğe, soliter traktusun çekirdeğine, vagus sinirinin arka çekirdeğine,
fasiyal sinir, ön ve arka koklear çekirdekler, lateral lemniskus ve alt kollikulus. Ek olarak, lifler diensefalona - hipotalamusun arka, yan ve ön kısımlarına, memeli gövdelere, talamus optik, periventriküler çekirdeklere, yan genikülat gövdelere ve telensefalona - Broca'nın diyagonal girusuna, N. Accumbens, amigdala ve serebral korteks.
Kolinerjik nöronlar
Okülomotor, troklear, trigeminal, abdusens, fasiyal, glossofaringeal, vagus, aksesuar ve hipoglossal sinirlerin ve omurilik sinirlerinin alfa (α) - ve gama (γ) motonöronları kolinerjiktir (Şekil 1.33). Asetilkolin iskelet kaslarının kasılmasını etkiler. Otonom sinir sisteminin preganglionik nöronları kolinerjiktir; otonom sinir sisteminin postganglionik nöronlarını uyarırlar. Diğer kolinerjik sinir hücreleri yukarıdan aşağıya doğru alfanümerik olarak adlandırıldı (katekolaminerjik ve serotonerjik nöronların ters sırasına göre). Ch1 kolinerjik nöronlar, medyan septal çekirdek hücrelerinin yaklaşık %10'unu oluşturur, Ch2 nöronları, Broca'nın diyagonal fissürünün dikey kolundaki hücrelerin %70'ini, Ch3 nöronları, median septal çekirdeğin yatay kolundaki hücrelerin %1'ini oluşturur. Broca'nın diyagonal çatlağı. Her üç nöron grubu da tasmanın medial çekirdeklerine ve interpedinküler çekirdeklere doğru aşağıya doğru uzanır. Ch1 nöronları artan liflerle forniks yoluyla hipokampusa bağlanır. Ch3 hücre grubu, koku alma soğanının sinir hücrelerine sinaptik olarak bağlanır.
İnsan beyninde, Ch4 hücre grubu nispeten geniştir ve tüm hücrelerin %90'ının kolinerjik olduğu Meynert bazalis çekirdeğine karşılık gelir. Bu çekirdekler subkortikal diensefalik-telensefalik bölgelerden afferent uyarılar alır ve beynin limbik-paralimbik korteksini oluşturur. Bazal çekirdeğin ön hücreleri frontal ve parietal neokortekse, arka hücreleri ise oksipital ve temporal neokortekse uzanır. Dolayısıyla bazal çekirdek, limbik-paralimbik bölgeler ile neokorteks arasında iletici bir bağlantıdır. İki küçük kolinerjik hücre grubu (Ch5 ve Ch6) ponsta bulunur ve çıkan retiküler sistemin parçası olarak kabul edilir.
Kısmen kolinerjik hücrelerden oluşan periolivary çekirdeğin küçük bir hücre grubu, ponsun alt kısımlarında yamuk gövdenin kenarında bulunur. Efferent lifleri işitme sisteminin reseptör hücrelerine gider. Bu kolinerjik sistem ses sinyallerinin iletimini etkiler.
Aminasiderjik nöronlar
Dört amino asit için nörotransmiter özellikleri kanıtlanmıştır: glutamik (glutamat), aspartik (aspartat) asitler için uyarıcı, g-aminobütirik asit ve glisin için inhibitör. Sisteinin nörotransmiter (uyarıcı) özelliklere sahip olduğu ileri sürülmüştür; taurin, serin ve p-alanin (inhibitör).
 Pirinç. 1.33. Sıçan beynindeki kolinerjik nöronların lokalizasyonu ve bunların yolları (parasagital bölüm). 1 - amigdala çekirdeği; 2 - ön koku alma çekirdeği; 3 - kavisli çekirdek; 4 - Meynert'in bazal çekirdeği; 5 - serebral korteks; 6 - kaudat çekirdeğinin kabuğu; 7 - Broca'nın çapraz kirişi; 8 - bükülmüş kiriş (Meynert kirişi); 9 - hipokampus; 10 - interpedinküler çekirdek; 11 - yanal dorsal tegmental çekirdek; 12 - tasmanın medial çekirdeği; 13 - koku alma ampulü; 14 - koku alma tüberkülü; 15 - retiküler oluşum; 16 - medüller şerit; 17 - talamus; 18 - lastiğin retiküler oluşumu
Pirinç. 1.33. Sıçan beynindeki kolinerjik nöronların lokalizasyonu ve bunların yolları (parasagital bölüm). 1 - amigdala çekirdeği; 2 - ön koku alma çekirdeği; 3 - kavisli çekirdek; 4 - Meynert'in bazal çekirdeği; 5 - serebral korteks; 6 - kaudat çekirdeğinin kabuğu; 7 - Broca'nın çapraz kirişi; 8 - bükülmüş kiriş (Meynert kirişi); 9 - hipokampus; 10 - interpedinküler çekirdek; 11 - yanal dorsal tegmental çekirdek; 12 - tasmanın medial çekirdeği; 13 - koku alma ampulü; 14 - koku alma tüberkülü; 15 - retiküler oluşum; 16 - medüller şerit; 17 - talamus; 18 - lastiğin retiküler oluşumu
Glutamaterjik ve aspartaterjik nöronlar Yapısal olarak benzer amino asitler glutamat ve aspartat (Şekil 1.34), elektrofizyolojik olarak uyarıcı nörotransmiterler olarak sınıflandırılır. Nörotransmitter olarak glutamat ve/veya aspartat içeren sinir hücreleri, işitsel sistemde (birinci sıra nöronlar), koku sisteminde (koku alma soğanını serebral korteksle birleştirir), limbik sistemde, neokortekste (piramidal hücreler) bulunur. Glutamat ayrıca piramidal hücrelerden gelen yolların nöronlarında da bulunur: kortikostriatal, kortikotalamik, kortikotektal, kortikomontin ve kortikospinal yollar.
Glutamat sisteminin işleyişinde önemli bir rol, sinir sisteminin pasif elemanları olmayan, ancak sinaptik aktivitedeki artışa yanıt olarak nöronlara enerji substratları sağlamada rol oynayan astrositler tarafından oynanır. Astrositik süreçler
 Pirinç. 1.34. Glutamik ve aspartik asitlerin sentezi.
Pirinç. 1.34. Glutamik ve aspartik asitlerin sentezi.
Glikoliz, glikozu, asetil-CoA varlığında Krebs döngüsüne giren piruvat'a dönüştürür. Daha sonra transaminasyonla oksaloasetat ve α-ketoglutarat sırasıyla aspartat ve glutamata dönüştürülür (reaksiyonlar şeklin alt kısmında gösterilmiştir)
ki, sinaptik temasların etrafında bulunur ve bu da onların, nörotransmitterlerin sinaptik konsantrasyonundaki artışları algılamalarına olanak tanır (Şekil 1.35). Glutamatın sinaptik yarıktan transferine, ikisi glial spesifik olan spesifik taşıma sistemleri aracılık eder. GLT-1 Ve GLAST- taşıyıcılar). Üçüncü taşıma sistemi (EAAS-1), Yalnızca nöronlarda bulunur ve sinapslardan salınan glutamatın transferinde rol oynamaz. Glutamatın astrositlere geçişi, Na + iyonlarının elektrokimyasal gradyanı boyunca meydana gelir.
Normal koşullar altında glutamat ve aspartatın hücre dışı konsantrasyonları nispeten sabit kalır. Artışları telafi edici mekanizmaları içerir: nöronlar ve astrositler tarafından hücreler arası boşluktaki fazlalığın yakalanması, nörotransmiterlerin salınımının presinaptik inhibisyonu, metabolik kullanım ve
 Pirinç. 1.35. Glutamaterjik sinapsın yapısı.
Pirinç. 1.35. Glutamaterjik sinapsın yapısı.
Glutamat, sinaptik veziküllerden sinaptik yarığa salınır. Şekilde iki geri alım mekanizması gösterilmektedir: 1 - presinaptik terminale geri dönüş; 2 - komşu bir glial hücreye; 3 - glial hücre; 4 - akson; 5 - glutamin; 6 - glutamin sentetaz; 7 - ATP+NH4+; 8 - glutaminaz; 9 - glutamat + NH4 +; 10 - glutamat; 11 - postsinaptik membran. Glial hücrelerde glutamin sentaz, glutamatı glutamine dönüştürür ve bu daha sonra presinaptik terminale geçer. Presinaptik terminalde glutamin, glutaminaz enzimi tarafından tekrar glutamata dönüştürülür. Serbest glutamat ayrıca mitokondride Krebs döngüsünün reaksiyonlarında da sentezlenir. Serbest glutamat, bir sonraki aksiyon potansiyeli ortaya çıkmadan önce sinaptik keseciklerde toplanır. Şeklin sağ tarafı, glutamin sentetaz ve glutaminazın aracılık ettiği glutamat ve glutaminin dönüşüm reaksiyonlarını göstermektedir.
vb. Sinaptik yarıktan eliminasyonları bozulursa, glutamat ve aspartatın sinaptik yarıkta mutlak konsantrasyonu ve kalış süresi izin verilen sınırları aşar ve nöronal membranların depolarizasyon süreci geri döndürülemez hale gelir.
Memeli merkezi sinir sisteminde iyonotropik ve metabotropik glutamat reseptör aileleri vardır. İyonotropik reseptörler iyon kanallarının geçirgenliğini düzenler ve N-metil-D-aspartatın etkisine olan duyarlılıklarına bağlı olarak sınıflandırılır. (NMDA), a-amino-3-hidroksi-5-metil-4-izoksazol-propiyonik asit (AMRA), kainik asit (K) ve L-2-amino-4-fosfonobütirik asit (L-AP4)- bu tip reseptörün en seçici ligandları. Bu bileşiklerin adları karşılık gelen reseptör türlerine verilmiştir: NMDA, AMRA, K Ve L-AP4.
En çok çalışılan reseptörler NMDA tipidir (Şekil 1.36). Postsinaptik reseptör NMDAçeşitli düzenleme bölgelerini (bölgelerini) içeren karmaşık bir supramoleküler oluşumdur: bir aracının spesifik bağlanması için bir bölge (L-glutamik asit), bir koagonistin (glisin) spesifik bağlanması için bir bölge ve her iki membran üzerinde bulunan allosterik modülatör bölgeler (poliamin) ve iyon kanalında, reseptöre bağlı (iki değerlikli katyonlar için bağlanma bölgeleri ve "fensiklidin" bölgesi - rekabetçi olmayan antagonistler için bağlanma bölgesi).
İyonotropik reseptörler, merkezi sinir sisteminde uyarıcı nörotransmisyonun uygulanmasında, nöroplastisitenin uygulanmasında, yeni sinapsların oluşmasında (sinaptogenez) ve mevcut sinapsların işleyiş verimliliğinin arttırılmasında anahtar rol oynar. Organik beyin hasarı nedeniyle bozulan hafıza, öğrenme (yeni becerilerin kazanılması) ve fonksiyonların telafisi mekanizmaları büyük ölçüde bu süreçlerle ilişkilidir.
Heyecan verici aminoasiderjik nörotransmiterler (glutamat ve aspartat) belirli koşullar altında sitotoksisite ile karakterize edilir. Aşırı uyarılmış postsinaptik reseptörlerle etkileşime girdiklerinde, sinir hücresinin iletken kısmında değişiklik olmaksızın dendrosomatik lezyonlar gelişir. Bu tür aşırı uyarılma yaratan koşullar, taşıyıcının artan salınımı ve/veya azalan yeniden alımı ile karakterize edilir. Reseptörlerin glutamat tarafından aşırı uyarılması NMDAöncenin açılmasına yol açar
nist bağımlı kalsiyum kanalları ve eşiğe konsantrasyonunda ani bir artışla nöronlara güçlü bir Ca2+ akışı. Aminoasiderjik nörotransmiterlerin aşırı etkisinden kaynaklanır "eksitotoksik nöron ölümü" sinir dokusuna verilen evrensel bir hasar mekanizmasıdır. Hem akut (iskemik felç) hem de kronik (nötr) çeşitli beyin hastalıklarında nöronların nekrotik ölümünün temelini oluşturur.
 Pirinç. 1.36. Glutamat NMDA reseptörü
Pirinç. 1.36. Glutamat NMDA reseptörü
rodejenerasyon). Hücre dışı aspartat ve glutamat seviyeleri ve dolayısıyla eksitotoksisitenin ciddiyeti, beynin sıcaklığı ve pH'ından ve tek değerlikli C1 - ve Na + iyonlarının hücre dışı konsantrasyonlarından etkilenir. Metabolik asidoz, sinaptik aralıktan glutamat taşıma sistemini inhibe eder.
AMPA ve K reseptörlerinin aktivasyonuyla ilişkili glutamatın nörotoksik özelliklerine dair kanıtlar vardır; bu, tek değerli K+ ve Na+ katyonları için postsinaptik membranın geçirgenliğinde bir değişikliğe, Na+ iyonlarının gelen akımında bir artışa ve kısa süreli depolarizasyona yol açar. postsinaptik membranın agonist bağımlı (reseptörler) yoluyla hücreye Ca2+ akışında bir artışa neden olur NMDA) ve voltaj kapılı kanallar. Na+ iyonlarının akışına suyun hücrelere girişi eşlik eder, bu da apikal dendritlerin şişmesine ve nöronların parçalanmasına (nöronlarda ozmolitik hasar) neden olur.
Metabotropik G proteinine bağlı glutamat reseptörleri, NMDA reseptörlerinin aktivasyonu sonucu oluşan hücre içi kalsiyum akımının düzenlenmesinde önemli rol oynar ve modülatör işlevler yerine getirerek hücre aktivitesinde değişikliklere neden olur. Bu reseptörler iyon kanallarının işleyişini etkilemez, ancak iskemik kaskadın sonraki süreçlerinde yer alan hücre içi aracılar diasilgliserol ve nositol trifosfatın oluşumunu uyarır.
GABAerjik nöronlar
Bazı nöronlar, glutamat dekarboksilazın etkisiyle glutamik asitten oluşan nörotransmitter olarak g-aminobütirik asit (GABA) içerir (Şekil 1.37). Serebral kortekste, koku alma ve limbik bölgelerde (hipokampal sepet nöronları) GABAerjik nöronlar bulunur. GABA ayrıca efferent ekstrapiramidal striatonigral, pallidonigral ve subtalamopallidal yolların nöronlarını, serebellumun Purkinje hücrelerini, serebellar korteksin nöronlarını (Golgi, stellat ve sepet), omuriliğin interkalar inhibitör nöronlarını içerir.
GABA, merkezi sinir sisteminin en önemli inhibitör nörotransmitteridir. GABA'nın ana fizyolojik rolü, uyarıcı ve engelleyici sistemler arasında istikrarlı bir denge oluşturmak, ana uyarıcı nörotransmiter glutamatın aktivitesini modüle etmek ve düzenlemektir. GABA, uyarıcı uyaranın yayılmasını hem presinaptik olarak, hem de GABA-B reseptörleri aracılığıyla, işlevsel olarak sınırlar.
 Pirinç. 1.37. Glutamatın GABA'ya dönüştürülmesi reaksiyonu.
Pirinç. 1.37. Glutamatın GABA'ya dönüştürülmesi reaksiyonu.
Glutamik asit dekarboksilaz (DHA) aktivitesi koenzim piridoksal fosfat gerektirir
 Pirinç. 1.38. GABA reseptörü.
Pirinç. 1.38. GABA reseptörü.
1 - benzodiazepin bağlama bölgesi;
2 - GABA bağlama bölgesi; CL- için 3 - iyon kanalı; 4 - barbitürat bağlama bölgesi
ancak presinaptik membranların voltaj kapılı kalsiyum kanallarıyla ve postsinaptik olarak - GABAA reseptörleri (GABA-barbitürat benzodiazepin reseptör kompleksi) aracılığıyla, işlevsel olarak voltaj kapılı klorür kanallarıyla ilişkilidir. Postsinaptik GABA-A reseptörlerinin aktivasyonu, hücre zarlarının hiperpolarizasyonuna ve depolarizasyonun neden olduğu uyarıcı dürtünün inhibisyonuna yol açar.
GABA-A reseptörlerinin yoğunluğu temporal ve frontal kortekste, hipokampusta, amigdala ve hipotalamik çekirdeklerde, substantia nigrada, periakuaduktal gri maddede ve serebellar çekirdeklerde maksimumdur. Biraz daha az bir ölçüde, reseptörler kaudat çekirdek, putamen, talamus, oksipital korteks ve epifiz bezinde temsil edilir. GABA-A reseptörünün üç alt biriminin tümü (a, β ve γ) GABA'ya bağlanır, ancak bağlanma afinitesi β alt birimi için en yüksektir (Şekil 1.38). Barbitüratlar a- ve P-alt birimleriyle etkileşime girer; benzodiazepinler - yalnızca 7 alt birimli. Her bir ligandın bağlanma afinitesi, diğer ligandların reseptör ile paralel olarak etkileşime girmesi durumunda artar.
Glisinerjik nöronlar Glisin, merkezi sinir sisteminin hemen hemen tüm kısımlarında inhibitör bir nörotransmiterdir. Glisin reseptörlerinin en yüksek yoğunluğu beyin sapı, serebral korteks, striatum, hipotalamik çekirdekler, frontal korteksten hipotalamusa giden iletkenler, beyin yapılarında bulundu.
kalp, omurilik. Glisin, yalnızca kendi striknine duyarlı glisin reseptörleriyle değil, aynı zamanda GABA reseptörleriyle de etkileşime girerek inhibitör özellikler sergiler.
Küçük konsantrasyonlarda glisin, glutamat reseptörlerinin normal işleyişi için gereklidir. NMDA. Glisin bir reseptör yardımcı agonistidir NMDAçünkü bunların aktivasyonu ancak glisinin spesifik (striknine duyarlı olmayan) glisin bölgelerine bağlanması durumunda mümkündür. Glisin'in reseptörler üzerindeki etkisini artırıcı etkisi NMDA 0,1 µmol'ün altındaki konsantrasyonlarda görülür ve 10 ila 100 µmol arasındaki konsantrasyonlarda glisin bölgesi tamamen doymuştur. Yüksek glisin konsantrasyonları (10-100 mmol) NMDA kaynaklı depolarizasyonu aktive etmez in vivo ve bu nedenle eksitotoksisiteyi arttırmaz.
Peptiderjik nöronlar
Birçok peptidin nörotransmitter ve/veya nöromodülatör fonksiyonu halen araştırılmaktadır. Peptiderjik nöronlar şunları içerir:
Peptidler içeren hipotalamonörohipofiz sinir hücreleri
Nörotransmiterler olarak sitosin ve vazopressin; somatostatin, korti-peptidleri içeren hipofiztrofik hücreler
koliberin, tiroliberin, luliberin;
P maddesi, vazoaktif bağırsak polipeptidi (VIN) ve kolesistokinin gibi gastrointestinal sistemin otonom sinir sisteminin peptidlerini içeren nöronlar;
Peptitleri pro-opiomelanokortinden (kortikotropin ve β-endorfin) oluşan nöronlar,
Enkefalinerjik sinir hücreleri.
Madde-R - içeren nöronlar Madde P, yavaş başlayan ve uzun süreli uyarıcı etkiye sahip 11 amino asitten oluşan bir peptiddir. P maddesi şunları içerir:
Aksonları ince bir miyelin kılıfına sahip olan veya miyelinli olmayan omurga ganglionları ve trigeminal (Gasserian) ganglion hücrelerinin yaklaşık 1/5'i;
Koku alma soğanlarının hücreleri;
Periakuaduktal gri maddenin nöronları;
Orta beyinden interpedinküler çekirdeğe giden yolun nöronları;
Efferent nigrostriatal yolların nöronları;
Serebral kortekste, esas olarak V ve VI. katmanlarda bulunan küçük sinir hücreleri.
VIP içeren nöronlar Vazoaktif bağırsak polipeptidi (VIP) 28 amino asitten oluşur. Sinir sisteminde VIP, uyarıcı bir nörotransmitter ve/veya nöromodülatördür. En yüksek VIP konsantrasyonu neokortekste, özellikle de bipolar hücrelerde bulunur. Beyin sapında, VIP içeren sinir hücreleri soliter sistemin çekirdeğinde bulunur ve limbik sistemle ilişkilidir. Suprakiazmatik çekirdek, hipotalamusun çekirdekleriyle ilişkili VIP içeren nöronları içerir. Gastrointestinal sistemde damar genişletici bir etkiye sahiptir ve glikojenin glikoza geçişini uyarır.
β-Endorfin içeren nöronlarβ-Endorfin, beyinde inhibitör bir nöromodülatör olarak işlev gören 31 amino asitli bir peptiddir. Endorfinerjik hücreler mediobazal hipotalamusta ve soliter sistemin çekirdeğinin alt kısımlarında bulunur. Hipotalamustan çıkan endorfinerjik yollar preoptik alana, septal çekirdeklere ve amigdalaya, inen yollar ise periakuaduktal gri maddeye, seruleus çekirdeğine ve retiküler formasyona gider. Endorfinerjik nöronlar analjezinin merkezi düzenlenmesinde rol oynar; büyüme hormonu, prolaktin ve vazopressin salınımını uyarırlar.
Enkefalinerjik nöronlar
Enkefalin, opiat reseptörlerinin endojen bir ligandı olarak işlev gören 5 amino asitli bir peptiddir. Enkefalinerjik nöronlar, omuriliğin arka boynuzunun yüzeysel tabakasında ve trigeminal sinirin omurilik yolunun çekirdeğinde, perioval çekirdekte (işitsel sistem), koku alma ampullerinde, raphe çekirdeklerinde ve gri periakuaduktal bölgede bulunur. madde. Enkefalin içeren nöronlar neokorteks ve allokortekste de bulunur.
Enkefalinerjik nöronlar, ağrı uyarılarını ileten afferentlerin sinaptik uçlarından P maddesinin salınmasını presinaptik olarak engeller (Şekil 1.39). Analjezi, elektriksel stimülasyon veya opiyatların bölgeye mikroenjeksiyonu yoluyla sağlanabilir. Enkefalinerjik nöronlar, oksitosin, vazopressin, bazı liberinler ve statinlerin sentezi ve salınımının hipotalamus-hipofiz düzenlemesini etkiler.
Nitrik oksit
Nitrik oksit (NO), geleneksel nörotransmitterlerin aksine, sinir uçlarının sinaptik keseciklerinde depolanmayan ve ekzositoz mekanizması tarafından değil, serbest difüzyon yoluyla sinaptik yarığa salınan bir nörotransmiterin özelliklerine sahip çok işlevli bir fizyolojik düzenleyicidir. . NO molekülü, L-arginin amino asidinden WA sentaz (WAS) enzimi tarafından fizyolojik ihtiyaçlara yanıt olarak sentezlenir. NO'nun biyolojik bir etki yaratma yeteneği esas olarak molekülünün küçük boyutu, yüksek reaktivitesi ve sinir dokusu da dahil olmak üzere dokulara yayılma yeteneği ile belirlenir. Bu, HAYIR'ı geriye dönük bir haberci olarak adlandırmanın temeliydi.
WAV'ın üç biçimi vardır. Bunlardan ikisi yapısaldır: nöronal (ncNOS) ve endotelyal (ecWAS), üçüncüsü ise glial hücrelerde bulunan uyarılabilirdir (WAV).
Nöronal WAV izoformunun kalsiyum-kalmodulin bağımlılığı, artan hücre içi kalsiyum seviyeleriyle birlikte NO sentezinin artmasına neden olur. Bu bağlamda hücrede kalsiyum birikmesine yol açan her türlü süreç (enerji eksikliği, aktif iyon taşınmasında değişiklikler,
 Pirinç. 1.39. Jelatinimsi madde seviyesinde ağrı duyarlılığının enkefalinerjik düzenleme mekanizması.
Pirinç. 1.39. Jelatinimsi madde seviyesinde ağrı duyarlılığının enkefalinerjik düzenleme mekanizması.
1 - internöron; 2 - enkefalin; 3 - enkefalin reseptörleri; 4 - omuriliğin arka boynuzunun nöronu; 5 - P maddesi reseptörleri; 6 - P maddesi; 7 - omurga ganglionunun duyusal nöronu. Periferik bir duyu nöronu ile bir spinotalamik ganglion nöronu arasındaki sinapstaki ana verici, P maddesidir. Enkefalinerjik internöron, P maddesinin salınması üzerinde presinaptik bir inhibitör etki uygulayarak ağrı duyarlılığına yanıt verir.
Glutamat eksitotoksisitesi, oksidatif stres, inflamasyon) NO seviyelerinde bir artışa eşlik eder.
NO'nun sinaptik iletim ve NMDA glutamat reseptörlerinin fonksiyonel durumu üzerinde modüle edici bir etkiye sahip olduğu gösterilmiştir. NO, çözünebilir hem içeren guanilat siklazı aktive ederek sinir hücreleri içindeki Ca2+ iyonlarının hücre içi konsantrasyonunun ve pH'ın düzenlenmesinde rol oynar.
1.8. Aksonal taşıma
Aksonal taşıma, nöronlar arası bağlantılarda önemli bir rol oynar. Somanın biyosentetik aparatında ve dendritlerin proksimal kısmında oluşan membran ve sitoplazmik bileşenler, elementlerin kaybını telafi etmek için akson boyunca dağıtılmalıdır (sinapsların presinaptik yapılarına girişleri özellikle önemlidir). serbest bırakıldı veya etkisiz hale getirildi.
Bununla birlikte birçok akson, materyallerin somadan sinaptik terminallere basit difüzyonla verimli bir şekilde hareket etmesi için çok uzundur. Bu görev özel bir mekanizma olan aksonal taşıma ile gerçekleştirilir. Birkaç türü var. Membranla çevrili organeller ve mitokondri, hızlı aksonal taşıma yoluyla nispeten yüksek hızlarda taşınır. Sitoplazmada çözünen maddeler (örneğin proteinler) yavaş aksonal taşınmayı kullanarak hareket eder. Memelilerde hızlı aksonal taşınmanın hızı 400 mm/gün, yavaş aksonal taşınmanın hızı ise yaklaşık 1 mm/gündür. Sinaptik veziküller, 2,5 gün sonra insan omurilik motor nöronunun somasından ayak kaslarına hızlı aksonal taşıma yoluyla ulaşabilir. Karşılaştırma yapalım: Birçok çözünebilir proteinin aynı mesafeye taşınması yaklaşık 3 yıl sürmektedir.
Aksonal taşınma, metabolik enerjiye ve hücre içi kalsiyumun varlığına ihtiyaç duyar. Hücre iskeletinin elemanları (daha doğrusu mikrotübüller), zarlarla çevrili organellerin hareket ettiği bir kılavuz şeritler sistemi oluşturur. Bu organeller, mikrotübüllere, iskelet kası liflerinin kalın ve ince filamentleri arasında meydana gelene benzer bir şekilde bağlanır; organellerin mikrotübüller boyunca hareketi Ca2+ iyonları tarafından tetiklenir.
Aksonal taşıma iki yönde gerçekleşir. Anterograd aksonal taşıma adı verilen somadan aksonal terminallere taşıma, presinaptik terminallerdeki nörotransmitter sentezinden sorumlu olan sinaptik keseciklerin ve enzimlerin tedarikini yeniler. Ters yöndeki taşıma, yani retrograd aksonal taşıma, boş sinaptik kesecikleri somaya geri döndürür, burada bu membran yapıları lizozomlar tarafından parçalanır. Sinapslardan gelen maddeler, sinir hücresi gövdelerinin normal metabolizmasını sürdürmek ve ayrıca terminal aparatlarının durumu hakkında bilgi taşımak için gereklidir. Retrograd aksonal taşınmanın bozulması, sinir hücrelerinin normal işleyişinde değişikliklere ve ciddi vakalarda retrograd nöronal dejenerasyona yol açar.
Aksonal taşıma sistemi, presinaptik terminallerdeki vericilerin ve modülatörlerin yenilenmesini ve beslenmesini belirleyen ana mekanizmadır ve aynı zamanda yeni süreçlerin, aksonların ve dendritlerin oluşumunun da temelini oluşturur. Beynin bir bütün olarak plastisitesi hakkındaki fikirlere göre, yetişkin beyninde bile, birbirine bağlı iki süreç sürekli olarak meydana gelir: yeni süreçlerin ve sinapsların oluşumu, ayrıca önceden var olan bazı nöronlar arası temasların yok edilmesi ve ortadan kalkması. Aksonal taşıma mekanizmaları, ilgili sinaptogenez süreçleri ve en ince aksonal dalların büyümesi, öğrenmenin, adaptasyonun ve bozulmuş fonksiyonların telafisinin temelini oluşturur. Aksonal taşıma bozukluğu, sinaptik uçların tahrip olmasına ve belirli beyin sistemlerinin işleyişinde değişikliklere yol açar.
Tıbbi ve biyolojik olarak aktif maddeler, aksonal taşınmalarını belirleyen, onu uyaran ve böylece telafi edici ve onarıcı süreçlerin olasılığını artıran nöronların metabolizmasını etkileyebilir. Aksonal taşınımın güçlendirilmesi, en ince aksonal dalların büyümesi ve sinaptogenez, normal beyin fonksiyonunda olumlu bir rol oynar. Patolojide bu fenomenler onarıcı, telafi edici ve onarıcı süreçlerin temelini oluşturur.
Bazı virüsler ve toksinler aksonal taşınma yoluyla periferik sinirler yoluyla yayılır. Evet, suçiçeği virüsü (Varisella zoster virüsü) Spinal ganglionların hücrelerine nüfuz eder. Orada virüs, kişinin bağışıklık durumu değişene kadar bazen uzun yıllar boyunca aktif olmayan bir formda kalır. Daha sonra virüs duyusal aksonlar yoluyla cilde ve dermatomlara taşınabilir.
omurilik sinirleri, herpes zoster'in ağrılı döküntüleri ortaya çıkar (Zona). Tetanoz toksini ayrıca aksonal taşıma yoluyla da taşınır. Bakteriler Klostridium tetani kontamine bir yaradan retrograd taşınma yoluyla motor nöronlara girerler. Toksin, omuriliğin ön boynuzlarının hücre dışı boşluğuna salınırsa, inhibitör nörotransmitter amino asitlere yönelik sinaptik reseptörlerin aktivitesini bloke eder ve tetanik nöbetlere neden olur.
1.9. Sinir dokusunun hasara karşı reaksiyonları
Sinir dokusundaki hasara nöronların ve nöroglia reaksiyonları eşlik eder. Hasar ciddiyse hücreler ölür. Nöronlar postmitotik hücreler olduğundan yenilenmezler.
Nöronların ve glial hücrelerin ölüm mekanizmaları
Ağır hasar görmüş dokularda, nekroz süreçleri baskın olup, pasif hücre dejenerasyonu, organellerin şişmesi ve parçalanması, membranların tahrip edilmesi, hücre lizizi, hücre içi içeriğin çevre dokuya salınması ve inflamatuar bir yanıtın gelişmesiyle tüm hücresel alanları etkiler. Nekroz her zaman büyük bir patolojiden kaynaklanır; mekanizmaları enerji harcaması gerektirmez ve ancak hasarın nedeninin ortadan kaldırılmasıyla önlenebilir.
Apoptoz- bir tür programlanmış hücre ölümü. Apoptotik hücreler, nekrotik olanlardan farklı olarak tek tek veya küçük gruplar halinde doku boyunca dağılmış halde bulunur. Boyutları daha küçüktür, değişmemiş membranlara sahiptirler, organellerin korunduğu buruşuk sitoplazmaya ve sitoplazmik membranla ilişkili çoklu çıkıntıların görünümüne sahiptirler. Ayrıca dokuda herhangi bir inflamatuar reaksiyon da mevcut değildir ve bu durum şu anda apoptozun nekrozdan önemli ayırt edici morfolojik işaretlerinden biri olarak hizmet etmektedir. Hem büzüşmüş hücreler hem de apoptotik cisimler, sağlam hücresel organelleri ve yoğunlaştırılmış kromatin kütlelerini içerir. Apoptotik hücrelerde DNA'nın sıralı imhasının sonucu, bunların çoğalmasının (üremesinin) ve hücreler arası etkileşimlere katılımının imkansızlığıdır, çünkü bu işlemler yeni proteinlerin sentezini gerektirir. Ölen hücreler fagositoz yoluyla dokudan etkili bir şekilde uzaklaştırılır. Nekroz ve apoptoz süreçleri arasındaki temel farklar tabloda özetlenmiştir. 1.1.
Tablo 1.1. Nekroz ve apoptoz süreçleri arasındaki farkların belirtileri
 Apoptoz, olgun dokunun gelişimi ve homeostazisi süreçlerinin ayrılmaz bir parçasıdır. Normalde vücut, embriyogenezde genetik olarak programlanmış bu mekanizmayı, doku gelişiminin erken aşamasında, özellikle de hedef hücrelerle temas kurmamış ve dolayısıyla bu hücrelerin trofik desteğinden yoksun kalan nöronlardaki "fazla" hücresel materyali yok etmek için kullanır. Yetişkinlikte, memelilerin merkezi sinir sisteminde apoptozun yoğunluğu önemli ölçüde azalırken diğer dokularda yüksek kalmaktadır. Virüsle enfekte olmuş hücrelerin ortadan kaldırılmasına ve bir bağışıklık tepkisinin gelişmesine de apoptotik bir reaksiyon eşlik eder. Apoptozun yanı sıra programlanmış hücre ölümünün başka varyantları da vardır.
Apoptoz, olgun dokunun gelişimi ve homeostazisi süreçlerinin ayrılmaz bir parçasıdır. Normalde vücut, embriyogenezde genetik olarak programlanmış bu mekanizmayı, doku gelişiminin erken aşamasında, özellikle de hedef hücrelerle temas kurmamış ve dolayısıyla bu hücrelerin trofik desteğinden yoksun kalan nöronlardaki "fazla" hücresel materyali yok etmek için kullanır. Yetişkinlikte, memelilerin merkezi sinir sisteminde apoptozun yoğunluğu önemli ölçüde azalırken diğer dokularda yüksek kalmaktadır. Virüsle enfekte olmuş hücrelerin ortadan kaldırılmasına ve bir bağışıklık tepkisinin gelişmesine de apoptotik bir reaksiyon eşlik eder. Apoptozun yanı sıra programlanmış hücre ölümünün başka varyantları da vardır.
Apoptozun morfolojik belirteçleri, apoptotik cisimler ve sağlam bir membrana sahip buruşuk nöronlardır. “Apoptoz” kavramıyla neredeyse özdeş hale gelen biyokimyasal belirteçlerden biri de DNA fragmantasyonudur. Bu işlem Ca 2+ ve Mg 2+ iyonları tarafından etkinleştirilir ve Zn 2+ iyonları tarafından inhibe edilir. DNA bölünmesi, kalsiyum-magnezyuma bağımlı endonükleazın etkisinin bir sonucu olarak ortaya çıkar. Endonükleazların DNA'yı histon proteinleri arasında bölerek düzenli uzunlukta parçalar açığa çıkardığı tespit edilmiştir. DNA başlangıçta 50.000 ve 300.000 bazlık büyük parçalara bölünür ve bunlar daha sonra jel elektroforezi ile ayrıldığında bir "merdiven" oluşturan 180 baz çiftli parçalara bölünür. DNA fragmantasyonu her zaman apoptozun morfolojik karakteristiği ile ilişkili değildir ve morfolojik kriterlere eşdeğer olmayan koşullu bir belirteçtir. Apoptozu doğrulamanın en gelişmiş yöntemi, yalnızca DNA fragmantasyonunun değil aynı zamanda önemli bir morfolojik özelliğin (apoptotik cisimcikler) kaydedilmesine de olanak tanıyan biyolojik-histokimyasal yöntemdir.
Apoptoz programı ardışık üç aşamadan oluşur: ölüm veya hayatta kalma konusunda karar verme; imha mekanizmasının uygulanması; ölü hücrelerin ortadan kaldırılması (hücresel bileşenlerin bozulması ve fagositozları).
Hücrelerin hayatta kalması veya ölümü büyük ölçüde cW ailesi genlerinin ekspresyon ürünleri tarafından belirlenir. Bu genlerden ikisinin protein ürünleri ced-3 Ve ced-4 Apoptozun gerçekleşmesi için (“öldürücü genler”) gereklidir. Bir genin protein ürünü ced-9 Gen uyarımını önleyerek apoptozu önleyerek hücreleri korur ced-3 Ve ced-4. Ailenin diğer genleri cedÖlmekte olan hücrelerin paketlenmesinde ve fagositozunda ve ölü hücre DNA'sının parçalanmasında rol oynayan proteinleri kodlar.
Memelilerde öldürücü genin homologları ced-3(ve protein ürünleri), farklı substrat ve inhibitör özelliklere sahip olan interlökin dönüştürücü enzimleri - kaspazları (sistein aspartil proteazlar) kodlayan genlerdir. Aktif olmayan kaspaz öncüleri olan procaspazlar tüm hücrelerde mevcuttur. Memelilerde procaspazların aktivasyonu, apoptotik proteaz-1'in uyarıcı bir faktörü olan ced-4 geninin bir analoğu tarafından gerçekleştirilir. (Apaf-a), ATP için bağlayıcı, bu da ölüm mekanizmasının seçiminde enerji arzı seviyesinin önemini vurguluyor. Kaspazlar uyarıldığında, apoptotik hücrelerde DNA parçalanmasından sorumlu hücresel proteinlerin (polimerazlar, endonükleazlar, nükleer membran bileşenleri) aktivitesini değiştirir. Aktive edilen enzimler, kırılma yerlerinde trifosfonükleotidlerin ortaya çıkmasıyla DNA bölünmesini başlatır ve sitoplazmik proteinlerin tahrip olmasına neden olur. Hücre su kaybederek küçülür, sitoplazmanın pH'ı düşer. Hücre zarı özelliğini kaybeder, hücre küçülür ve apoptotik cisimcikler oluşur. Hücre zarlarının yeniden yapılandırılması süreci, fosfolipaz A2'yi aktive eden seramidin salınmasıyla hücrenin siringomiyelinini parçalayan siringomiyelazın aktivasyonuna dayanır. Araşidonik asit ürünleri birikir. Apoptoz sırasında ifade edilen fosfatidilserin ve vitronektin proteinleri hücrenin dış yüzeyine getirilir ve apoptotik cisimlerin fagositozunu gerçekleştiren makrofajlara sinyal verir.
Nematod geninin homologları ced-9, memelilerde hücrenin hayatta kalmasını belirleyen bir proto-onkogen ailesidir bcl-2. VE bcl-2, ve ilgili protein bcl-x-l Memeli beyninde bulunur; burada nöronları iskemik maruz kalma sırasında apoptozdan, büyüme faktörlerinin ortadan kaldırılmasından ve nörotoksinlerin etkisinden korurlar. in vivo Ve laboratuvar ortamında. Bcl-2 gen ekspresyon ürünlerinin analizi, hem anti-apoptotik hem de bcl-2 ile ilişkili proteinlerin tüm ailesini ortaya çıkardı. (Bcl-2 Ve Bcl-x-l), ve proapoptotik (Bcl-x-s, Bax, Kötü, Çanta) proteinler. Bax ve kötü proteinler homolog bir diziye sahiptir ve heterodimerler oluştururlar. bcl-2 Ve bcl-x-l in vitro.Ölümü bastıran aktivite için, bcl-2 Ve bcl-x-l protein ile dimer oluşturmalıdır bah, ve kötü proteinli dimerler ölümü hızlandırır. Bu, şu sonuca varmamızı sağladı bcl-2 ve ilgili moleküller, CNS'de hücrenin hayatta kalması veya hücre ölümünün temel belirleyicileridir. Moleküler genetik çalışmaları bunun böyle olduğunu ortaya çıkardı
gen ailesi denir bcl-2, Zıt işlevlere sahip 16 genden oluşan insanlarda 18. kromozom üzerinde haritalanmıştır. Anti-apoptotik etkiler, grubun öncüsüne benzer şekilde ailenin altı geni tarafından üretilir. bcl-2; diğer 10 gen apoptozu destekler.
Aktive edilmiş gen ekspresyon ürünlerinin pro- ve anti-apoptotik etkileri bcl-2 mitokondriyal aktivitenin modülasyonu yoluyla gerçekleştirilir. Mitokondri apoptozda anahtar oyunculardır. Apoptozun indüksiyonu için gerekli olan sitokrom C, ATP, Ca2+ iyonları ve apoptoz indükleyici faktör (AIF) içerirler. Bu faktörlerin mitokondriden salınması, zarının ailenin aktif proteinleriyle etkileşimi sırasında meydana gelir. bcl-2, Mitokondrinin dış zarına, dış ve iç zarların bir araya geldiği yerlerde - 2 nm'ye kadar çapa sahip bir megakanal olan geçirgenleştirme gözeneği alanında bağlananlar. Proteinleri bağlarken bcl-2 mitokondrinin dış zarına doğru gözeneklerin megakanalları 2,4-3 nm'ye kadar genişler. Bu kanallar aracılığıyla sitokrom C, ATP ve AIF, mitokondriden hücrenin sitozolüne girer. Antiapoptotik protein ailesi bcl-2, tam tersine megakanalları kapatarak apoptotik sinyalin ilerlemesini keser ve hücreyi apoptozdan korur. Apoptoz sürecinde mitokondri bütünlüğünü kaybetmez ve tahrip edilmez. Mitokondriden salınan sitokrom C, apoptotik proteaz aktive edici faktör (APAF-1), kaspaz-9 ve ATP ile bir kompleks oluşturur. Bu kompleks, kaspaz-9'un aktivasyonunun meydana geldiği bir apoptozomdur ve ardından hücre ölümüne yol açan ana "öldürücü" kaspaz-3'tür. Mitokondriyal sinyalleme apoptozu indüklemenin ana yoludur.
Apoptozu indüklemeye yönelik başka bir mekanizma, ligand, FADD/MORT1, TRADD adaptör proteinlerinin yardımıyla meydana gelen hücre ölümü bölgesinin reseptörlerine bağlandığında pro-apoptotik bir sinyalin iletilmesidir. Hücre ölümünün reseptör yolu, mitokondriyal olandan çok daha kısadır: Kaspaz-8, adaptör moleküller yoluyla aktive edilir ve bu da doğrudan "öldürücü" kaspazları aktive eder.
gibi bazı proteinler p53, p21 (WAF1), apoptoz gelişimini teşvik edebilir. Doğal olduğu gösterildi s.53 tümör hücre hatlarında apoptozu indükler ve in vivo. dönüşüm s.53 Doğal tipten mutant forma geçiş, apoptoz süreçlerinin baskılanması sonucu birçok organda kanser gelişimine yol açmaktadır.
Akson dejenerasyonu
Sinir hücresinin soma kısmındaki aksonun kesilmesinden sonra, yeni yapısal proteinlerin sentezlenmesi yoluyla aksonun onarılmasını amaçlayan sözde akson reaksiyonu gelişir. Sağlam nöronların somasında, Nissl cisimcikleri, ribozomların ribonükleik asitlerine bağlanan bazik anilin boyasıyla yoğun bir şekilde boyanır. Bununla birlikte, akson reaksiyonu sırasında kaba endoplazmik retikulumun sarnıçları hacim olarak artar ve protein sentezi ürünleriyle dolar. Kromatoliz meydana gelir - ribozomların düzensizliği, bunun sonucunda Nissl cisimciklerinin bazik anilin boyası ile boyanması çok daha zayıf hale gelir. Hücre gövdesi şişer ve yuvarlanır ve çekirdek bir tarafa doğru hareket eder (çekirdeğin eksantrik konumu). Tüm bu morfolojik değişiklikler, artan protein sentezine eşlik eden sitolojik süreçlerin bir yansımasıdır.
Aksonun transeksiyon bölgesinin distalindeki kısmı ölür. Birkaç gün içinde bu alan ve aksonun tüm sinaptik uçları yok edilir. Aksonun miyelin kılıfı da dejenere olur, parçaları fagositler tarafından yakalanır. Ancak miyelini oluşturan nöroglial hücreler ölmez. Bu fenomen dizisine Wallerian dejenerasyonu denir.
Hasar görmüş akson, bir sinire veya efektör hücreye tek veya ana sinaptik girişi sağlıyorsa, postsinaptik hücre dejenere olabilir ve ölebilir. İyi bilinen bir örnek, iskelet kası liflerinin motor nöronlar tarafından innervasyonunun kesilmesinden sonra atrofisidir.
Akson rejenerasyonu
Hasar görmüş bir akson dejenere olduktan sonra birçok nöron yeni bir akson geliştirebilir. Proksimal segmentin sonunda akson dallanmaya başlar. (filizleniyor)- çoğalma]. PNS'de yeni oluşan dallar, eğer bu yola erişilebilirse, ölü sinirin orijinal yolu boyunca büyür. Waller dejenerasyonu sırasında, sinirin uzak kısmındaki Schwann hücreleri sadece hayatta kalmakla kalmaz, aynı zamanda çoğalarak ölü sinirin geçtiği sıralar halinde sıralanır. Yenilenen aksonun "büyüme konileri" Schwann hücrelerinin sıraları arasında yolunu bulur ve sonunda hedeflerine ulaşarak onları yeniden sinirlendirebilir. Aksonlar daha sonra Schwann hücreleri tarafından yeniden miyelinlenir. Yenilenme oranı sınırlıdır
yavaş aksonal taşınmanın hızıyla belirlenir, yani. yaklaşık 1 mm/gün.
CNS'de akson rejenerasyonu biraz farklıdır: oligodendroglia hücreleri akson dallarının büyümesi için bir yol sağlayamaz, çünkü CPS'de her bir oligodendrosit birçok aksonu miyelinleştirir (PNS'deki her biri yalnızca bir aksona miyelin sağlayan Schwann hücrelerinin aksine).
Kimyasal sinyallerin CNS ve PNS'deki rejeneratif süreçler üzerinde farklı etkileri olduğuna dikkat etmek önemlidir. Merkezi sinir sisteminde akson yenilenmesinin önündeki ek bir engel de astrositlerin oluşturduğu glial yaralardır.
Mevcut nöronal akımların “yeniden amplifikasyonunu” ve yeni polisinaptik bağlantıların oluşumunu sağlayan sinaptik filizlenme, nöronal dokunun plastisitesini belirler ve bozulmuş nörolojik fonksiyonların restorasyonunda rol oynayan mekanizmaları oluşturur.
Trofik faktörler
Trofik kaynağının seviyesi, beyin dokusunda iskemik hasarın gelişiminde önemli bir rol oynar.
Nörotrofik özellikler, yapısal proteinler (örneğin S1OOβ) dahil olmak üzere birçok proteinin doğasında vardır. Aynı zamanda, en az 7 aileden oluşan heterojen bir trofik faktör grubunu temsil eden büyüme faktörleri tarafından maksimum düzeyde gerçekleştirilirler - nörotrofinler, sitokinler, fibroblast büyüme faktörleri, insüline bağımlı büyüme faktörleri, dönüştürücü büyüme faktörü ailesi 31 (TGF-J3I), epidermal büyüme faktörleri ve büyüme proteini 6 (GAP-6)4, trombosite bağımlı büyüme faktörü, heparine bağlı nörotrofik faktör, eritropoietin, makrofaj koloni uyarıcı faktör vb. dahil olmak üzere diğerleri (Tablo 1.2).
Nöronların yaşamının tüm temel süreçleri üzerindeki en güçlü trofik etki, hücrelerinde (nöronlar ve glia) sentezlenen sinir dokusunun düzenleyici proteinleri olan nörotrofinler tarafından uygulanır. Lokal olarak, salınım yerinde etki gösterirler ve özellikle hedef hücreler yönünde dendritik dallanmayı ve aksonal büyümeyi yoğun bir şekilde indüklerler.
Bugüne kadar yapısal olarak birbirine benzeyen üç nörotrofin en çok çalışılanlar oldu: sinir büyüme faktörü (NGF), beyinden türetilen büyüme faktörü (BDNF) ve nörotrofin-3 (NT-3).
Tablo 1.2. Nörotrofik faktörlerin modern sınıflandırması

 Gelişmekte olan bir organizmada, hedef hücre (örneğin kas iğciği) tarafından sentezlenirler, nörona doğru yayılırlar ve yüzeyindeki reseptör moleküllerine bağlanırlar.
Gelişmekte olan bir organizmada, hedef hücre (örneğin kas iğciği) tarafından sentezlenirler, nörona doğru yayılırlar ve yüzeyindeki reseptör moleküllerine bağlanırlar.
Reseptöre bağlı büyüme faktörleri nöronlar tarafından alınır (yani endositozlanır) ve retrograd olarak somaya taşınır. Orada doğrudan çekirdeğe etki ederek nörotransmiterlerin sentezinden ve aksonların büyümesinden sorumlu enzimlerin oluşumunu değiştirebilirler. Büyüme faktörleri için iki tür reseptör vardır: çoğu trofik faktörün bağlandığı düşük afiniteli reseptörler ve yüksek afiniteli tirozin kinaz reseptörleri.
Sonuç olarak akson hedef hücreye ulaşarak onunla sinaptik temas kurar. Büyüme faktörleri, yokluğunda var olamayacak olan nöronların yaşamını destekler.
Trofik düzensizlik, sinir sistemindeki hasarın patogenezinin evrensel bileşenlerinden biridir. Olgun hücreler trofik destekten yoksun kaldığında, sinir dokusunun özelliklerindeki değişikliklerle birlikte nöronların biyokimyasal ve fonksiyonel farklılaşması gelişir. Trofik düzensizlik, membran elektrogenezi, aktif iyon taşınması, sinaptik iletim (arabulucuların sentezi için enzimler, postsinaptik reseptörler) ve efektör fonksiyonu (kas miyozini) ile ilgili makromoleküllerin durumunu etkiler. Farklılaşmamış merkezi nöron toplulukları, nekroz ve apoptoz mekanizmaları yoluyla nöron ölümüne yol açan patobiyokimyasal basamakları tetikleyerek patolojik olarak artmış uyarım odakları yaratır. Aksine, yeterli düzeyde trofik tedarik ile, iskemik beyin hasarından sonra nörolojik defisit gerilemesi, başlangıçta buna neden olan kalan morfolojik kusurla bile sıklıkla gözlenir, bu da beyin fonksiyonunun yüksek adaptasyonunu gösterir.
Yetersiz trofik tedarikin gelişmesinin, potasyum ve kalsiyum homeostazındaki değişiklikleri, trofik faktörlerin aktif merkezinin bir parçası olan tirozin kinaz enzimini bloke eden nitrik oksitin aşırı sentezini ve sitokin dengesizliğini içerdiği tespit edilmiştir. Önerilen mekanizmalardan biri, kişinin kendi nörotrofinlerine ve trofik özelliklere sahip yapısal nörospesifik proteinlere karşı otoimmün saldırganlığıdır ve bu, kan-beyin bariyerinin koruyucu fonksiyonunun bozulması sonucu mümkün olur.
Morfofonksiyonel özelliklerine göre 3 ana tip nöron vardır.
Afferent (hassas, reseptör) nöronlar, merkezi sinir sistemine impulslar iletir; merkezcil. Bu nöronların gövdeleri her zaman beyin veya omuriliğin dışında, periferik sinir sisteminin düğümlerinde (ganglia) bulunur. 2) Interkalatlı (ara, ilişkisel) nöronlar uyarımı afferent (hassas) nörondan efferent (motor veya salgı) nörona iletir. 3) Efferent (motor, salgı, efektör) nöronlar, aksonları boyunca impulsları çalışan organlara (kaslar, bezler) iletir. Bu nöronların gövdeleri merkezi sinir sisteminde veya çevrede - sempatik ve parasempatik düğümlerde bulunur.
Sinir aktivitesinin ana şekli reflekstir. Refleks (Latince refleks - yansıma), merkezi sinir sisteminin zorunlu katılımıyla gerçekleştirilen, vücudun tahrişe karşı nedensel olarak belirlenmiş bir reaksiyonudur. Refleks aktivitenin yapısal temeli, reseptör, interkalar ve efektör nöronlardan oluşan sinir zincirlerinden oluşur. Sinir uyarılarının reseptörlerden yürütme organına geçtiği, refleks arkı adı verilen yolu oluştururlar. Bu yol şunları içerir: reseptör -> afferent sinir yolu -> refleks merkezi -> efferent yol -> efektör.
Omurilik (medulla spinalis), merkezi sinir sisteminin ilk kısmıdır. Omurilik kanalında bulunur ve önden arkaya doğru düzleştirilmiş, 40-45 cm uzunluğunda, 1 ila 1,5 cm genişliğinde, 34-38 gr ağırlığında (beyin kütlesinin %2'si) silindirik bir korddur. Üst kısımda medulla oblongata'ya geçer ve altta bir nokta ile biter - ince bir terminal (terminal) filamanın ondan ayrıldığı I - II lomber omur seviyesinde medüller koni (bir temel) omuriliğin kaudal (kaudal) ucu). Omuriliğin çapı farklı bölgelerde değişiklik gösterir. Servikal ve lomber bölgelerde kalınlaşmalar (üst ve alt ekstremitelerin innervasyonu) oluşturur. Omuriliğin ön yüzeyinde ön ortanca fissür bulunur, arka yüzeyde arka ortanca sulkus vardır; omuriliği birbirine bağlı sağ ve sol simetrik yarılara bölerler. Her iki yarıda, zayıf bir şekilde tanımlanmış ön yan ve arka yan oluklar ayırt edilir. Birincisi ön motor köklerinin omurilikten çıktığı yer, ikincisi ise omurilik sinirlerinin arka duyu köklerinin beyne girdiği yerdir. Bu yanal oluklar aynı zamanda omuriliğin ön, yan ve arka kordları arasında sınır görevi görür. Omuriliğin içinde dar bir boşluk vardır - beyin omurilik sıvısıyla dolu merkezi kanal (bir yetişkinde çeşitli kısımlarda ve bazen tüm uzunluk boyunca büyümüştür).
Omurilik parçalara ayrılır: servikal, torasik, lomber, sakral ve koksigeal ve parçalar bölümlere ayrılır. Bir segment (omuriliğin yapısal ve fonksiyonel birimi), iki çift köke (iki ön ve iki arka) karşılık gelen bir alandır. Omuriliğin tüm uzunluğu boyunca her iki taraftan 31 çift kök çıkar. Buna göre omurilikteki 31 çift omurilik siniri 31 segmente ayrılır: 8'i servikal, 12'si torakal, 5'i lomber, 5'i sakral ve 1-3'ü koksigeal.
Omurilik gri ve beyaz maddeden oluşur. Gri madde - omuriliğin her iki yarısında 3 gri sütun oluşturan nöronlar (13 milyon): ön, arka ve yan. Omuriliğin bir kesitinde, her iki taraftaki gri madde sütunları boynuz görünümündedir. Daha geniş ön boynuz ve dar arka boynuz, ön ve arka gri sütunlara karşılık gelir. Yan boynuz, gri maddenin ara sütununa (bitkisel) karşılık gelir. Ön boynuzların gri maddesi motor nöronları (motor nöronlar), arka boynuzları interkalar duyu nöronlarını ve yan boynuzları interkalar otonomik nöronları içerir. Omuriliğin beyaz maddesi gri maddeden dışarıya doğru lokalize olup ön, yan ve arka kordları oluşturur. Çoğunlukla uzunlamasına uzanan, demetler halinde birleşmiş sinir liflerinden oluşur - yollar. Ön kordların beyaz maddesi inen yolları içerir, yan kordlar çıkan ve inen yolları içerir ve arka kordlar çıkan yolları içerir.
Omurilik ile çevre arasındaki bağlantı, omurilik köklerinden geçen sinir lifleri aracılığıyla gerçekleştirilir. Ön kökler santrifüj motor lifleri içerir ve arka kökler merkezcil duyu lifleri içerir (bu nedenle, bir köpekte omuriliğin dorsal köklerinin iki taraflı kesilmesiyle hassasiyet kaybolur, ön kökler korunur, ancak uzuvların kas tonusu kaybolur).