Одним из наиболее важных обобщений в иммунологии конца XX и начала XXI в. стало создание научно обоснованного учения о врожденном (от англ. innate immunity), или естественном, природном, и адаптивном (от англ. adaptive immunity), или приспособительном, приобретенном (от англ. acquired immunity), иммунитете. В иммунологической практике чаще используют термины «врожденный» и «адаптивный» иммунитет, врожденные и адаптивные компоненты иммунной системы, врожденный и адаптивный иммунный ответ. Оба варианта иммунитета реализуются через клеточные и гуморальные факторы. Ушли в прошлое такие термины, как «неспецифический иммунитет», «неспецифическая иммунологическая реактивность» и им подобные.
Врожденный и приобретенный иммунитет представляет собой две взаимодействующие части одной системы, обеспечивающей развитие иммунного ответа на генетически чужеродные субстанции.
Врожденный иммунитет - наследственно закрепленная система защиты многоклеточных организмов от любых патогенных и непатогенных микроорганизмов, а также эндогенных продуктов тканевой деструкции.
Как самая ранняя форма иммунной защиты организма
, врожденный иммунитет сформировался на начальных этапах эволюции многоклеточных организмов, до появления способности к перегруппировке генов иммуноглобулинов и TCR, а также возможности узнавания «своего» и полноценной иммунной памяти. Доказательством этому служит наличие разнообразных генов врожденной защиты у беспозвоночных животных и растений. Известно, что у беспозвоночных (например, у членистоногих) существуют клеточные элементы, обладающие фагоцитарной функцией, и гуморальные факторы типа противомикробных пептидов, лектинов и др., успешно распознающих и поражающих патогенные микроорганизмы. Все эти компоненты консервативны, наследуются и не подвергаются генетической модификации в течение жизни.
Охарактеризованы основные отличительные признаки
системы врожденного иммунитета.
Врожденный иммунитет обеспечивает распознавание и элиминацию патогенов в первые несколько минут или часов после их проникновения в организм, когда механизмы адаптивного иммунитета еще отсутствуют.
Функция системы врожденного иммунитета осуществляется через разнообразные клеточные элементы (макрофаги, ДК, нейтрофилы, тучные клетки, эозинофилы, базофилы, NK-клетки, NKT-клетки, некоторые негемопоэтические клетки) и гуморальные факторы (естественные антитела, цитокины, комплемент, белки острой фазы, катионные противомикробные пептиды, лизоцим и др.).
Клетки врожденной иммунной системы
:
не образуют клонов. Отсутствие клональности в организации врожденной иммунной системы - одно из ее основных отличий от адаптивной иммунной системы. В этом смысле каждая клетка врожденного иммунитета действует индивидуально, тогда как при адаптивном иммунном ответе все клетки в пределах клона (сообщества) подчинены единой генетически детерминированной программе;
не подвергаются негативной и позитивной селекции;
участвуют в реакциях фагоцитоза, цитолиза, в том числе бактериолиза, нейтрализации, выработки цитокинов и др.
Распознавание патогенов клетками врожденного иммунитета реализуется через многочисленные рецепторные структуры, такие, как рецепторы-мусорщики (scavenger-рецепторы), маннозные рецепторы, рецепторы комплемента (CRl, CR3, CR4), лектиновые рецепторы и др. Особую группу рецепторов врожденного иммунитета составляют так называемые паттерн-распознающие рецепторы (англ. Pattern-Recognition Receptor - PRR).
Они распознают консервативные , общие для многих типов микроорганизмов структуры, так называемые патогенассоциированные молекулярные паттерны (англ. Pathogen-Associated Molecular Patterns - PAMP). В настоящее время интенсивно изучают структуру и функции рецепторов врожденного иммунитета, таких, как Toll-подобные рецепторы (TLR), NOD-1, NOD-2, RIG и др. Рецепторы врожденной иммунной системы эволюционно законсервированы.
Toll-рецепторы впервые обнаружены у дрозофил. Toll-подобные (TLR) рецепторы у млекопитающих имеют сходную с ними структуру и функцию. Рецепторы этого семейства широко представлены на различных клетках иммунной системы (моноциты, ДК, лейкоциты и др.), а также на многих клетках организма (фибробласты, эндотелий, эпителий, кардиомиоциты и др.). Система TLR более подробно рассмотрена ниже.
Факторы врожденного иммунитета не изменяются в процессе жизни организма, контролируются генами зародышевой линии и наследуются.
Активация врожденного иммунитета
не формирует продолжительной иммунной памяти, но служит обязательным условием развития адаптивного иммунного ответа.
Все перечисленные функции крайне важны для защиты от патогенных микроорганизмов, но недостаточны для жизнедеятельности высокоорганизованных многоклеточных организмов, таких, как позвоночные. Именно у них в процессе эволюции возникли новые иммунные компоненты и сформировалась иммунная система, главной функцией которой стал контроль над генетическим постоянством внутренней среды многоклеточного организма. Перед иммунной системой возникла задача распознать и запомнить «свое». Всё, что антигенно «свое», должно сохраниться, а всё, что антигенно «чужое», подлежит удалению из организма. В условиях многомиллионного разнообразия чужеродных антигенных структур невозможно обойтись небольшим набором генов, передаваемых по наследству (так называемых зародышевых генов - англ. germ line).
Общая система иммунитета человека разделяется на две большие подсистемы — неспецифический естественный врожденный иммунитет и приобретенный специфический (адаптивный) иммунитет. Давайте разберемся, что такое врожденный иммунитет , как он работает и для чего он нужен человеку. При рождении ребенок попадает в среду, отличную от внутриутробной стерильной жизни. Даже при условии соблюдения всех правил асептики и антисептики он буквально с первой секунды жизни подвергается атаке микроорганизмов. Тем не менее, малыш не заболевает в момент рождения! Почему так происходит? Все дело во врожденном иммунитете, который способен оградить новорожденного от опасности инфицирования. Врожденный иммунитет стойкий, он передается по наследству, что связано с биологическими свойствами организма. Например, животные не болеют венерическими болезнями человека, а человек не болеет чумой крупного рогатого скота. Система врожденного иммунитета создает мощный заслон попаданию в организм бактерий, вирусов, грибков и так далее.
Клетки фагоциты
Врожденный иммунитет обеспечивает 60% всей защиты нашего организма. Он обеспечивает распознавание и элиминацию патогенов в первые несколько минут или часов после их проникновения в организм. Врожденный иммунитет начинает формироваться в середине первого триместра беременности с фагоцитов. Фагоциты - это клетки, которые способны поглощать чужеродные организмы. Они «вырастают» из стволовых клеток и проходят «обучение» в селезенке, благодаря которому могут впоследствии отличать своих и чужих. Клетки фагоциты обычно циркулируют по организму в поисках чужеродных материалов, но могут быть призваны в определённое место при помощи цитокинов. Фагоцитоз представляет собой важную особенность клеточного звена врождённого иммунитета и, по всей вероятности, представляет собой наиболее старую форму защиты организма, поскольку фагоциты обнаруживаются как у позвоночных, так и у беспозвоночных животных.
Факторы врожденного иммунитета
Врожденный иммунитет - это врожденная способность уничтожать все чуждое организму. Именно он является первой линией защиты организма млекопитающих против опухолей и инфекционных болезней. Основным внешним защитным барьером, предотвращающим проникновение микроорганизмов в организм человека, являются кожа и слизистые оболочки. Защитные свойства кожи - это, прежде всего, ее непроницаемость (физический барьер) и наличие на поверхности ингибиторов микроорганизмов (молочная кислота и жирные кислоты в поте и секрете сальных желез, низкий pH на поверхности). Слизистая оболочка обладает многокомпонентным механизмом защиты. Слизь, выделяемая ее клетками, препятствует прикреплению к ней микроорганизмов, движение ресничек способствует «выметанию» чужеродных веществ из дыхательного тракта. Слезы, слюна и моча активно вымывают чужеродные вещества со слизистых оболочек. Многие секретируемые организмом жидкости обладают специфическими бактерицидными свойствами. Например, соляная кислота желудка, спермин и цинк в сперме, лактопероксидаза в грудном молоке и лизоцим во многих внешних секретах (носовой, слезы, желчь, дуоденальное содержимое, грудное молоко и др.) обладают мощными бактерицидными свойствами. Бактерицидным действием обладают также некоторые ферменты, например, гиалуронидаза, α1-антитрипсин, липопротеиназа.
Клетки врожденного иммунитета
Клетки врожденного иммунитета не образуют клонов. Каждая клетка врожденного иммунитета действует индивидуально. Факторы врожденного иммунитета не изменяются в процессе жизни организма, контролируются генами зародышевой линии и наследуются. Клетки врожденного иммунитета НК-клетки или натуральные киллеры способны убивать широкий круг клеток - от вирусинфицированных до опухолевых. Снижение НК клеточной активности и снижение числа клеток в НК клеточной популяции связаны с развитием и быстрым прогрессированиеми таких заболеваний, как рак , вирусный гепатит , СПИД, синдром хронической усталости, синдром иммунодефицита и целый ряд аутоиммунных заболеваний. В ряде исследований показано, что низкие уровни НК клеточной популяции коррелируют с более быстрым распространением опухолей, с более коротким периодом жизни больных и большей их смертностью. Повышение функциональной активности натуральных киллеров напрямую связано с проявлением противовирусного и противоопухолевого действия. Поиск препаратов, повышающих активность этого звена врожденного иммунитета, представляется стратегически перспективным для разработки противовирусных препаратов широкого спектра действия. Поэтому вовсем мире ведущие ученные заняты поиском таких препаратов. А между тем такой препарат уже существует, но об этом ниже.
Стимуляторы клеток врожденного иммунитета
К сожалению, почти у половины населения нашей планеты уровень НК клеток значительно ниже нормы. Такое состояние называется иммунодефицит. Иммунодефицит приводит к более частым инфекционным заболеваниям, является причиной более высокой онкологической заболеваемости и смертности. Поэтому сегодня крайне необходимы средства, стимулирующие увеличение количества и функциональной активности НК и, таким образом, приводящие к устранению иммунодефицита и способствующие укреплению иммунной системы . Для этих целей в практике применяются иммуномодуляторы и адаптогены . Однако, их активность недостаточно высока. Недавно установлено, что наиболее активными стимуляторами функции НК клеток являются, так называемые трансферфакторные белки, которые содержатся в лейкоцитах крови и, как оказалось, в молозиве коров, коз и в яичном желтке. Эти белки обладают в 4-5 раз более высокой иммуностимулирующей активностью в сравнении с известными активными иммуномодуляторами, применяемыми в практической медицине. А в связи с доступностью источника трансфер факторов, открывается возможность его получения в неограниченных количествах. Компания 4Life воодушевившись возможностями трансфер факторов начала первой производить препарат Трансфер Фактор, в основе которого находятся трансфер факторы из молозива коров и яичных желтков. Всасываясь в кровь, трансфер факторы устремляются к молекуле ДНК, проверяют ее на наличие повреждений, и восстанавливают ее целостность благодаря информации, содержащейся в них. Результатом становится отладка всех иммунных процессов. Иными словами, после приема Трансфер фактора иммунитет сам начинает понимать когда, чем и как реагировать на тот или иной вид опасности. Сегодня Трансфер Фактор купить можно и в Украине, для этого нужно просто позвонить нам или заполнить специальную форму заказа.
Для этих целей в практике применяются иммуномодуляторы и адаптогены . Однако, их активность недостаточно высока. Недавно установлено, что наиболее активными стимуляторами функции НК клеток являются, так называемые трансферфакторные белки, которые содержатся в лейкоцитах крови и, как оказалось, в молозиве коров, коз и в яичном желтке. Эти белки обладают в 4-5 раз более высокой иммуностимулирующей активностью в сравнении с известными активными иммуномодуляторами, применяемыми в практической медицине. А в связи с доступностью источника трансфер факторов, открывается возможность его получения в неограниченных количествах. Компания 4Life воодушевившись возможностями трансфер факторов начала первой производить препарат Трансфер Фактор, в основе которого находятся трансфер факторы из молозива коров и яичных желтков. Всасываясь в кровь, трансфер факторы устремляются к молекуле ДНК, проверяют ее на наличие повреждений, и восстанавливают ее целостность благодаря информации, содержащейся в них. Результатом становится отладка всех иммунных процессов. Иными словами, после приема Трансфер фактора иммунитет сам начинает понимать когда, чем и как реагировать на тот или иной вид опасности. Сегодня Трансфер Фактор купить можно и в Украине, для этого нужно просто позвонить нам или заполнить специальную форму заказа.
Укрепляя иммунитет. Однако мало кто из нас знает, что у понятия иммунная система есть свои виды и особенности. Что такое иммунитет человека? Давайте разбираться вместе.
Немного терминологии
Под этим понятием скрывается способность организма препятствовать деятельности бактерий, токсинов и других вредных веществ. Медики различают такие виды иммунитета, как врожденный и приобретенный, которые, в свою очередь, делятся на другие формы, о которых мы расскажем чуть позже.
Главной задачей иммунной системы организма является сохранение здоровья и нормальной жизнедеятельности всех органов и систем человека. Таким образом, иммунитет играет роль защитного барьера, который отделяет нас от окружающей среды. Давайте рассмотрим детально виды и формы защитных функций организма человека.
Врожденный иммунитет
Этот вид защиты связан с особенностями организма, передающимися при рождении по наследству. Функционирование врожденного иммунитета обеспечивается множеством клеточных и неклеточных (так называемых ) факторов. Например, кожа и слизистые оболочки являются для большинства микробов надежным барьером. Защиту организма осуществляют также потовые, сальные, слюнные железы. Выделяемые ними вещества губительны для большинства патогенных бактерий. Нормальная микрофлора кишечника содержит микроорганизмы, которые являются естественными врагами многих возбудителей заболеваний. С инфекцией в пищеварительном тракте борются также желудочный сок, ферменты и желчь.
Естественная защита организма очень сильна. Но ее враги - микроорганизмы, чужеродные молекулы и клетки - постоянно пытаются проникнуть внутрь, нарушая целостность барьеров или нормальную секрецию органов и систем - понижая естественный иммунитет. Провоцирующими факторами в такой ситуации становятся переохлаждения или стрессы, нехватка витаминов или прием лекарств, гормональный дисбаланс или хирургическое вмешательство. В этом случае проникновение микроорганизмов в организм существенно облегчается. Но тут вступает в силу другой вид защиты организма. Подробно о нем поговорим далее.
Приобретенный иммунитет
Если чужеродный агент проник через естественный барьер в кровеносное русло организма, то возможно возникновение нескольких вариантов взаимоотношений между иммунитетом и бактериями, одним из которых является инфекционное заболевание. В этом случае активизируется приобретенный иммунитет, который будет бороться с инфекцией в дальнейшем.
Основной характеристикой этого вида иммунитета является выработка специфичных антител против того или иного антигена. Он формируется в процессе жизни человека и не передается по наследству. Уникальность приобретенного иммунитета заключается в том, что в зависимости от перенесенных заболеваний он изменяется, вырабатывая новые антитела. Данный вид защитных функций организма может быть естественным или искусственно приобретенным, . Рассмотрим эти формы иммунитета детально.
Если защитный иммунный барьер появился после перенесенного заболевания, то его называют естественным приобретенным иммунитетом. После атаки возбудителями заболевания организм сам вырабатывает антитела. Иногда они защищают организм от повторного заражения на недели и месяцы (при гриппе, ОРВИ), а могут - и на долгие годы или всю жизнь, как при кори или скарлатине (такой иммунитет называют стойким).
Когда человеку вводят ослабленные возбудители заболеваний, вызывающие иммунный ответ организма, то речь идет об искусственно приобретенном активном иммунитете. Если в организм вводят готовые антитела - возникает пассивный иммунитет, который позволяет в кратчайшие сроки защитить человека, имевшего контакт с больным. Но эта форма защитных функций организма более слабая по сравнению с активным типом приобретенного иммунного барьера.
Ярким представителем пассивного иммунитета является новорожденный ребенок. Еще находясь в утробе матери, малыш получает через плаценту антитела против возбудителей тех болезней, которыми переболела мама. К 3-6 месяцам жизни, данный вид иммунитета ослабевает, а к концу первого года жизни полностью угасает. Но его можно укрепить, практикуя грудное вскармливание.
Подытожив все вышесказанное, можно сделать вывод, что иммунитет - довольно сложная система, требующая постоянной помощи извне в виде вакцинации, соблюдения правил гигиены, здорового питания и физической активности. То есть чтобы быть здоровым, необходимо просто соблюдать эти правила.
9.1. Введение в иммунологию 9.1.1. Основные этапы развития иммунологии
Каждый человек на планете (кроме однояйцовых близнецов) имеет присущие только ему генетически детерминированные особенности биополимеров, из которых построено его тело. Однако его организм живет и развивается в непосредственном контакте с представителями живой и неживой природы и разнообразными биоорганическими молекулами естественного или искусственного происхождения, обладающими биологической активностью. Попадая в организм человека, продукты жизнедеятельности и ткани других людей, животных, растений, микробов, а также чужеродные молекулы могут вмешиваться и нарушать биологические процессы, создавая угрозу жизни отдельному индивидууму. Отличительной чертой этих агентов является генетическая чужеродность. Зачастую подобные продукты образуются внутри организма человека в результате синтетической активности населяющей нас микрофлоры, клеточных мутаций и всевозможных модификаций макромолекул, из которых мы построены.
Для защиты от нежелательной и губительной интервенции эволюция создала у представителей живой природы специальную систему противодействия, совокупный эффект которой был обозначен как иммунитет (от лат. immunitas - освобождение от чеголибо, неприкосновенность). Применялся этот термин уже в средние века для обозначения, например, освобождения от уплаты от податей, а позже - неприкосновенности дипломатической миссии. Смысл этого термина точно соответствует тем биологическим задачам, которые определила эволюция в отношении иммунитета.
Основными являются распознавание генетического отличия интервента от собственных структур и устранение его влияния на биологические процессы, протекающие в организме, при помощи комплекса специальных реакций и механизмов. Конечной целью деятельности системы иммунной защиты являются сохранение гомеостаза, структурной и функциональной целостности и генетической индивидуальности как отдельного организма, так и вида в целом, а также выработка средств профилактики подобных интервенций в будущем.
Следовательно, иммунитет - это способ защиты организма от генетически чужеродных веществ экзогенного и эндогенного происхождения, направленный на поддержание и сохранение гомеостаза, структурной и функциональной целостности организма и генетической индивидуальности каждого организма и вида в целом.
Иммунитет как общебиологическое и общемедицинское явление, его анатомические структуры, механизмы функционирования в организме изучает специальная наука - иммунология. Эта наука возникла более 100 лет назад. По мере прогресса человеческих знаний менялись взгляды на иммунитет, на его роль в организме, на механизмы иммунных реакций, расширялась сфера практического использования достижений иммунологии, а в соответствии с этим менялось само определение иммунологии как науки. Зачастую иммунологию трактуют как науку, которая изучает специфическую невосприимчивость к возбудителям инфекционных болезней и разрабатывает способы защиты от них. Это однобокий взгляд, который не дает всестороннего, всеобъемлющего понимания науки, исходя из сущности и механизмов иммунитета и его роли в жизнедеятельности организма. На современном этапе развития учения об иммунитете иммунологию можно определить как общебиологическую и общемедицинскую науку, которая изучает способы и механизмы защиты организма от генетически чужеродных веществ экзогенного и эндогенного происхождения с целью поддержания гомеостаза, структурной и функциональной целостности организма и генетической индивидуальности отдельного индивидуума и вида в целом. Такое определение подчеркивает, что иммунология как наука едина независимо от объекта изучения: человека, животных или растений. Конечно, анатомо-физиологическая основа, набор механизмов и реакций, а также способов защиты от антигенов у представителей животного
и растительного мира будут варьировать, однако принципиальная сущность иммунитета от этого меняться не будет. В иммунологии выделяют три направления: медицинскую иммунологию (гомоиммунологию), зооиммунологию и фитоиммунологию, изучающие соответственно иммунитет у человека, животных и растений, а в каждом из них - общую и частную. Одним из важнейших ее разделов является медицинская иммунология. Сегодня медицинская иммунология решает такие важные проблемы, как диагностика, профилактика и лечение инфекционных болезней (иммунопрофилактика или вакцинология), аллергических состояний (аллергология), злокачественных опухолей (иммуноонкология), болезней, в механизме которых играют роль иммунопатологические процессы (иммунопатология), иммунные взаимоотношения матери и плода на всех стадиях репродукции (иммунология репродукции), изучает иммунные механизмы и вносит практический вклад в решение проблемы трансплантации органов и тканей (трансплантационная иммунология); можно также выделить иммуногематологию, изучающую взаимоотношения донора и реципиента при переливании крови, иммунофармакологию, изучающую влияние на иммунные процессы лекарственных веществ. В последние годы выделились клиническая и экологическая иммунология. Клиническая иммунология изучает и разрабатывает проблемы диагностики и лечения болезней, возникающих в результате врожденных (первичных) и приобретенных (вторичных) иммунодефицитов, а экологическая иммунология - влияние на иммунную систему всевозможных экологических факторов (климатогеографических, социальных, профессиональных и т.д.).
Хронологически иммунология как наука уже прошла два больших периода (Ульянкина Т.И., 1994): период протоиммунологии (от античного периода до 80-х годов XIX века), связанный со стихийным, эмпирическим познанием защитных реакций организма, и период зарождения экспериментальной и теоретической иммунологии (с 80-х годов XIX века до второго десятилетия XX века). В течение второго периода завершилось формирование классической иммунологии, которая носила в основном характер инфекционной иммунологии. С середины XX века иммунология вступила в третий, молекулярно-генетический, период, который продолжается до наших дней. Этот период характеризуется быстрыми темпами развития молекулярной и клеточной иммунологии и иммуногенетики.
Предохранение от заболевания натуральной оспой путем прививки человеку коровьей оспы предложил более 200 лет назад английский врач Э. Дженнер, однако это наблюдение носило чисто эмпирический характер. Поэтому основоположниками научной иммунологии по праву считаются французский ученый-химик Л. Пастер, открывший принцип вакцинации, русский ученыйзоолог И.И. Мечников - автор учения о фагоцитозе и немецкий врач-биохимик П. Эрлих, сформулировавший гипотезу об антителах. В 1888 г. за выдающиеся заслуги Л. Пастера перед человечеством на народные пожертвования был учрежден Институт иммунологии (ныне Институт Пастера), который явился школой, вокруг которой группировались иммунологи многих стран. Российские ученые активно участвовали в становлении и развитии иммунологии. Более 25 лет И.И. Мечников был заместителем директора по науке в Институте Пастера, т.е. был его ближайшим помощником и единомышленником. В Пастеровском институте работали многие выдающиеся русские ученые: М. Безредка, Н.Ф. Гамалея, Л.А. Тарасович, Г.Н. Габричевский, И.Г. Савченко, С.В. Коршун, Д.К. Заболотный, В.А. Барыкин, Н.Я. и Ф.Я. Чистовичи и многие другие. Эти ученые продолжали развивать традиции Пастера и Мечникова в иммунологии и по существу создали русскую школу иммунологов.
Российским ученым принадлежат многие выдающиеся открытия в области иммунологии: И.И. Мечников заложил основы учения о фагоцитозе, В.К. Высокович одним из первых сформулировал роль ретикулоэндотелиальной системы в иммунитете, Г.Н. Габричевский описал явление хемотаксиса лейкоцитов, Ф.Я. Чистович стоял у истоков открытия тканевых антигенов, М. Райский установил феномен ревакцинации, т.е. иммунологической памяти, М. Сахаров - один из основоположников учения об анафилаксии, акад. Л.А. Зильбер стоял у истоков учения об антигенах опухолей, акад. П.Ф. Здродовский обосновал физиологическое направление в иммунологии, акад. Р.В. Петров внес весомый вклад в развитие неинфекционной иммунологии.
Российские ученые по праву являются лидерами в разработке фундаментальных и прикладных проблем вакцинологии и иммунопрофилактики в целом. Хорошо известны в нашей стране и за рубежом имена создателей вакцин против туляремии (Б.Я. Эльберт и Н.А. Гайский), сибирской язвы (Н.Н. Гинзбург), полиомие-
лита (М.П. Чумаков, А.А. Смородинцев), кори, паротита, гриппа (А.А. Смородинцев), Ку-лихорадки и сыпного тифа (П.Ф. Здродовский), полианатоксинов против раневых инфекций и ботулизма (А.А. Воробьев, Г.В. Выгодчиков, П.Н. Бургасов) и др. Активное участие российские ученые принимали в разработке вакцин и других иммунобиологических препаратов, стратегии и тактики иммунопрофилактики, глобальной ликвидации и снижении уровня инфекционных болезней. В частности, по их инициативе и с их помощью ликвидирована натуральная оспа на земном шаре (В.М. Жданов, О.Г. Анджапаридзе), успешно ликвидируется полиомиелит (М.П. Чумаков, С.Г. Дроздов).
Иммунология за сравнительно короткий исторический период добилась существенных результатов в снижении и ликвидации болезней человека, сохранении и поддержании здоровья людей нашей планеты.
9.1.2. Виды иммунитета
Способность к распознаванию чужеродных структур и защите собственного организма от интервентов сформировалась довольно рано. Элементарные системы защиты от любых чужеродных веществ имеют уже низшие организмы, в частности беспозвоночные (губки, кишечнополостные, черви). Организм человека, как и всех теплокровных животных, уже имеет сложноорганизованную систему противодействия генетически чужеродным агентам. Однако анатомическое строение, физиологические функции и реакции, обеспечивающие такую защиту у отдельных видов животных, у человека и низших организмов в соответствии с уровнем эволюционного развития существенно различаются.
Так, фагоцитоз и аллогенная ингибиция как одни из ранних филогенетических защитных реакций присуща всем многоклеточным организмам; дифференцированные лейкоцитоподобные клетки, выполняющие функции клеточного иммунитета, появляются уже у кишечнополостных и моллюсков; у круглоротых (миноги) возникают зачатки тимуса, Т-лимфоциты, иммуноглобулины, отмечается иммунная память; у рыб уже есть типичные для высших животных лимфоидные органы - тимус и селезенка, плазматические клетки и антитела класса М; птицы обладают центральным органом иммунитета в виде сумки Фабрициуса, у них появляется способность реагировать в виде гиперчувствительности немедлен-
ного типа. Наконец, у млекопитающих иммунная система достигает наиболее высокого уровня развития: формируются Т-, В- и А-системы иммунных клеток, осуществляется их кооперативное взаимодействие, появляется способность синтеза иммуноглобулинов разных классов и формы иммунного реагирования.
В зависимости от уровня эволюционного развития, особенностей и сложности сформировавшейся иммунной системы, способностей последней отвечать теми или иными реакциями на антигены в иммунологии принято выделять отдельные виды иммунитета.
Так, введено понятие о врожденном и приобретенном иммунитете (рис. 9.1). Врожденный, или видовой, иммунитет, он же наследственный, генетический, конституциональный - это выработанная в процессе филогенеза генетически закрепленная, передающаяся по наследству невосприимчивость особей данного вида к какому-либо чужеродному агенту. Примером может служить невосприимчивость человека к некоторым возбудителям, в том числе к особо опасным для сельскохозяйственных животных (чума крупного рогатого скота, болезнь Ньюкасла, поражающая птиц, оспа лошадей и др.), нечувствительность человека к бактериофагам, поражающим клетки бактерий. Объяснить видовой иммунитет можно с разных позиций: неспособностью чужеродного агента к адгезии на клетках и молекулах-мишенях, определяющих запуск патологического процесса и активацию иммунной системы, его быстрой деструкцией ферментами макроорганизма, отсутствием условий для колонизации макроорганизма.
Видовой иммунитет может быть абсолютным и относительным. Например, нечувствительные к столбнячному токсину лягушки реагируют на его введение при повышении температуры их тела. Лабораторные животные, нечувствительные к какому-либо чужеродному агенту, реагируют на него на фоне введения иммунодепрессантов или удаления центрального органа иммунитета - тимуса.
Приобретенный иммунитет - это невосприимчивость к чужеродному агенту чувствительного к нему организма человека, животных, приобретаемая в процессе индивидуального развития, т.е. развития каждой особи в отдельности. Основой ее является потенция к иммунной защите, которая реализуется лишь при необходимости и в определенных условиях. Приобретенный иммунитет, точнее его конечный результат, сам по себе не наследуется (в отличие, конечно, от потенции), это индивидуальный прижизненный опыт.
Рис. 9.1. Классификация видов иммунитета
Различают естественный и искусственный приобретенный иммунитет. Примером естественного приобретенного иммунитета у человека может служить невосприимчивость к инфекции, возникающая после перенесенного инфекционного заболевания (так называемый постинфекционный иммунитет), например после скарлатины. Искусственный приобретенный иммунитет создается преднамеренно для формирования невосприимчивости организма
к определенному агенту путем введения специальных иммунобиологических препаратов, например вакцин, иммунных сывороток, иммунокомпетентных клеток (см. главу 14).
Приобретенный иммунитет может быть активным и пассивным. Активный иммунитет обусловлен непосредственным вовлечением системы иммунитета в процесс его формирования (например, поствакцинальный, постинфекционный иммунитет). Пассивный иммунитет образуется за счет введения в организм уже готовых иммунореагентов, способных обеспечить необходимую защиту. К таким препаратам относятся антитела (препараты иммуноглобулинов и иммунные сыворотки) и лимфоциты. Пассивный иммунитет формируется у плода в эмбриональном периоде за счет проникновения материнских антител через плаценту, а в период грудного вскармливания - при поглощении ребенком антител, содержащихся в молоке.
Поскольку в формировании иммунитета принимают участие клетки иммунной системы и гуморальные факторы, принято активный иммунитет дифференцировать в зависимости от того, какой из компонентов иммунных реакций играет ведущую роль в формировании защиты от антигена. В связи с этим различают гуморальный, клеточный иммунитет. Примером клеточного иммунитета может служить трансплантационный иммунитет, когда ведущую роль в иммунитете играют цитотоксические Т-лимфоцитыкиллеры. Иммунитет при токсинемических инфекциях (дифтерия) и интоксикациях (столбняк, ботулизм) обусловлен в основном антителами (антитоксинами).
В зависимости от направленности иммунитета, т.е. природы чужеродного агента, выделяют антитоксический, противовирусный, противогрибковый, антибактериальный, антипротозойный, трансплантационный, противоопухолевый и другие виды иммунитета.
Иммунитет может поддерживаться, сохраняться либо в отсутствие или только в присутствии чужеродного агента в организме. В первом случае такой агент играет роль пускового фактора, а иммунитет называют стерильным, во втором - нестерильным. Примером стерильного иммунитета является поствакцинальный иммунитет при введении убитых вакцин, а нестерильного - иммунитет при туберкулезе, который поддерживается постоянным присутствием в организме микобактерий туберкулеза.
Иммунитет может быть системным, т.е. генерализованным, распространяющимся на весь организм, и местным, при котором на-
блюдается более выраженная резистентность отдельных органов и тканей. Как правило, учитывая особенности анатомического строения и организации функционирования, понятие «местный иммунитет» используется для обозначения резистентности слизистых оболочек (поэтому его называют иногда мукозальным) и кожных покровов. Такое подразделение также условно, так как в процессе формирования невосприимчивости эти виды иммунитета могут переходить друг в друга.
9.2. Врожденный иммунитет
Врожденный (видовой, генетический, конституциональный, естественный, неспецифический) иммунитет - это выработанная в процессе филогенеза, передающаяся по наследству, присущая всем особям одного вида устойчивость к инфекционным агентам (или антигенам).
Основной особенностью биологических факторов и механизмов, обеспечивающих такую устойчивость, является наличие в организме готовых (преформированных) эффекторов, которые способны обеспечить деструкцию патогена быстро, без длительных подготовительных реакций. Они составляют первую линию защиты организма от внешней микробной или антигенной агрессии.
9.2.1. Факторы врожденного иммунитета
Если рассматривать траекторию движения патогенного микроба в динамике инфекционного процесса, то легко заметить, что организм на этом пути выстраивает различные линии защиты (табл. 9.1). Прежде всего это покровный эпителий кожи и слизистых оболочек, обладающий колонизационной резистентностью. Если возбудитель вооружен соответствующими инвазивными факторами, то он проникает в субэпителиальную ткань, где развивается острая воспалительная реакция, ограничивающая возбудителя во входных воротах. Следующая станция на пути патогена - регионарные лимфатические узлы, куда он транспортируется лимфой по лимфатическим сосудам, дренирующим соединительную ткань. Лимфатические сосуды и узлы отвечают на внедрение развитием лимфангита и лимфаденита. После преодоления этого барьера микробы по эфферентным лимфатическим сосудам проникают в кровь - в ответ может развиться системный воспалительный от-
вет. Если микроб не гибнет в крови, то он гематогенно разносится во внутренние органы - развиваются генерализованные формы инфекции.
Таблица 9.1. Факторы и механизмы антиинфекционного иммунитета (принцип эшелонированности антимикробной защиты по Маянскому А.Н., 2003)
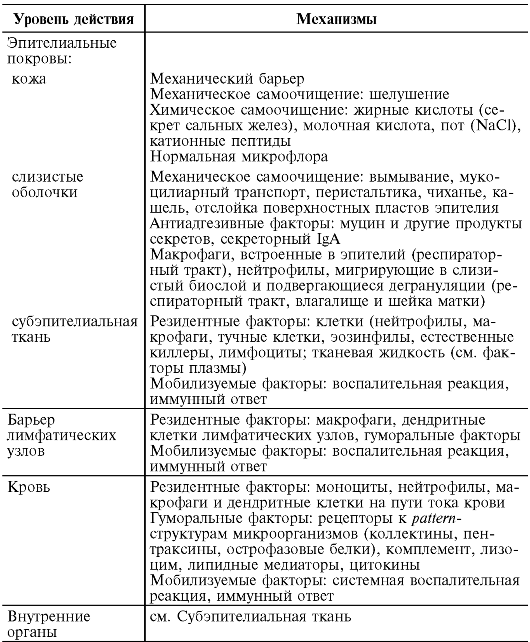 К факторам врожденного иммунитета относят:
К факторам врожденного иммунитета относят:
Кожу и слизистые оболочки;
Клеточные факторы: нейтрофилы, макрофаги, дендритные клетки, эозинофилы, базофилы, естественные киллеры;
Гуморальные факторы: система комплемента, растворимые рецепторы к поверхностным структурам микроорганизмов (pattern-структуры), антимикробные пептиды, интерфероны.
Кожа и слизистые оболочки. Тонкий слой эпителиальных клеток, выстилающий поверхность кожи и слизистых оболочек, является тем барьером, который практически непроницаем для микроорганизмов. Он отделяет стерильные ткани организма от заселенного микробами внешнего мира.
Кожа покрыта многослойным плоским эпителием, в котором различают два слоя: роговой и базальный.
Кератиноциты рогового слоя - это погибшие клетки, устойчивые к агрессивным химическим соединениям. На их поверхности отсутствуют рецепторы для адгезивных молекул микроорганизмов, поэтому они обладают значительной устойчивостью к колонизации и являются самым надежным барьером на пути большинства бактерий, грибов, вирусов, простейших. Исключение составляют S. aureus, Pr. acnae, I. pestis, да и они скорее всего проникают либо через микротрещины, либо с помощью кровососущих насекомых, либо через устья потовых и сальных желез. Устье сальных и потовых желез, волосяных фоликулов в коже наиболее уязвимы, поскольку здесь слой ороговевшего эпителия истончается. В защите этих участков важную роль играют продукты потовых и сальных желез, содержащих молочную, жирные кислоты, ферменты, антибактериальные пептиды, оказывающие антимикробное действие. Именно в устьях придатков кожи располагается глубокая резидентная микрофлора, образующая микроколонии и продуцирующая защитные факторы (см. главу 4).
В эпидермисе, помимо кератиноцитов, содержатся еще два типа клеток - клетки Лангерганса и клетки Гринстейна (отростчатые эпидермоциты, составляющие 1-3% кариоцитов базального слоя). Клетки Лангерганса и Гринстейна имеют миелоидное происхождение и относятся к дендритным. Предполагается, что по функции эти клетки являются оппозитными. Клетки Лангерганса участвуют в презентации антигена, индуцируют иммунный ответ, а клетки Гринстейна продуцируют цитокины, подавляющие им-
мунные реакции в коже. Типичные кератиноциты и дендритные клетки эпидермиса в совокупности с лимфоидными структурами дермы принимают активное участие в реакциях приобретенного иммунитета (см. ниже).
Здоровая кожа обладает высокой способностью к самоочищению. Это легко доказать, если нанести на ее поверхность нетипичные для кожи бактерии - через некоторое время такие микробы исчезают. На этом принципе основаны методы оценки бактерицидной функции кожи.
Слизистые оболочки. Большинство инфекций начинается не с кожи, а со слизистых оболочек. Это связано, во-первых, с большей площадью их поверхности (слизистые оболочки около 400 м 2 , кожа около 2 м 2), во-вторых, с меньшей защищенностью.
Слизистые оболочки не имеют многослойного плоского эпителия. На их поверхности располагается лишь один слой эпителиоцитов. В кишечнике это однослойный цилиндрический эпителий, бокаловидные секреторные клетки и М-клетки (мембранные эпителиальные клетки), располагающиеся в слое эпителиоцитов, покрывающие лимфоидные скопления. М-клетки наиболее уязвимы для проникновения многих патогенных микроорганизмов изза целого ряда особенностей: наличия специфических рецепторов для некоторых микроорганизмов (сальмонелл, шигелл, патогенных эшерихий и др.), которые не обнаружены на соседних энтероцитах; истонченного слизистого слоя; способности к эндоцитозу и пипоцитозу, благодаря чему обеспечивается облегченный транспорт антигенов и микроорганизмов из кишечной трубки в мукозоассоциированную лимфоидную ткань (см. главу 12); отсутствия мощного лизосомального аппарата, характерного для макрофагов и нейтрофилов, благодаря чему бактерии и вирусы перемещаются в субэпителиальное пространство без разрушения.
М-клетки относятся к эволюционно сформировавшейся системе облегченного транспорта антигенов к иммунокомпетентным клеткам, а бактерии и вирусы используют этот путь для своей транслокации через эпителиальный барьер.
Аналогичные М-клеткам кишечника эпителиоциты, ассоциированные с лимфоидной тканью, имеются у слизистых оболочек бронхоальвеолярного дерева, носоглотки, половой системы.
Колонизационная резистентность покровного эпителия. Любой инфекционный процесс начинается с адгезии возбудителя на по-
верхности чувствительных эпителиоцитов (за исключением микроорганизмов, передающихся через укусы насекомых или вертикально, т.е. от матери к плоду). Только закрепившись, микробы приобретают возможность размножиться во входных воротах и образовывать колонию. В колонии накапливаются токсины, ферменты патогенности в количестве, необходимом для преодоления эпителиального барьера. Этот процесс называется колонизацией. Под колонизационной резистентностью понимают устойчивость эпителия кожи и слизистых оболочек к заселению посторонними микроорганизмами. Колонизационную резистентность слизистых оболочек обеспечивает муцин, секретируемый бокаловидными клетками и образующий на поверхности сложноорганизованную биопленку. В этот биослой встроены все защитные инструменты: резидентная микрофлора, бактерицидные вещества (лизоцим, лактоферрин, токсичные метаболиты кислорода, азота и т.д.), секреторные иммуноглобулины, фагоциты.
Роль нормальной микрофлоры (см. главу 4.3). Важнейшим механизмом участия резидентной микрофлоры в колонизационной резистентности является их способность продуцировать бактериоцины (антибиотикоподобные субстанции), короткоцепочечные жирные кислоты, молочную кислоту, сероводород, перекись водорода. Такими свойствами обладают лакто-, бифидобактерии, бактероиды.
Благодаря ферментативной активности анаэробных бактерий в кишечнике происходит деконъюгация желчных кислот с образованием дезоксихолиевой кислоты, токсичной для патогенных и условно-патогенных бактерий.
Муцин наряду с полисахаридами, продуцируемыми резидентными бактериями (в частности, лактобактериями), образует на поверхности слизистых оболочек выраженный гликоналикс (биопленку), который эффективно экранирует сайты адгезии и делает их недоступными для случайных бактерий. Бокаловидные клетки образуют смесь сиало- и сульфомуцинов, соотношение которых различается в различных биотонах. Своеобразие состава микрофлоры в различных экологических нишах в значительной степени определяется количеством и качеством муцина.
Фагоцитирующие клетки и продукты их дегрануляции. В слизистый биослой на поверхности эпителия мигрируют макрофаги и нейтрофилы. Наряду с фагоцитозом эти клетки выделяют биоцид-
ные продукты наружу, содержащиеся в их лизосомах (лизоцим, пероксидаза, лактоферрин, дефанзины, токсичные метаболиты кислорода, азота), которые повышают антимикробные свойства секретов.
Химические и механические факторы. В резистентности покровного эпителия слизистых оболочек важную роль играют секреты, обладающие выраженными биоцидными, антиадгезивными свойствами: слеза, слюна, желудочный сок, ферменты и желчные кислоты тонкой кишки, цервикальный и вагинальный секреты репродуктивной системы женщин.
Благодаря целенаправленным движениям - перистальтике гладкой мускулатуры в кишечнике, ресничек мерцательного эпителия в респираторном тракте, мочи в мочевыводящей системе - образующиеся секреты вместе с содержащимися в них микроорганизмами перемещаются в направлении выхода и выводятся наружу.
Колонизационная резистентность слизистых оболочек усиливается за счет секреторных иммуноглобулинов А, синтезируемых мукозоассоциированной лимфоидной тканью.
Покровный эпителий мукозального тракта постоянно регенерирует за счет стволовых клеток, расположенных в толще слизистых оболочек. В кишечнике эту функцию выполняют клетки крипт, в которых наряду со стволовыми располагаются клетки Панета - особые клетки, синтезирующие антибактериальные белки (лизоцим, катионные пептиды). Эти белки защищают не только стволовые клетки, но и покровные эпителиоциты. При воспалении в стенке слизистой оболочки продукция этих белков усиливается.
Колонизационная резистентность покровного эпителия обеспечивается всей совокупностью защитных механизмов врожденного и приобретенного (секреторные иммуноглобулины) иммунитета и является основой устойчивости организма к большинству микроорганизмов, обитающих во внешней среде. Отсутствие на эпителиоцитах специфических рецепторов для определенных микроорганизмов, по-видимому, является базовым механизмом генетической резистентности животных одного вида к микробам, патогенным для животных другого вида.
9.2.2. Клеточные факторы
Нейтрофилы и макрофаги. Способностью к эндоцитозу (поглощению частиц с образованием внутриклеточной вакуоли) обла-
дают все эукариотические клетки. Именно таким образом внутрь клеток проникают многие патогенные микроорганизмы. Однако в большинстве инфицированных клеток отсутствуют механизмы (либо они слабы), обеспечивающие деструкцию патогена. В процессе эволюции в организме многоклеточных сформировались специализированные клетки, имеющие мощные системы внутриклеточного киллинга, основной «профессией» которых является фагоцитоз (от греч. phagos - пожираю, cytos - клетка) - поглощение частиц диаметром не менее 0,1 мкм (в отличие от пиноцитоза - поглощения частиц меньшего диаметра и макромолекул) и уничтожение захваченных микробов. Такими свойствами обладают полиморфно-ядерные лейкоциты (в основном нейтрофилы) и мононуклеарные фагоциты (эти клетки иногда называют профессиональными фагоцитами).
Впервые идея о защитной роли подвижных клеток (микро- и макрофагов) была сформулирована в 1883 г. И.И. Мечниковым, который за создание клеточно-гуморальной теории иммунитета (в соавторстве с П. Эрлихом) был удостоен в 1909 г. Нобелевской премии.
Нейтрофилы и мононуклеарные фагоциты имеют общее миелоидное происхождение из стволовой кроветворной клетки. Однако эти клетки различаются рядом свойств.
Нейтрофилы - наиболее многочисленная и подвижная популяция фагоцитов, созревание которых начинается и заканчивается в костном мозгу. Около 70% всех нейтрофилов сохраняется в виде резерва в костно-мозговых депо, откуда они под влиянием соответствующих стимулов (провоспалительных цитокинов, продуктов микробного происхождения, С5а-компонента комплемента, колониестимулирующих факторов, кортикостероидов, катехоламинов) могут экстренно перемещаться через кровь в очаг тканевой деструкции и участвовать в развитии острого воспалительного ответа. Нейтрофилы - это «отряд быстрого реагирования» в системе антимикробной защиты.
Нейтрофилы - короткоживущие клетки, продолжительность их жизни около 15 сут. Из костного мозга они выходят в кровоток уже зрелыми клетками, утратившими способность к дифференцированию и пролиферации. Из крови нейтрофилы перемещаются в ткани, в которых они либо гибнут, либо выходят на поверхность слизистых оболочек, где и заканчивают свой жизненный цикл.
Мононуклеарные фагоциты представлены промоноцитами костного мозга, моноцитами крови и тканевыми макрофагами. Моноциты, в отличие от нейтрофилов, - незрелые клетки, которые, попадая в кровяное русло и далее в ткани, созревают в тканевые макрофаги (плевральные и перитонеальные, купферовские клетки печени, альвеолярные, интердигитальные клетки лимфатических узлов, костного мозга, остеокласты, микроглиоциты, мезангиальные клетки почек, сертолиевы клетки яичек, клетки Лангерганса и Гринстейна кожи). Продолжительность жизни мононуклеарных фагоцитов от 40 до 60 сут. Макрофаги - не очень быстрые клетки, но они рассеяны во всех тканях, и, в отличие от нейтрофилов, им нет необходимости в столь срочной мобилизации. Если продолжить аналогию с нейтрофилами, то макрофаги в системе врожденного иммунитета - это «войска специального назначения».
Важной особенностью нейтрофилов и макрофагов является наличие в их цитоплазме большого количества лизосом - гранул размером 200-500 нм, содержащих различные ферменты, бактерицидные и биологически активные продукты (лизоцим, миелопероксидаза, дефензины, бактерицидный протеин, лактоферрин, протеиназы, катепсины, коллагеназа и т.д.). Благодаря столь разнообразному «вооружению» фагоциты обладают мощным деструктивным и регуляторным потенциалом.
Нейтрофилы и макрофаги чутко реагируют на любые изменения гомеостаза. Для этой цели они оснащены богатым арсеналом рецепторов, располагающихся на их цитоплазматической мембране (рис. 9.2):
Рецепторы для распознавания чужого - Toll-подобные рецепторы (Toll-like receptor - TLR), впервые открытые А. Poltorak в 1998 г. у плодовой мушки и впоследствии обнаруженные у нейтрофилов, макрофагов и дендритных клеток. По значимости открытие Toll-подобных рецепторов сопоставимо с более ранним обнаружением антигенраспознающих рецепторов у лимфоцитов. Toll-подобные рецепторы узнают не антигены, разнообразие которых в природе чрезвычайно велико (около 10 18 вариантов), а более грубые повторяющиеся молекулярные углеводные и липидные узоры - pattern-структуры (от англ. рattern - узор), которых нет на клетках организма хозяина, но которые присутствуют у простейших, грибов, бактерий, вирусов. Репертуар таких узоров невелик и составляет около 20 ва-
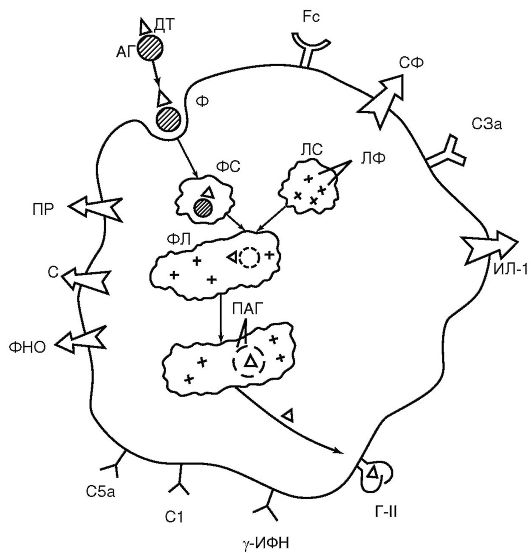 Рис. 9.2.
Функциональные
структуры макрофага (схема): АГ - антиген; ДТ - антигенная
детерминанта; ФС - фагосома; ЛС - лизосома; ЛФ - лизосомальные ферменты;
ФЛ - фаголизосома; ПАГ - процессированный антиген; Г-II - антиген
гистосовместимости II класса (МНС II); Fc - рецептор для Fc-фрагмента
молекулы иммуноглобулина; С1, С3а, С5а - рецепторы для компонентов
комплемента; γ-ИФН - рецептор для γ-МФН; С - секреция компонентов
комплемента; ПР - секреция перекисных радикалов; ИЛД-1 - секреция; ФНО -
секреция фактора некроза опухолей; Сф - секреция ферментов
Рис. 9.2.
Функциональные
структуры макрофага (схема): АГ - антиген; ДТ - антигенная
детерминанта; ФС - фагосома; ЛС - лизосома; ЛФ - лизосомальные ферменты;
ФЛ - фаголизосома; ПАГ - процессированный антиген; Г-II - антиген
гистосовместимости II класса (МНС II); Fc - рецептор для Fc-фрагмента
молекулы иммуноглобулина; С1, С3а, С5а - рецепторы для компонентов
комплемента; γ-ИФН - рецептор для γ-МФН; С - секреция компонентов
комплемента; ПР - секреция перекисных радикалов; ИЛД-1 - секреция; ФНО -
секреция фактора некроза опухолей; Сф - секреция ферментов
риантов. Toll -подобные рецепторы представляют собой семейство мембранных гликопротеидов, известно 11 типов таких рецепторов, способных узнавать всю палитру pattern -структур микроорганизмов (липополисахариды, глико-, липопротеи-
ды, нуклеиновые кислоты, белки теплового шока и т.д.). Взаимодействие Toll-подобных рецепторов с соответствующими лигандами запускает транскрипцию генов провоспалительных цитокинов и ко-стимулирующих молекул, которые необходимы для миграции, адгезии клеток, фагоцитоза и представления антигенов лимфоцитам;
Маннозно-фукозные рецепторы, распознающие углеводные компоненты поверхностных структур микроорганизмов;
Рецепторы для мусора (scavenger receptor) - для связывания фосфолипидных мембран и компонентов собственных разрушенных клеток. Участвуют в фагоцитозе поврежденных и умирающих клеток;
Рецепторы для С3в- и С4в-компонентов комплемента;
Рецепторы для Fc-фрагментов IgG. Эти рецепторы, как и рецепторы для компонентов комплемента, играют важную роль в связывании иммунных комплексов и фагоцитозе бактерии, помеченных иммуноглобулинами и комплементом (эффект опсонизации);
Рецепторы для цитокинов, хемокинов, гормонов, лейкотриенов, простагландинов и т.д. позволяют взаимодействовать с лимфоцитами и реагировать на любые изменения внутренней среды организма.
Основной функцией нейтрофилов и макрофагов является фагоцитоз. Фагоцитоз - это процесс поглощения клеткой частиц или крупных макромолекулярных комплексов. Он складывается из нескольких последовательно протекающих этапов:
Активация и хемотаксис - целенаправленное движение клетки к объекту фагоцитоза в сторону повышающейся концентрации хемоаттрактантов, роль которых играют хемокины, компоненты комплемента и микробной клетки, продукты деградации тканей организма;
Адгезия (прикрепление) частиц к поверхности фагоцита. В адгезии важную роль играют Toll-подобные рецепторы, а также рецепторы к Fc-фрагменту иммуноглобулина и С3в- компоненту комплемента (такой фагоцитоз называется иммунным). Иммуноглобулины M, G, С3в-, С4в-компоненты комплемента усиливают адгезию (являются опсонинами), служат мостиком между микробной клеткой и фагоцитом;
Поглощение частиц, их погружение в цитоплазму и образование вакуоли (фагосомы);
Внутриклеточный киллинг (убийство) и переваривание. После поглощения частицы фагосомы сливаются с лизосомами - образуется фаголизосома, в которой бактерии гибнут под действием бактерицидных продуктов гранул (кислороднезависимая система бактерицидности). Одновременно в клетке усиливается потребление кислорода и глюкозы - развивается так называемый респираторный (окислительный) взрыв, что приводит к образованию токсичных метаболитов кислорода и азота (Н 2 О 2 , супероксиданиона О 2 , гипохлорной кислоты, пироксинитрита), обладающих высокой бактерицидностью (кислородзависимая система бактерицидности). Не все микроорганизмы чувствительны к бактерицидным системам фагоцитов. Гонококки, стрептококки, микобактерии и другие выживают после контакта с фагоцитами, такой фагоцитоз называется незавершенным.
Фагоциты, помимо фагоцитоза (эндоцитоза), могут осуществлять свои цитотоксические реакции путем экзоцитоза - выделения своих гранул наружу (дегрануляция) - таким образом фагоциты осуществляют внеклеточный киллинг. Нейтрофилы, в отличие от макрофагов, способны образовывать внеклеточные бактерицидные ловушки - в процессе активации клетка выбрасывает наружу нити ДНК, в которых располагаются гранулы с бактерицидными ферментами. Благодаря липкости ДНК бактерии приклеиваются к ловушкам и под действием фермента погибают.
Нейтрофилы и макрофаги являются важнейшим звеном врожденного иммунитета, однако их роль в защите от различных микробов неодинакова. Нейтрофилы эффективны при инфекциях, вызванных внеклеточными патогенами (гноеродные кокки, энтеробактерии и др.), индуцирующими развитие острого воспалительного ответа. При таких инфекциях эффективна кооперация нейтрофил-комплемент-антитело. Макрофаги защищают от внутриклеточных патогенов (микобактерии, риккетсии, хламидии и др.), вызывающих развитие хронического гранулематозного воспаления, где главную роль играет кооперация макрофаг-Т- лимфоцит.
Помимо участия в антимикробной защите, фагоциты участвуют в удалении из организма отмирающих, старых клеток и продуктов их распада, неорганических частиц (уголь, минеральная пыль и др.). Фагоциты (особенно макрофаги) являются антигенпред-
ставляющими, они обладают секреторной функцией, синтезируют и выделяют наружу широкий спектр биологически активных соединений: цитокины (интерлейкины-1, 6, 8, 12, фактор некроза опухоли), простагландины, лейкотриены, интерфероны α и γ. Благодаря этим медиаторам фагоциты активно участвуют в поддержании гомеостаза, в процессах воспаления, в адаптивном иммунном ответе, регенерации.
Эозинофилы относятся к полиморфно-ядерным лейкоцитам. Они отличаются от нейтрофилов тем, что обладают слабой фагоцитарной активностью. Эозинофилы поглощают некоторые бактерии, но внутриклеточный киллинг у них менее эффективен, чем у нейтрофилов.
Естественные киллеры. Естественные киллеры - большие лимфоцитоподобные клетки, которые происходят из лимфоидных предшественников. Они содержатся в крови, тканях, особенно их много в печени, слизистой оболочке репродуктивной системы женщин, селезенке. Естественные киллеры, как и фагоциты, содержат лизосомы, но фагоцитарной активностью не обладают.
Естественные киллеры распознают и элиминируют клеткимишени, на которых изменены или отсутствуют маркеры, характерные для здоровых клеток. Известно, что такое происходит прежде всего с клетками, мутировавшими или пораженными вирусом. Именно поэтому естественные киллеры играют важную роль в противоопухолевом надзоре, уничтожении клеток, зараженных вирусами. Свое цитотоксическое действие естественные киллеры оказывают с помощью особого белка перфорина, который подобно мембраноатакующему комплексу комплемента образует поры в мембранах клеток-мишеней.
9.2.3. Гуморальные факторы
Система комплемента. Система комплемента - это многокомпонентная полиферментная самособирающаяся система сывороточных белков, которые в норме находятся в неактивном состоянии. При появлении во внутренней среде микробных продуктов запускается процесс, который называют активацией комплемента. Активация протекает по типу каскадной реакции, когда каждый предшествующий компонент системы активирует последующий. В процессе самосборки системы образуются активные продукты распада белков, которые выполняют три важнейшие функции: вызывают перфорацию мембран и лизис клеток, обеспечивают опсонизацию микроорганизмов для их дальнейшего фагоцитоза и инициируют развитие сосудистых реакций воспаления.
Комплемент под названием «алексин» был описан в 1899 г. французским микробиологом Ж. Борде, а затем немецким микробиологом П. Эрлихом назван комплементом (complement - дополнение) как фактор, дополнительный к антителам, вызывающим лизис клеток.
В систему комплемента входит 9 основных белков (обозначаемых как С1, С2-С9), а также субкомпоненты - продукты расщепления этих белков (Clg, С3в, С3а и т.д.), ингибиторы.
Ключевым событием для системы комплемента является его активация. Она может происходить тремя путями: классическим, лектиновым и альтернативным (рис. 9.3).
Классический путь. При классическом пути активирующим фактором являются комплексы антиген-антитело. При этом Fс-фрагмент и IgG иммунных комплексов активирует Сгсубкомпонент, Сг расщепляется с образованием Cls, гидролизующей С4, который расщепляется на С4а (анафилотоксин) и С4в. С4в активирует С2, который, в свою очередь, активизирует С3- компонент (ключевой компонент системы). С3-компонент расщепляется на анафилотоксин С3а и опсонин С3в. Активация С5- компонента комплемента также сопровождается образованием двух активных фрагментов белков: С5а - анафилотоксина, хемоаттрактанта для нейтрофилов и С5в - активирующего С6-компонент. В итоге образуется комплекс С5, б, 7, 8, 9, который называется мембраноатакующим. Терминальная фаза активации комплемента - это образование трансмембранной поры в клетке, выход ее содержимого наружу. В итоге клетка набухает и лизируется.
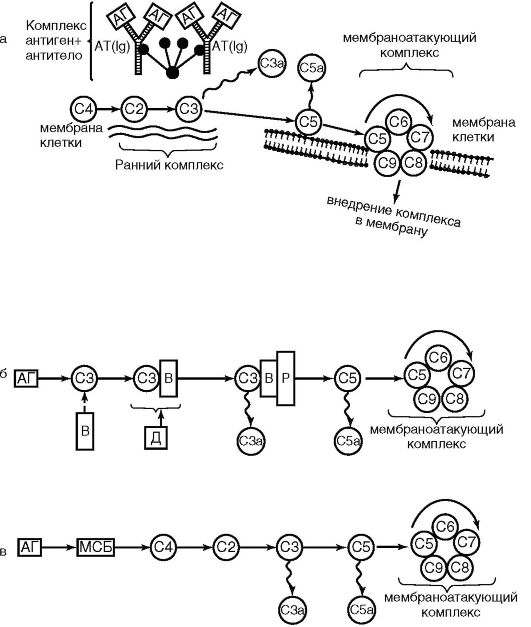 Рис. 9.3.
Пути
активации комплемента: классический (а); альтернативный (б); лектиновый
(в); С1-С9 - компоненты комплемента; АГ - антиген; АТ - антитело; ВиД -
протеины; Р - пропердин; МСБ - маннозосвязывающий белок
Рис. 9.3.
Пути
активации комплемента: классический (а); альтернативный (б); лектиновый
(в); С1-С9 - компоненты комплемента; АГ - антиген; АТ - антитело; ВиД -
протеины; Р - пропердин; МСБ - маннозосвязывающий белок
Лектиновый путь. Он во многом аналогичен классическому. Различие заключается лишь в том, что при лектиновом пути один из белков острой фазы - связывающий маннозу лектин взаимодействует с маннозой на поверхности микробных клеток (прообраз комплекса антиген-антитело), и этот комплекс активирует С4 и С2.
Альтернативный путь. Он идет без участия антител и минуя первые 3 компонента С1-С4-С2. Инициируют альтернативный путь компоненты клеточной стенки грамотрицательных бактерий (липополисахариды, пептидогликаны), вирусы, которые связываются последовательно с белками Р (пропердин), В и D. Эти комплексы напрямую конвертируют С3-компонент.
Сложная каскадная реакция комплемента протекает только в присутствии ионов Са и Mg.
Биологические эффекты продуктов активации комплемента:
Вне зависимости от пути активация комплемента завершается образованием мембраноатакующего комплекса (С5, б, 7, 8, 9) и лизисом клеток (бактерий, эритроцитов и других клеток);
Образующиеся С3а-, С4а- и С5а-компоненты являются анафилотоксинами, они связываются с рецепторами кровяных и тканевых базофилов, индуцируют их дегрануляцию - выброс гистамина, серотонина и других вазоактивных медиаторов (медиаторов воспалительного ответа). Кроме этого С5а является хемоаттрактантом для фагоцитов, он привлекает эти клетки в очаг воспаления;
С3в, С4в являются опсонинами, повышают адгезию иммунных комплексов с мембранами макрофагов, нейтрофилов, эритроцитов и тем самым усиливают фагоцитоз.
Растворимые рецепторы для патогенов. Это белки крови, непосредственно связывающиеся с различными консервативными, повторяющимися углеводными или липидными структурами микробной клетки (pattern -структурами). Эти белки обладают опсоническими свойствами, некоторые из них активируют комплемент.
Основную часть растворимых рецепторов составляют белки острой фазы. Концентрация этих белков в крови быстро нарастает в ответ на развитие воспаления при инфекции или повреждении тканей. К белкам острой фазы относятся:
С-реактивный белок (он составляет основную массу белков острой фазы), получивший название вследствие способности
связываться с фосфорилхолином (С-полисахаридом) пневмококков. Образование комплекса С-реактивный белок- фосфорилхолин способствует фагоцитозу бактерий, поскольку комплекс связывается с Clg и активирует классический путь комплемента. Белок синтезируется в печени, и его концентрация быстро нарастает в ответ на интерлейкин-б;
Сывороточный амилоид Р близок по структуре и функции к С-реактивному белку;
Маннозосвязывающий лектин активирует комплемент по лектиновому пути, является одним из представителей сывороточных белков-коллектинов, распознающих углеводные остатки и действующих как опсонины. Синтезируется в печени;
Белки сурфактанта легких также принадлежат к семейству коллектинов. Обладают опсоническим свойством, особенно в отношении одноклеточного гриба Pneumocystis carinii;
Другую группу белков острой фазы составляют белки, связывающие железо, - трансферрин, гаптоглобин, гемопексин. Такие белки препятствуют размножению бактерий, нуждающихся в этом элементе.
Антимикробные пептиды. Одним из таких пептидов является лизоцим. Лизоцим - это фермент муромидаза с молекулярной массой 14 000-1б 000, вызывающий гидролиз муреина (пептидогликана) клеточной стенки бактерий и их лизис. Открыт в 1909 г. П.Л. Лащенковым, выделен в 1922 г. А. Флемингом.
Лизоцим содержится во всех биологических жидкостях: сыворотке крови, слюне, слезе, молоке. Он продуцируется нейтрофилами и макрофагами (содержится в их гранулах). Лизоцим в большей степени действует на грамположительные бактерии, основу клеточной стенки которых составляет пептидогликан. Клеточные стенки грамотрицательных бактерий также могут повреждаться лизоцимом, если на них предварительно подействовал мембраноатакующий комплекс системы комплемента.
Дефензины и кателицидины - пептиды, обладающие антимикробной активностью. Они образуются клетками многих эукариот, содержат 13-18 аминокислотных остатков. На сегодняшний день известно около 500 таких пептидов. У млекопитающих бактерицидные пептиды относятся к семействам дефензинов и кателицидинов. В гранулах человеческих макрофагов, нейтрофилов содержатся α-дефензины. Они синтезируются также эпителиальными клетками кишечника, легких, мочевого пузыря.
Семейство интерферонов. Интерферон (ИФН) был открыт в 1957 г. А. Айзексом и Ж. Линдеманом при изучении интерференции вирусов (от лат. inter - между, ferens - несущий). Интерференция - это явление, когда ткани, инфицированные одним вирусом, становятся устойчивыми к заражению другим вирусом. Было установлено, что такая резистентность связана с продукцией зараженными клетками особого белка, который и был назван интерфероном.
В настоящее время интерфероны хорошо изучены. Они представляют собой семейство гликопротеидов с молекулярной массой от 15 000 до 70 000. В зависимости от источника получения эти белки делят на интерфероны I и II типов.
I тип включает ИФН α и β, которые продуцируются инфицированным вирусом клетками: ИФН-α - лейкоцитами, ИФН-β - фибробластами. В последние годы описаны три новых интерферона: ИФН-τ / ε (трофобластный ИФН), ИФН-λ и ИФН-К. В противовирусной защите участвуют ИФН-α и β.
Механизм действия ИФН-α и β не связан с прямым влиянием на вирусы. Он обусловлен активацией в клетке ряда генов, блокирующих репродукцию вируса. Ключевое звено - индукция синтеза протеинкиназы R, которая нарушает трансляцию вирусной мРНК и запускает апоптоз зараженных клеток через Вс1-2 и каспазазависимые реакции. Другой механизм - это активация латентной РНК-эндонуклеазы, которая вызывает деструкцию вирусной нуклеиновой кислоты.
II тип включает интерферон γ. Он продуцируется Т-лимфоцитами и естественными киллерами после антигенной стимуляции.
Интерферон синтезируется клетками постоянно, его концентрация в крови в норме мало меняется. Однако продукция ИФ усиливается при заражении клеток вирусами или действии его индукторов - интерфероногенов (вирусной РНК, ДНК, сложных полимеров).
В настоящее время интерфероны (как лейкоцитарные, так и рекомбинантные) и интерфероногены широко применяются в клинической практике для профилактики и лечения острых вирусных инфекций (грипп), а также с терапевтической целью при хронических вирусных инфекциях (гепатиты В, С, герпес, рассеянный склероз и др.). Поскольку интерфероны обладают не только противовирусной, но и противоопухолевой активностью, они применяются также для лечения онкологических заболеваний.
9.2.4. Особенности врожденного и приобретенного иммунитета
В настоящее время факторы врожденного иммунитета не принято называть неспецифическими. Забарьерные механизмы врожденного и приобретенного иммунитета отличаются лишь точностью настройки на «чужое». Фагоциты и растворимые рецепторы врожденного иммунитета распознают «образы», а лимфоциты детали такой картины. Врожденный иммунитет является эволюционно более древним способом защиты, присущим практически всем живым существам от многоклеточных, растений до млекопитающих благодаря быстроте реакции на вторжение чужеродного агента, именно он составляет основу резистентности к инфекции и защищает организм от большинства патогенных микробов. Лишь те возбудители, с которыми не справляются факторы врожденного иммунитета, включают лимфоцитарный иммунитет.
Разделение механизмов антимикробной защиты на врожденные и приобретенные или на доиммунные и иммунные (по Хаитову Р.М., 200б) условно, поскольку если рассматривать иммунный процесс во времени, то и те и другие являются звеньями одной цепи: вначале срабатывают фагоциты и растворимые рецепторы к pattern -структурам микробов, без такой редакции в последующем невозможно развитие лимфоцитарного ответа, вслед за этим лимфоциты вновь привлекают фагоциты в качестве эффекторных клеток для деструкции патогенов.
Вместе с тем деление иммунитета на врожденный и приобретенный целесообразно для лучшего осмысления этого сложного явления (табл. 9.2). Механизмы врожденной сопротивляемости обеспечивают быструю защиту, вслед за чем организм выстраивает более прочную, эшелонированную оборону.
Таблица 9.2. Особенности врожденного и приобретенного иммунитета
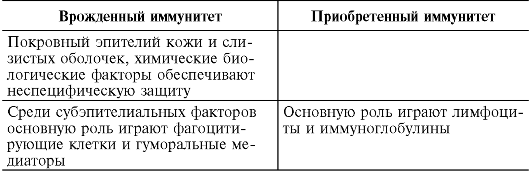 Окончание табл. 9.2
Окончание табл. 9.2
 Задания для самоподготовки (самоконтроля)
Задания для самоподготовки (самоконтроля)
Множество веществ и инфекций (микроорганизмов, вирусов), проникая в организм, вызывают заболевания. Опасны и внутренние враги организма — его погибшие клетки, раковые или инфицированные вирусами. Однако наш организм способен защищать себя от внешних и внутренних чужеродных агентов. Эту способность называют иммунитетом. Иммунитет обеспечивает иммунная система организма. ее составляющими являются клетки лейкоциты и органы, в которых они размножаются и специализируются (созревают). Это красный костный мозг, вилочковая железа (тимус), селезенка, лимфатические узлы и лимфоидные ткани, расположенные в пищеварительной, дыхательной, мочевыделительной системах. Все лейкоциты образуются в костном мозге, а созревают в различных органах. Исходя из них, лейкоциты циркулируют вместе кровью и лимфой и попадают в ткани.
К лейкоцитам относят несколько видов клеток различного строения (лимфоциты, моноциты, эозинофилы и т.д.). Лимфоциты делятся на Т-лимфоциты (созревают в тимусе) и В-лимфоциты (созревают в костном мозге).
Значительное количество лейкоцитов различных видов (53-81%) способны к фагоцитозу. Больше фагоцитов размещается в соединительных тканях почек, легких, печени, кожи.
Неспецифический врожденный иммунитет
Препятствуют проникновению чужаков в организм кожа и слизистые оболочки. Шелушение отмерших клеток эпителия кожи и движение ворсинок слизистой оболочки удаляют их, а разрушают — бактерицидные вещества секретов потовых и сальных желез, слизи эпителия т.п..
Если чужеродные агенты проникли в организм, к ним направляются фагоциты и уничтожают агрессоров. В случае проникновения большого количества иностранцев или массовой гибели фагоцитов в бою с ними костный мозг ускоряет размножение таких клеток, и новые силы становятся к борьбе. Так действует клеточный иммунитет. Он тесно связан с гуморальными факторами иммунитета — определенными белками, которые постоянно присутствуют в крови. Одни белки прикрепляются к мембране микроорганизма, обозначая чужака — это облегчает фагоцитоз. Другие участвуют в разрушении мембраны чужеродной клетки. Бороться с вирусами помогают организму белки плазмы крови интерфероны.
Фагоциты и
Фагоциты и гуморальные факторы иммунитета , которые действуют на первой стадии борьбы, влияют на всех агрессоров в те же способы. Эти способы защиты является унаследованными, т.е. врожденными. Поэтому такой иммунитет называют неспецифическим врожденным.
Специфический приобретенный иммунитет. Организм не всегда может справиться с чужеродными агентами с помощью неспецифического иммунитета. Следовательно, он применяет другие методы — такие, которые действуют на агрессоров в соответствии с их особенностей. В этих специфических реакциях организма также выделяют два звена — гуморальную и клеточную. Гуморальный иммунитет осуществляется благодаря В-лимфоцитам, а клеточный — Т-лимфоцитамы.
Гуморальными факторами
Гуморальными факторами специфических иммунных реакций антитела — белки-иммуно-глобулины. их производят В-лимфоциты в ответ на антигены — вещества, которые организм воспринимает как чужеродные. Обычно это определенные белки в оболочках агрессоров или токсины, которые они производят. В-лимфоциты реагируют на каждый антиген образованием антитела, соответствует именно этому антигену. Эти белки соединяются с антигеном и образуют комплексы «антиген-антитело» — происходит нейтрализация и антигена, и агрессора.
Клеточное звено
Клеточное звено специфического иммунитета уничтожает чужеземцев иначе. Так, Т-лимфоциты могут прикрепляться к мембранам клеток, пораженных вирусом или бактерией, и разрушать их.
Последствия разрушительной деятельности В-и Т-лимфоцитов ликвидируют фагоциты, пожирающие нейтрализованных агрессоров и погибшие клетки.
Лимфоциты, циркулирующие кровотока и лимфотока, активируются, только распознав антиген. Опознанию ими антигена, который впервые попал в организм человека, — сложный процесс, который может длиться до 14 дней. Его следствием является иммунный ответ, в ней обычно участвуют и Т-и В-лимфоциты. В-лимфоциты, распознали антиген, начинают синтезировать антитела к нему. Одновременно в органах иммунной системы размножаются В-лимфоциты, которые также чувствительны к данному антигену. Одни из них присоединяются к гуморального атаки, производя антитела с огромной скоростью (до 30 000 молекул в секунду). Другие В-лимфоциты становятся клетками памяти. Управляют иммунным ответом Т-лимфоциты, производя различные белки-интерлейкины. Интерлейкины могут повышать активность В-лимфоцитов или уменьшать ее, стимулировать размножение Т-лимфоцитов и образование Т-клеток памяти или подавлять эти процессы.
Клетки памяти
Клетки памяти в течение месяцев, а иногда и годами сохраняют способность реагировать на вторжение «знакомого» антигена. Они не тратят времени на его распознавание, иммунный ответ возникает сразу, и антител вырабатывается больше. Так формируется специфический приобретенный иммунитет.
Иммунный ответ
Иммунный ответ на первую встречу с инфекцией обычно сопровождается плохим самочувствием человека, повышением температуры и т.д.. Если человек приобрел иммунитета к этой инфекции, симптомы болезни не наблюдаются.
Искусственный приобретенный иммунитет. Есть инфекции, первая встреча с которыми может стать для человека смертельной. Чтобы создать против них иммунитет, прививают — вводят в организм человека вакцину. Это небольшое количество убитых или ослабленных возбудителей болезни или веществ, являющихся продуктами их жизнедеятельности. Такое заражение не приводит к болезни. Однако на введение вакцины развивается полноценная иммунная реакция: вырабатываются специфические к данному возбудителю антитела и образуются клетки памяти. Поэтому после вакцинации организм встречает живых возбудителей, вторгшиеся во всеоружии. Так вследствие введения вакцин создается искусственный приобретенный иммунитет.