Učne ure kemije v 9. razredu: "Oksidacijsko-redukcijske reakcije"
Namen lekcije:
Razmislite o bistvu redoks reakcije, ponovite osnovne pojme o stopnji oksidacije, oksidaciji in redukciji.
Oprema in reagenti: Set epruvet, raztopine: CuSO4, H2SO4, NaOH, H2O, Na2SO3.
Potek pouka kemije v 9. razredu
Organiziranje časa.
Danes bomo v razredu nadaljevali uvod v redoks reakcije, bomo utrdili znanje, pridobljeno v prejšnjih razredih, se seznanili z oksidacijsko-redukcijskimi reakcijami, ugotovili, kakšno vlogo ima okolje na potek redoks procesov. ORR sodijo med najpogostejše kemijske reakcije in so velikega pomena v teoriji in praksi. Procesi OM spremljajo cikle snovi v naravi, povezani so s presnovnimi procesi v živem organizmu, gnitjem, fermentacijo, fotosintezo. Opazimo jih lahko med zgorevanjem goriva, med taljenjem kovin, med elektrolizo in med korozijskimi procesi. (diapozitivi 1-7).
Tema redoks reakcij ni nova, študente smo morali ponoviti nekatere pojme in spretnosti. Vprašanje za razred? Kaj je oksidacijsko stanje? (brez tega koncepta in zmožnosti določanja oksidacijskega stanja kemijskih elementov ni mogoče obravnavati te teme.) Učenci naj določijo oksidacijsko stanje v naslednjih spojinah: KCIO3, N2, K2Cr2O7, P2O5, KH, HNO3 . Preverite njihove naloge z zapiski na tabli. V vseh primerih pride do spremembe oksidacijskega stanja. Za to bomo izvajali laboratorijsko delo (na mizah so navodila za izvedbo poskusov, navodila, kako to narediti).
Izvajajte poskuse :1. CuSO4 + 2NaOH= Na2SO4 + Cu(OH)2
CuSO4 + Fe= CuFeSO4
Prirejajo in delajo zapiske. Zaključek: vse reakcije niso razvrščene kot ODD. (diapozitiv 8).
Kaj je bistvo OVR? (slide 9).
ORR je enotnost dveh nasprotujočih si procesov oksidacije in redukcije. Pri teh reakcijah je število elektronov, ki jih odda redukcijsko sredstvo, enako številu elektronov, ki jih pridobi oksidacijsko sredstvo. Reducent poveča svojo oksidativno stopnjo, oksidant pa zmanjša (Geslo lekcije ni bilo izbrano naključno.) Poglejmo si kemijsko reakcijo (je zelo pomembna z okoljskega vidika, saj v normalnih pogojih omogoča zbiranje po nesreči razlitega živega srebra.
n g0 + 2Fe+3Cl3-=2Fe+2Cl2-1 + Hg+2Cl2-1
Hg0 - 2ē → Hg+2
Fe+3+ē→ Fe+2
Učence prosimo, da rešijo problem. Kako okolje vpliva na obnašanje istega oksidanta, na primer: KMnO4
Laboratorijske vaje 2 se izvajajo po naslednjih možnostih:
2KMnO4+ 5Na2SO3 +3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 +3H2O
2KMnO4+ Na2SO3 2KOH= 2K2Mn04+Na2SO4 H2O
2KMnO4 +3Na2SO3 +H2O= 2KOH +3Na2SO4+ 2MnO2
Zaključek: okolje vpliva na oksidativne lastnosti snovi (diapozitiv 10)
KMnO4 v kislem okolju - Mn+2 - brezbarvna raztopina.
V nevtralnem okolju - MnO2 je rjava oborina,
V alkalnem okolju je MnO4-2 zelen.
Glede na pH raztopine KMnO4 oksidira različne snovi in se reducira v spojine Mn različnih stopenj oksidacije.
Lekcija je povzeta. Ocene so podane.
Odsev.
Razred izrazi svoje mnenje o delu v lekciji.
Domača naloga
Prenesite predstavitev za lekcijo kemije: "Oksidacijsko-redukcijske reakcije"
Lekcija kemije na temo "Oksidacijsko-redukcijske reakcije"
v 11. razredu.
Pripravljen material
Dudnik Svetlana Evgenievna,
učiteljica kemije prve kategorije
Srednja šola MAOU št. 211, Novosibirsk
Cilj:
poglabljanje znanja študentov in priprava na olimpijade in enotni državni izpit.
Naloge:
Izobraževalni cilji:
Utrditi znanje študentov o redoks reakcijah; utrditi spretnosti učencev pri sestavljanju enačb oksidacijsko-redukcijskih reakcij
razvijati spretnosti pri sestavljanju enačb redoks reakcij
razvijati veščine prepoznavanja oksidantov in reducentov
oblikovanje kemijsko pismene osebnosti, pripravljene na življenje v nenehno spreminjajočem se okolju, nadaljnje izobraževanje in samoizobraževanje.
Razvojne naloge:
prispevajo k oblikovanju in razvoju kognitivnega interesa učencev za predmet
oblikovanje veščin za analizo, primerjavo in posploševanje znanja o temi.
Izobraževalne naloge:
spodbujanje zavestne potrebe po znanju;
spodbujanje aktivnosti in samostojnosti pri obravnavi določene teme, sposobnost skupinskega dela in sposobnost poslušanja sošolcev.
Vrsta lekcije: lekcija - vaja.
Oblika organizacija izobraževalnih dejavnosti : individualno in skupinsko.
Oprema Kabina: računalnik, multimedijski projektor, platno, dokument kamera.
Učne metode:
Splošna metoda (metoda delnega iskanja).
Posebna metoda (verbalno – vizualno – praktično).
Specifična metoda (razlaga z elementi pogovora).
Med poukom
Posodabljanje znanja. Reprodukcija predhodno pridobljenega znanja.
Organiziranje časa
Sporočilo teme, določitev teme in ciljev lekcije
učiteljica.
Kaj so redoks reakcije?
Vsak ORR je niz procesov darovanja in dodajanja elektronov.
Kako se imenuje proces oddajanja elektronov?
Proces oddajanja elektronov se imenuje oksidacijo.
Kako se imenujejo delci, ki oddajajo elektrone?
Imenujemo delce (atome, molekule ali ione), ki oddajajo elektrone restavratorji.
učiteljica.
Zaradi oksidacije se oksidacijsko stanje reducenta poveča. Reducenti so lahko delci v nižjih ali srednjih oksidacijskih stopnjah. Najpomembnejši reducenti so: vse kovine v obliki enostavnih snovi, zlasti aktivne; C, CO, NH 3, PH 3, CH 4, SiH 4, H 2 S in sulfidi, vodikovi halogenidi in kovinski halogenidi, kovinski hidridi, kovinski nitridi in fosfidi.
Kako se imenuje postopek dodajanja elektronov in delcev, ki sprejemajo elektrone?
Postopek dodajanja elektronov imenujemo obnova. Imenujemo delce, ki sprejemajo elektrone oksidanti.
učiteljica.
Zaradi redukcije se oksidacijsko stanje oksidanta zmanjša. Oksidanti so lahko delci v višjih ali vmesnih oksidacijskih stopnjah. Najpomembnejši oksidanti: enostavne nekovinske snovi z visoko elektronegativnostjo (F 2, Cl 2, O 2), kalijev permanganat, kromati in dikromati, dušikova kislina in nitrati, koncentrirana žveplova kislina, perklorova kislina in perklorati.
Delovanje z znanjem, obvladovanje metod delovanja v novih razmerah
Učenci opravljajo TEST o oksidacijskem stanju (Priloga 4.)
Posploševanje in sistematizacija znanja in metod delovanja.
učiteljica.
Obstajajo tri vrste redoks reakcij.
Medmolekularno OVR - oksidant in reducent sta vključena v različne snovi, na primer:
Intramolekularno OVR – oksidant in reducent sta del ene snovi. To so lahko različni elementi, na primer:

ali en kemični element v različnih oksidacijskih stanjih, na primer:

Disproporcionalnost (avtooksidacija-samozdravljenje)– sta oksidant in reducent isti element, ki je v vmesnem oksidacijskem stanju, npr.

Za sestavljanje enačb ORR lahko uporabite metodo elektronskega ravnovesja (elektronska vezja) ali metodo ravnotežja elektronov in ionov. Razmislimo o eni od metod.
Metoda elektronske tehtnice:

1. vaja. Sestavite enačbe OVR z metodo elektronske tehtnice, določite vrsto OVR.
1. Cink + kalijev dikromat + žveplova kislina = cinkov sulfat + kromov (III) sulfat + kalijev sulfat + voda.
rešitev
Elektronska tehtnica:

2. Kositrov(II) sulfat + kalijev permanganat + žveplova kislina = kositrov(IV) sulfat + manganov sulfat + kalijev sulfat + voda.
3. Natrijev jodid + kalijev permanganat + kalijev hidroksid = jod + kalijev manganat + natrijev hidroksid.
4. Žveplo + kalijev klorat + voda = klor + kalijev sulfat + žveplova kislina.
5. Kalijev jodid + kalijev permanganat + žveplova kislina = manganov(II) sulfat + jod + kalijev sulfat + voda.
6. Železov(II) sulfat + kalijev dikromat + žveplova kislina = železov(III) sulfat + kromov(III) sulfat + kalijev sulfat + voda.
7. Amonijev nitrat = dušikov oksid (I) + voda.
Odgovori na naloge 1. naloge

Naloga 3. Sestavite enačbe OVR.
2. Manganov(IV) oksid + kisik + kalijev hidroksid = kalijev manganat +..................................
3. Železov(II) sulfat + brom + žveplova kislina = .......................
4. Kalijev jodid + železov(III) sulfat = ....................... .
5. Vodikov bromid + kalijev permanganat = ..................................
6. Vodikov klorid + kromov (VI) oksid = kromov (III) klorid + .......................
7. Amoniak + brom = ........................
8. Bakrov(I) oksid + dušikova kislina = dušikov oksid(II) + .......................
9. Kalijev sulfid + kalijev manganat + voda = žveplo + .......................
10. Dušikov oksid (IV) + kalijev permanganat + voda = .......................
11. Kalijev jodid + kalijev dikromat + žveplova kislina = ..................................
Odgovori na nalogo 3. vaje
Opredelitev in razlaga domače naloge.
Priloga 1.
Reduktorji:
Ogljikov(II) monoksid (CO)
Vodikov sulfid (H2S)
žveplov oksid (IV) (SO2)
žveplova kislina H2SO3 in njene soli
Halovodikove kisline in njihove soli
Kovinski kationi v nižjih oksidacijskih stopnjah: SnCl2, FeCl2, MnSO4, Cr2(SO4)3
Dušikova kislina HNO2
amoniak NH3
hidrazin NH2NH2
dušikov oksid (II) (NO)
Katoda med elektrolizo
Oksidanti:
Halogeni
Kalijev permanganat (KMnO4)
Kalijev manganat (K2MnO4)
manganov(IV) oksid (MnO2)
Kalijev dikromat (K2Cr2O7)
Kalijev kromat (K2CrO4)
Dušikova kislina (HNO3)
Žveplova kislina (H2SO4) konc.
bakrov(II) oksid (CuO)
svinčev (IV) oksid (PbO2)
srebrov oksid (Ag2O)
vodikov peroksid (H2O2)
Železov(III) klorid (FeCl3)
Bertoletova sol (KClO3)
Anoda med elektrolizo.
Dodatek 2.
Pravila za določanje stopnje oksidacije
Oksidacijsko stanje atomov enostavnih snovi je nič.
Vsota oksidacijskih stanj atomov v kompleksni snovi (v molekuli) je nič.
Oksidacijsko stanje atomov alkalijskih kovin je +1.
Oksidacijsko stanje atomov zemeljskoalkalijskih kovin je +2.
Oksidacijsko stanje atomov bora in aluminija je +3.
Oksidacijsko stanje vodikovih atomov je +1 (v hidridih alkalijskih in zemeljskoalkalijskih kovin –1).
Oksidacijsko stanje atomov kisika je –2 (v peroksidih –1).
Dodatek 3.
Beležka
možna oksidacijska stanja elementov
Mangan: +2, +3, +4, +6, +7.
Krom: +2, +3, +6.
Železo: +2, +3, +6.
Dušik: -3, 0, +1, +2, +4, +5.
Žveplo: -2, 0, +4, +6.
Fosfor: -3, 0, +3, +5.
Klor: -1, 0, +1, + 3, +5, +7.
Kovine z višjimi stopnjami oksidacije tvorijo kisle okside.
Kalijev permanganat: KMnO 4.
Je močan oksidant. Z lahkoto oksidira številne organske snovi, pretvarja železove (2) soli v železove (3) soli, žveplovo kislino v žveplovo kislino in iz klorovodikove kisline sprošča klor.
Pri vstopu v kemične reakcije se lahko ion MnO 4 - zmanjša v različnih stopnjah:
V kislem okolju (pH
V nevtralnem okolju (pH=7) do MnO 2.
V alkalnem okolju (pH>7) do MnO 4 2-
Vodikov peroksid.
Oksidacijsko stanje elementa kisika v vodikovem peroksidu je
1, tj. ima vmesno vrednost med oksidacijskim stanjem elementa kisika v vodi (-2) in v molekularnem kisiku (0). Zato vodikov peroksid kaže redoks dvojnost.
Če peroksid služi kot oksidant, se reducira v vodo H 2 O.
Če peroksid služi kot redukcijsko sredstvo, potem se oksidira v molekularni kisik-O 2.
Kromatne in dikromatne soli.
Kromati (obarvani svetlo rumeno) se v kislem okolju spremenijo v dikromate (oranžne), dikromati v alkalnem okolju pa v kromate.
Kromati in dikromati so močni oksidanti in v enačbah redoks reakcij spremenijo oksidacijsko stanje od +6 do +3.
Klorove spojine.
HClO-hipoklorova kislina (hipokloritne soli)
HClO 2 -klorid (kloritne soli)
HClO 3 -klorat (kloratne soli)
HClO 4 -klor (perkloratne soli)
Ko halogeni medsebojno delujejo z alkalijami, se v hladni raztopini tvorijo hipokloriti, v vroči raztopini pa klorati (na primer kalijev klorat ali bertholletova sol-KClO 3).
Koncentrirana dušikova kislina
Če se koncentrirana dušikova kislina vzame kot izhodiščni material za ORR z drugimi snovmi, se kot rezultat reakcije reducira v dušikov oksid NO 2
Dodatek 4.
TEST “Oksidacijska stanja”
Možnost 1.
1 .
Ion, ki vsebuje 16 protonov in 18 elektronov, ima naboj
1) +4 2) -2 3) +2 4) -4
2. Ion ima zunanjo lupino z osmimi elektroni
1) P 3+ 2) S 2- 3) C1 5+ 4) Fe 2+
3. Ca 2+ in
1) K + 2) Ne 0 3) Ba 2+ 4) F -
4. Elektronska konfiguracijaje 2 2 s 2 2 str 6 ustreza ionu
1) A1 3+ 2) Fe 3+ 3) Zn 2+ 4) Cr 3+
Možnost 2.
1. Ion ima zunanjo lupino z dvema elektronoma
1) S 6+ 2) S 2- 3) Br 5+ 4) Sn 4+
2. Elektronska konfiguracija Je 2 2s 2 2p 6 3s 2 3p 6 ustreza ionu
1) C l - 2) N 3- 3) Br - 4) O 2-
3. Delci imajo enako elektronsko strukturo
1) Na 0 in Na + 2) Na 0 in K 0 3) Na + in F - 4) Cr 2+ in Cr 3+
4. Ion Al 3+ ima naslednjo elektronsko konfiguracijo:
1) 1s 2 2s 2 2p 6 2) 1s 2 2s 2 2p 6 3s 1 3) 1s 2 2s 2 2p 6 3s 2 3p 1 4) Je 2 2s 2 2p 6 3s 2 3p 6 4s 1
odgovori :
Možnost 1.
Možnost 2.
Dodatek 5.
Domača naloga
Naloga. Zlitine na osnovi bakra se imenujejo bron. Prstani iz berilijevega brona so natančna kopija zlatih. Od zlatih se ne razlikujejo ne po barvi ne po teži in obešene na nitki ob udarcu ob kozarec oddajajo melodičen zvok. Skratka, ponaredka ni mogoče zaznati z očesom, ušesom ali zobom. Predlagajte načine za prepoznavanje ponaredka: v lastni kuhinji, v kemijskem laboratoriju (2 načina). Zapiši reakcijske enačbe in poimenuj njihove značilnosti.
Odgovori.
V kuhinji."Zlati" prstan segrejte na plinskem štedilniku; baker na zraku oksidira v črni bakrov (II) oksid CuO (to pomeni, da bronast prstan pri segrevanju potemni).
V laboratoriju. Obroč raztopite v dušikovi kislini. Zlato visoke čistosti se ne raztopi v dušikovi kislini, vendar baker, ki je del brona, sodeluje s HNO 3. Znaki: modra raztopina, sproščanje rjavega plina "lisičjega repa".
Cu + 4HNO 3 konc. = Cu(NO 3) 2 + 2NO 2 + 2H 2 O
Zlato se ne topi v konc. H 2 SO 4, vendar se baker pri segrevanju raztopi:
Сu + 2H 2 SO 4 konc. = CuSO 4 + SO 2 + 2H 2 O
Znaki: modra raztopina, nastajanje plina.
Analiza izvedene lekcije
Pouk je potekal v 11. razredu. Zastavljeni cilj - poglobitev znanja učencev in priprava na olimpijade in enotni državni izpit - je bil dosežen. Dijaki so dobili opomnike, ki so potrebni za popolnejše razumevanje teme in so jih uporabljali pri domačih nalogah.
Glavne težave, ki jih imajo učenci pri obvladovanju vsebine učnega gradiva na temo »Oksidacijsko-redukcijske reakcije«, so povezane s sestavljanjem ORR z metodo elektronskega ravnovesja.
Z algoritmom, ki ga je sestavil učitelj skupaj z učenci, je bilo mogoče popraviti osnovne korake za pisanje OVR in se izogniti osnovnim napakam.
2 Lekcija kemije v 8. razredu na temo "Oksidacijsko-redukcijske reakcije"
Opomba: Učna ura kemije na temo “Oksidacijsko-redukcijske reakcije” je namenjena učencem 8. razreda. Lekcija razkrije osnovne pojme redoks reakcij: oksidacijsko stanje, oksidant, reducent, oksidacija, redukcija: razvija se sposobnost sestavljanja redoks zapisov z metodo elektronske tehtnice.
Pouk kemije v 8. razredu na temo
"Oksidacijsko-redukcijske reakcije"
NAMEN LEKCIJE: oblikovati sistem znanja o redoks reakcijah, naučiti se zapisovati ORR z metodo elektronske tehtnice.
CILJI LEKCIJE:
Poučna: razmislite o bistvu redoks procesov, naučite se uporabljati "stopnje oksidacije" za določanje procesov oksidacije in redukcije; študente naučiti izenačiti zapise redoks reakcij z metodo elektronske tehtnice.
Razvojni: Izboljšati sposobnost presojanja o vrsti kemijske reakcije z analizo stopnje oksidacije atomov v snoveh; sklepati, delati z algoritmi, razvijati zanimanje za predmet.
Izobraževanje: oblikovati potrebo po kognitivni dejavnosti in vrednostnem odnosu do znanja; analizirati odgovore svojih tovarišev, napovedati rezultat dela, oceniti svoje delo; gojiti kulturo komuniciranja z delom v parih »učenec-učenec«, »učitelj-učenec«.
Vrsta lekcije: Lekcija učenja nove snovi.
Metode, uporabljene v lekciji: Pojasnjevalno ali lustrativno.
Koncepti, predstavljeni v lekciji: redoks reakcije; oksidant; redukcijsko sredstvo; proces oksidacije; proces okrevanja.
Uporabljena opremain reagenti: tabela topnosti, periodni sistem D. I. Mendelejeva, klorovodikova kislina, žveplova kislina, cinkova zrnca, magnezijevi ostružki, raztopina bakrovega sulfata, železov žebelj.
Oblika dela: individualno, frontalno.
Čas pouka: (90 minut, 2 učni uri).
Med poukom
jaz . Organiziranje časa
II . Ponovitev obravnavane snovi
UČITELJICA: Fantje, spomnimo se predhodno preučenega gradiva o stopnji oksidacije, ki ga bomo potrebovali v lekciji.
Ustno frontalno anketiranje:
Kaj je elektronegativnost?
Kaj je oksidacijsko stanje?
Ali je lahko oksidacijsko število elementa nič? V katerih primerih?
Kakšno oksidacijsko stanje ima kisik najpogosteje v spojinah?
Ne pozabite na izjeme.
Kakšno oksidacijsko stanje imajo kovine v polarnih in ionskih spojinah?
Kako se izračuna oksidacijsko stanje s formulami spojin?
Oksidacijsko stanje kisika je skoraj vedno -2.
Oksidacijsko stanje vodika je skoraj vedno +1.
Stopnja oksidacije kovin je vedno pozitivna in je pri največji vrednosti skoraj vedno enaka številu skupine.
Oksidacijsko stanje prostih atomov in atomov v enostavnih snoveh je vedno 0.
Skupno oksidacijsko stanje atomov vseh elementov v spojini je 0.
UČITELJICA Da bi utrdil oblikovana pravila, študente povabi k izračunavanju - najti oksidacijsko stanje elementov v enostavnih snoveh in spojinah:
S, H 2, H 3 PO 4, NaHSO 3, HNO 3, Cu(NO 2) 2, NO 2, Ba, Al.
Na primer: Kakšno bo oksidacijsko stanje žvepla v žveplovi kislini?
V molekulah je algebraična vsota oksidacijskih stanj elementov, upoštevajoč število njihovih atomov, enaka 0.
H 2 +1 S x O 4 -2
(+1) * 2 +X *1 + (-2) . 4 = 0
X = + 6
H 2 +1 S +6 O 4 -2
III . Učenje nove snovi
UČITELJICA: Različne klasifikacije kemijskih reakcij glede na različne značilnosti (smer, število in sestava reagirajočih in tvornih snovi, uporaba katalizatorja, toplotni učinek) lahko dopolnite še z eno funkcijo. Ta znak je sprememba oksidacijskega stanja atomov kemičnih elementov, ki tvorijo reagirajoče snovi.
Na podlagi tega ločimo reakcije
Kemijske reakcije
Reakcije, ki potekajo s spremembo v reakcije, ki potekajo brez spremembe oksidacijskega stanja elementov oksidacijska stanja elementov.
Na primer, v reakciji
1 +5 -2 +1 -1 +1 -1 +1 +5 -2
AgNO 3 + HCl AgCl + HNO 3 (učenec piše na tablo)
Oksidacijska stanja atomov kemičnih elementov se po reakciji niso spremenila. Toda v drugi reakciji - interakcija klorovodikove kisline s cinkom
2HCl + Zn ZnCl 2 + H 2 (učenec piše na tablo)
atoma dveh elementov, vodika in cinka, sta spremenila svoja oksidacijska stanja: vodik iz +1 na 0, cink pa iz 0 na +2. Zato je v tej reakciji vsak atom vodika prejel en elektron
2H + 2eH2
in vsak atom cinka je oddal dva elektrona
Zn - 2е Zn
UČITELJICA: Katere vrste kemijskih reakcij poznate?
OPOZORILO: ORR vključuje vse substitucijske reakcije, pa tudi tiste reakcije spojine in razgradnje, pri katerih vsaj eno preprosto snov.
UČITELJICA: Določite OVR.
Kemijske reakcije, ki povzročijo spremembo oksidacijskih stanj atomov kemičnih elementov ali ionov, ki tvorijo reagirajoče snovi, imenujemo redoks reakcije.
UČITELJICA: Fantje, ustno določite, katera od predlaganih reakcij ni redoks:
1) 2Na + Cl 2 = 2NaCl
2) Na CL + AgNO 3 = NaNO 3 +AgCl↓
3) Zn + 2HCl = ZnCl 2 + H 2
4) S + O 2 = SO 2
UČENCI: dokončati nalogo
UČITELJICA: Kot primere OVR bomo prikazali naslednjo izkušnjo.
H 2 SO 4 + Mg MgSO 4 + H 2
Označimo oksidacijsko stanje vseh elementov v formulah snovi - reagentov in produktov te reakcije:
Kot je razvidno iz reakcijske enačbe, sta atoma dveh elementov, magnezija in vodika, spremenila svoja oksidacijska stanja.
Kaj se jim je zgodilo?
Magnezij iz nevtralnega atoma se je spremenil v pogojni ion v oksidacijskem stanju +2, to je opustil 2e:
Mg 0 – 2е Mg +2
Zapišite v svoje zapiske:
Imenujemo elemente ali snovi, ki oddajajo elektrone reducenti; med reakcijo so oksidirajo.
Pogojni H ion v oksidacijskem stanju +1 se je spremenil v nevtralni atom, to je, da je vsak atom vodika prejel en elektron.
2Н +1 +2е Н 2
Imenujemo elemente ali snovi, ki sprejemajo elektrone oksidanti; med reakcijo so okrevajo.<Приложение 1>
Te procese lahko predstavimo kot diagram:
Klorovodikova kislina + magnezijev magnezijev sulfat + vodik
CuSO 4 + Fe (železen žebelj) = Fe SO 4 + Cu (lep rdeč žebelj)
Fe 0 – 2 eFe +2
Cu +2 +2 eCu 0
Proces oddajanja elektronov se imenuje oksidacija in sprejemanje – obnova.
Med postopkom oksidacije se stanje oksidacije dvigne, v procesu okrevanja – gre dol.
Ti procesi so neločljivo povezani.
UČITELJICA: Izpolnimo nalogo po zgoraj opisanem primeru.
Vaja: Za redoks reakcije navedite oksidant in reducent, procese oksidacije in redukcije ter sestavite elektronske enačbe:
1) BaO + SO 2 = BaSO 3
2) CuCl 2 + Fe = FeCl 2 + Cu
3) Li + O 2 = Li 2 O 3
4) CuSO 4 + 2KOH = Cu(OH) 2 ↓ + K 2 SO 4
II del učne ure (2. učna ura)
Metoda elektronske tehtnice kot način za sestavljanje enačb OVR
Nato bomo razmislili o sestavljanju enačb za redoks reakcije z uporabo metode elektronske bilance. Metoda elektronskega ravnovesja temelji na pravilu: skupno število elektronov, ki jih reducent odda, je vedno enako skupnemu številu elektronov, ki jih pridobi oksidant.
Po razlagi učenci pod vodstvom učitelja sestavijo OVR enačbe po načrtih, ki jih je učitelj naredil za to uro. <Приложение 2>.
Opomniki se nahajajo na mizi vsakega učenca.
UČITELJICA: Med reakcijami, ki smo jih preučevali, so redoks reakcije:
Interakcija kovine z nekovinami
2Mg + O 2 = 2MgO
Oksidant O 2 +4e 2O -2 1 redukcija
2. Interakcija kovine s kislino.
H 2 SO 4 + Mg = MgSO 4 + H 2
Reducent Mg 0 -2e Mg +2 2 oksidacija
Oksidant 2O -2 +4e O 2 0 1 redukcija
3. Interakcija kovine s soljo.
Cu SO 4 + Mg = MgSO 4 + Cu
Reducent Mg 0 -2e Mg +2 2 oksidacija
Oksidant Cu +2 +2e Cu 0 1 redukcija
Reakcija je narekovana, en učenec samostojno sestavi reakcijski diagram za tablo:
H 2 + O 2 → H 2 O
Ugotovimo, kateri atomi elementov spremenijo oksidacijsko stanje.
(H 2 ° + O 2 ° → H 2 O 2).
Sestavimo elektronske enačbe za procese oksidacije in redukcije.
(H 2 ° -2e → 2H + – proces oksidacije,
O 2 ° +4e → 2O - ² - postopek redukcije,
H 2 je redukcijsko sredstvo, O 2 je oksidant)
Izberimo skupno dividendo za dane in prejete e ter koeficiente za elektronske enačbe.
(∙2| Н 2 °-2е → 2Н + - proces oksidacije, element je redukcijsko sredstvo;
∙1| O 2 ° +4e → 2O - ² - postopek redukcije, element – oksidant).
Prenesimo te koeficiente v enačbo ORR in izberimo koeficiente pred formulami drugih snovi.
2 H 2 + O 2 → 2 H 2 O .
IV . Utrjevanje naučene snovi
Vaje za utrjevanje snovi:
Katera shema transformacije dušika ustreza tej reakcijski enačbi?
4NH 3 +5O 2 → 4NO + 6H 2 O
1) N +3 → N +2 3) N +3 → N -3
2) N -3 → N -2 4) N -3 → N +2
2) Vzpostavite ujemanje med spremembo oksidacijskega stanja atoma žveplo in shemo za preoblikovanje snovi. Zapišite številke brez presledkov in vejic.
SHEMA PREOBLIKOVANJA
A) H 2 S + O 2 → SO 2 + H 2 O
B) H 2 SO 4 + Na → Na 2 SO 4 + H 2 S + H 2 O
B) SO 2 + Br 2 + H 2 O → H 2 SO 4 + HBr
SPREMEMBA OKSIDACIJSKEGA STANJA
1) E +4 → E +6
2) E +6 → E -2
3) E +6 → E +4
4) E -2 → E +6
5) E -2 → E +4 odgovor (521)
3) Vzpostavite ujemanje med transformacijsko shemo in spremembo oksidacijskega stanja oksidacijsko sredstvo v.
SHEMA PREOBLIKOVANJA
A) Cl 2 + K 2 MnO 4 → KMnO 4 + KCl
B) NH 4 Cl + KNO 3 → KCl + N 2 O + H 2 O
B) HI + FeCl 3 → FeCl 2 + HCl + I 2
SPREMEMBA DIPLOMIJE
OKSIDACIJA OKSIDANT
1) E +6 → E +7
2) E +5 → E +1
3) E +3 → E +2
4) E 0 → E -1
5) E -1 → E 0 odgovor (423)
V. Učiteljeve zaključne besede
Redoks reakcije predstavljajo enotnost dveh nasprotujočih si procesov: oksidacije in redukcije. Pri teh reakcijah je število elektronov, ki jih oddajo reducenti, enako številu elektronov, ki jih dodajo oksidanti.Ves svet okoli nas lahko razumemo kot velikanski kemijski laboratorij, v katerem vsak dan potekajo kemične reakcije, predvsem redoks drugo.
Vjaz . Odsev.
VIII . Domača naloga:§ 43, vaja 1, 3, 7 str. 234-235.
Rabljene knjige:
Oksidacijsko stanje enostavnih snovi je 0;
Stopnja oksidacije kovin v spojinah je enaka
1. Gabrielyan O.S. "Kemija. 8. razred: učbenik. za splošno izobraževanje institucije. –M. : Bustard, 2010.
Oksidacijsko-redukcijske reakcije. Khomchenko G.P., Sevastyanova K.I. - Od razsvetljenja, 1985.
MEMO ZA ŠTUDENTE
Priloga št. 1
Najpomembnejša redukcijska in oksidacijska sredstva
|
Restavratorji |
Oksidanti |
|
|
Kovine, N 2, premog, CO – ogljikov monoksid (II) H 2 S, SO 2, H 2 SO 3 in soli HJ, HBr, HCl SnCl 2, FeSO 4, MnSO 4, Cr2(SO4)3 HNO 2 - dušikova kislina NH3 – amoniak NO - dušikov oksid (II) Aldehidi, alkoholi, mravljinčna in oksalna kislina, Katoda med elektrolizo |
Halogeni KMnO 4, K 2 MnO 4, MnO 2, K 2 Cr 2 O 7, K2CrO4 HNO 3 - dušikova kislina H 2 O 2 – vodikov peroksid O 3 – ozon, O 2 H 2 SO 4 (konc.), H 2 S eO 4 CuO, Ag 2 O, PbO 2 Ioni plemenitih kovin (Ag+, Au3+) FeCl3 Hipokloriti, klorati in perklorati "Aqua regia" Anoda med elektrolizo |
|
Priloga št. 2
Algoritem za sestavljanje kemijskih enačb z metodo elektronske tehtnice:
1. Nariši reakcijski diagram.
2. Določite oksidacijska stanja elementov v reaktantih in reakcijskih produktih.
Ne pozabite!
številka skupine teh kovin (zajaz - III skupine).
Oksidacijsko stanje atoma kisika v
povezave je običajno enako - 2, razen H 2 O 2 -1 in OF 2.
Oksidacijsko stanje vodikovega atoma v
povezave je običajno +1, razen MeH (hidridi).
Algebraična vsota oksidacijskih stanj
elementov v povezavah je 0.
3. Ugotovite, ali je reakcija redoks ali poteka brez spreminjanja oksidacijskih stanj elementov.
4. Podčrtaj elemente, katerih oksidacijska stanja se spreminjajo.
5. Sestavite elektronske enačbe za procese oksidacije in redukcije.
6. Ugotovite, kateri element se med reakcijo oksidira (njegovo oksidacijsko stanje se poveča) in kateri element se reducira (njegovo oksidacijsko stanje se zmanjša).
7. Na levi strani diagrama s puščicami označite proces oksidacije (izpodriv elektronov iz atoma elementa) in proces redukcije (izpodriv elektronov na atom elementa)
8. Opredelite reducent in oksidant.
9. Uravnotežite število elektronov med oksidacijskim in redukcijskim sredstvom.
10. Določite koeficiente za oksidant in reducent, produkte oksidacije in redukcije.
11. Pred formulo snovi zapišite koeficient, ki določa okolje raztopine.
12.Preveri enačbo reakcije.
Dodatek 3
Samostojno delo za preverjanje znanja
Možnost 1
1. Označite oksidacijsko stopnjo elementov v spojinah, katerih formule so IBr, TeCl 4, SeF e, NF 3, CS 2.
2. V naslednjih reakcijskih shemah označite oksidacijsko stopnjo vsakega elementa in razporedite koeficiente z metodo elektronske tehtnice:
1) F 2 + Xe → XeF 6 3) Na + Br 2 → NaBr
2) S + H 2 → H 2 S 4) N 2 + Mg → Mg 3 N 2
Možnost 2
1. Označite oksidacijsko stopnjo elementov v spojinah: H 2 S O 4, HCN, HN O 2, PC1 3
2. Dopolnite enačbe za oksidacijsko-redukcijske reakcije:
1) CI 2 + Fe → 2) F 2 + I 2 → 3) Ca + C → 4) C + H 2 →
Označite oksidacijska stanja elementov v nastalih produktih.
Možnost 3
1. Označite oksidacijsko stanje spojin s formulami XeF 4, CC 1 4, PC1 b, SnS 2.
2. Zapišite enačbe reakcij: a) raztapljanje magnezija v raztopini žveplove kisline; b) interakcija raztopine natrijevega bromida s klorom. Kateri element je oksidiran in kateri reduciran?
Možnost 4
1. Sestavite formule za naslednje spojine: a) litijev nitrid (spojina litija z dušikom); b) aluminijev sulfid (spojina aluminija z žveplom); c) fosforjev fluorid, pri katerem ima elektropozitivni element največjo stopnjo oksidacije.
2. Zapišite enačbe reakcij: a) magnezijevega jodida z bromom; b) raztapljanje magnezija v raztopini bromovodikove kisline. V vsakem primeru navedite, kaj je oksidant in kaj reducent.
Možnost 5
1. Sestavite formule za naslednje spojine: a) fluor s ksenonom; b) berilij z ogljikom, pri katerem ima elektropozitivni element največje oksidacijsko stanje.
2. Razporedite koeficiente z metodo elektronske bilance v naslednje sheme:
1) KI + Cu(N O 3 ) 2 → CuI + I 2 +KN O 3
2) MnS + HN O 3 ( konc. .) → MnS O 4 +N O 2 +H 2 O
Možnost 6
1. Navedite oksidacijska stanja posameznega elementa v spojinah s formulami Na 2 S O 3, KSO 3, NaCIO, Na 2 Cr O 4, N H 4 ClO 4, BaMn O 4.
2. Zapišite enačbe za reakcije: a) litijevega jodida s klorom; b) litij s klorovodikovo kislino. Vnesite oksidacijska stanja vseh elementov in koeficientov z metodo elektronske tehtnice.
Možnost 7
1. Izračunajte oksidacijska stanja mangana, kroma in dušika v spojinah s formulami KMnO 4, Na 2 Cr 2 O 7, NH 4 N O 3.
2. Označite oksidacijska stanja posameznega elementa in razporedite koeficiente z metodo elektronske tehtnice v naslednje diagrame:
2) H 2 S O 3 + I 2 + H 2 O → H 2 S O 4 + HI
Možnost 8
1. Kakšno je oksidacijsko stanje ogljika v ogljikovem monoksidu (IV) in ali se spreminja
Aleksandrova Anfisa Mihajlovna
Učiteljica kemije
Mestna izobraževalna ustanova "Privolzhskaya srednja šola" okrožja Volzhsky Ruske medicinske akademije
Tema: “Oksidacijsko-redukcijske reakcije”
Vrsta lekcije: pouk – posploševanje in ponavljanje snovi s kombinacijo frontalnega, parnega in individualnega dela učencev.
Vrsta lekcije- pojasnjevalno in ilustrativno.
Metode in metodološke tehnike. Besedno-vizualno in demonstracijsko-praktično. Samostojno iskanje pravilnih odgovorov, razprava o izbranem odgovoru, laboratorijski poskus, nato pisanje reakcijskih enačb, razprava o rezultatih dela.
Cilj: poglobitev znanja o sestavljanju OVR enačb z metodo elektronske tehtnice.
Cilji lekcije:
Izobraževalni: ponovite osnovne pojme o procesih oksidacije in redukcije, stopnji oksidacije, oksidantih in reducentih, razmislite o bistvu redoks reakcij, razvijete spretnosti pri sestavljanju enačb kemijskih reakcij, ki potekajo v različnih medijih z uporabo metode elektronskega ravnovesja.
Izobraževalni: prispevajo k oblikovanju in razvoju kognitivnega interesa učencev za predmet, spodbujajo razvoj govora učencev, oblikovanje sposobnosti analize, primerjave in posploševanja znanja o temi.
Izobraževalni: spodbujanje zavestne potrebe po znanju, izboljšanje sposobnosti poslušanja mnenj vsakega člana ekipe.
Reagenti: raztopine kalijevega permanganata, žveplove kisline, natrijevega sulfita, vode.
Oprema: pipete, epruvete.
Učni načrt:
I. Posodabljanje znanja.
V. Domača naloga.
VI. Refleksija in povzemanje.
Moto lekcije: "Nekdo izgubi, nekdo najde ..."
JAZ. Posodabljanje znanja.
Pogovor o predhodno preučenem gradivu.
1) Katere reakcije imenujemo redoks?
Oksidacijsko-redukcijske reakcije so reakcije, pri katerih se elektroni prenašajo z enega atoma, molekule ali iona na drugega.
2) Kaj je proces oksidacije?
Oksidacija je proces izgube elektronov in povečanja oksidacijskega stanja.
3) Kateri postopek se imenuje okrevanje?
Redukcija je proces dodajanja elektronov, oksidacijsko stanje pa se zmanjša.
4) Kako se imenujejo delci, ki oddajajo elektrone?
Atomi, molekule ali ioni, ki oddajajo elektrone, se oksidirajo; so redukcijska sredstva.
5) Kako se imenujejo delci, ki sprejemajo elektrone?
Atomi, ioni ali molekule, ki sprejemajo elektrone, so reducirani; so oksidanti.
6) Kaj je "oksidacijsko stanje"?
Oksidacijsko stanje je pogojni naboj atoma v molekuli, izračunan ob predpostavki, da je molekula sestavljena iz ionov in je na splošno električno nevtralna (pogojni naboj atoma, ki mu ga pripišemo v primeru sprejemanja ali izgubljanja elektronov) .
7) Kakšno metodo sestavljanja enačbe redoks reakcij poznate? Katero pravilo je osnova te metode?
Samostojno delo učencev za tablo z uporabo kartic (z nadaljnjim pogovorom).
1. Določite valenco in oksidacijska stanja elementov v naslednjih spojinah:
CH 4, Cl 2, CO 2, NH 3, C 2 H 4, CH 3 COOH, V 2 O 5, Na 2 B 4 O 7, KClO 4, K 2 HPO 4, Na 2 Cr 2 O 7.
Odgovor: Za dokončanje naloge lahko uporabite prilogo 1.
IV I I IV II III I IV I IV I IV II II I V II
C -4 H +1 4, Cl 0 2, C +4 O -2 2, N -3 H +1 3, C -2 2 H +1 4, C -3 H +1 3 C +3 O -2 O -2 H +1, V +5 2 O -2 5 ,
I VII II I I V II I VI II
K +1 Cl +7 O -2 4 , K +1 2 H +1 P +5 O -2 4 , Na +1 2 Cr +6 2 O -2 7 .
2. V kateri od spodnjih reakcijskih enačb kaže MnO 2 lastnosti oksidanta in v kateri reducenta?
A ) 2MnO 2 + 2H 2 SO 4 2MnSO 4 + O 2 + 2H 2 O;
b ) 2MnO 2 + O 2 + 4KOH 2K 2 MnO 4 + 2H 2 O;
V ) MnO 2 + H 2 = MnO + H 2 O;
G ) 2MnO 2 + 3NaBiO 3 + 6HNO 3 = 2HMnO 4 + 3BiONO 3 + 3NaNO 3 + 2H 2 O
odgovor:
Oksidant sprejema elektrone in hkrati se zniža oksidacijsko stanje, kar pomeni, da v primerih A in V MnO 2 je oksidant. Reducent odda elektrone in oksidacijsko stanje se poveča, kar pomeni, da v primerih b in G MnO 2 je redukcijsko sredstvo.
II. Motivacija in postavljanje ciljev.
Redoks reakcije so zelo pogoste. Povezani so na primer s procesi dihanja in presnove, ki se pojavljajo v živem organizmu, gnitjem in fermentacijo, fotosintezo. Redoks procesi spremljajo kroženje snovi v naravi. Opazimo jih lahko med zgorevanjem goriva, v korozijskih procesih kovin, med elektrolizo in taljenjem kovin. Z njihovo pomočjo se pridobivajo alkalije in kisline ter številni drugi dragoceni izdelki. Redoks reakcije so osnova za pretvorbo kemične energije v električno energijo v galvanskih in gorivnih celicah.
Težava: Za lekcijo sem pripravljal raztopino kalijevega permanganata ("kalijev permanganat"), polil kozarec z raztopino in umazal svoj najljubši kemijski plašč. Predlagajte (po opravljenem laboratorijskem poskusu) snov, ki jo lahko uporabite za čiščenje ogrinjala.
III. Razvoj in širjenje znanja.
Oksidacijsko-redukcijske reakcije lahko potekajo v različnih okoljih. Glede na okolje se lahko narava reakcije med istimi snovmi spremeni: okolje vpliva na spremembo oksidacijskih stanj atomov.
Običajno se doda žveplova kislina, da se ustvari kislo okolje. Klorovodikova in dušikova se uporabljata manj pogosto, ker prvi je sposoben oksidacije, drugi pa je sam močan oksidant in lahko povzroči stranske procese. Za ustvarjanje alkalnega okolja se uporablja kalijev ali natrijev hidroksid, za ustvarjanje nevtralnega okolja pa voda.
Laboratorijske izkušnje: (pravila TB)
V štiri oštevilčene epruvete vlijemo 1-2 ml razredčene raztopine kalijevega permanganata. V prvo epruveto dodajte nekaj kapljic raztopine žveplove kisline, v drugo vodo, v tretjo kalijev hidroksid, četrto epruveto pa pustite kot kontrolo. Nato nalijte raztopino natrijevega sulfita v prve tri epruvete in jih rahlo stresajte. Upoštevajte, kako se spreminja barva raztopine v vsaki epruveti.
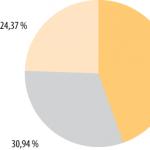
Rezultati laboratorijskega poskusa:
Izdelki za zmanjšanje KMnO 4 (MnO 4 -):
v kislem okolju - Mn +2 (sol), brezbarvna raztopina;
v nevtralnem okolju - MnO 2, rjava oborina;
v alkalnem mediju - MnO 4 2-, zelena raztopina.
telovadba . Reakcijski diagrami:
KMnO 4 + Na 2 SO 3 + H 2 SO 4 → MnSO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 O
KMnO 4 + Na 2 SO 3 + H 2 O → MnO 2 ↓ + Na 2 SO 4 + KOH
KMnO 4 + Na 2 SO 3 + KOH → K 2 MnO 4 + Na 2 SO 4 + H 2 O
Naloga je večnivojska: močnejši učenci sami zapišejo reakcijske produkte:
KMnO 4 + Na 2 SO 3 + H 2 SO 4 →
KMnO 4 + Na 2 SO 3 + H 2 O →
KMnO 4 + Na 2 SO 3 + KOH →
Koeficiente izberite z metodo elektronske tehtnice z uporabo algoritma (Priloga 1). Določite oksidant in reducent.
odgovor:
2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 → 2MnSO 4 + 5Na 2 SO 4 + K 2 SO 4 + 3H 2 O
2KMnO 4 + 3Na 2 SO 3 + H 2 O → 2MnO 2 ↓ + 3Na 2 SO 4 + 2KOH
2KMnO 4 + Na 2 SO 3 + 2KOH → 2K 2 MnO 4 + Na 2 SO 4 + H 2 O
Opravili ste laboratorijski poskus, predlagajte snov, s katero lahko očistite obleko.
Naslednji diagrami prikazujejo produkte reakcije. Določite reagente, zapišite reakcijske enačbe z uporabo metode elektronskega ravnotežja:
(učenci delajo v parih)
a) KI + KMnO 4 +. . . ->MnSO 4 + I 2 + K 2 SO 4 + H2O
Odgovor: ker kot rezultat reakcije dobimo Mn +2, zato proces poteka v kislem okolju s sodelovanjem žveplove kisline in nastane kalijev sulfat.
10KI + 2 KMnO 4 + 8H 2 SO 4 = 2MnSO 4 + 5I 2 + 6K 2 SO 4 +8H 2 O
2I -1 -2e -> I 2 0 5 - oksidacija, reducent
Mn +7 + 5e -> Mn +2 2- redukcija, oksidant
b ) NaI + KMnO 4 + . . . -> I 2 + K 2 MnO 4 + NaOH
Odgovor: ker kot rezultat reakcije dobimo K 2 MnO 4, zato proces poteka v alkalnem okolju s sodelovanjem kalijevega hidroksida
2NaI + 2 KMnO 4 + 2KOH = I 2 + 2K 2 MnO 4 + 2NaOH
2I -1 -2e -> I 2 0 1- oksidacija, redukcijsko sredstvo
Mn +7 + 1e -> Mn +6 2- redukcija, oksidant
V ) . . . + KMnO 4 + H 2 O -> NaNO 3 + MnO 2 + KOH
Odgovor: v tej reakciji je oksidant KMnO4 znan, lahko domnevamo, da se natrijev nitrit, kjer je N +3, reducira v nitrat:
3 NaNO 2 + 2 KMnO 4 + H 2 O = 3NaNO 3 + 2MnO 2 + 2KOH,
N +3 – 2e -> N +5 3 - oksidacija, redukcijsko sredstvo
Mn +7 + 3e -> Mn +4 2 - redukcija, oksidant
Poleg kalijevega permanganata imajo tudi druge snovi oksidativne lastnosti. Z njimi se lahko seznanite v prilogi 2.
1) H2SO4 (razredčeno), oksidant H +1
Produkt redukcije s kovino v napetostnem nizu do vodika je H2.
na primer
H 2 SO 4 (razredčen) + Zn -> ZnSO 4 + H 2,
H 2 SO 4 (razredčen) + Cu ne reagira.
2) H 2 SO 4 (koncentriran), oksidant S +6
Odvisno od aktivnosti kovine se produkti redukcije koncentriranega H 2 SO 4 različni: H 2 S; S; SO 2 . Od koncentracije je odvisen tudi redukcijski produkt kisline (tabela 18, stran 250 učbenika).
3) HNO 3, oksidant n +5 (Tabela 18 str. 250 učbenika).
Koncentrirana HNO 3 pasivira kovine, kot so Fe, Cr, Al, kar je povezano s tvorbo tankega, a zelo gostega oksidnega filma na površini teh kovin.
Au in Pt ne reagirata s HNO 3, vendar se te kovine raztopijo v "aqua regia" - mešanici koncentrirane klorovodikove in dušikove kisline v razmerju 3: 1.
Na primer:
Au + 3HCl (konc.) + HNO 3 (konc.) = AuCl 3 + NO + 2H 2 O.
4) K 2 C r 2 O 7 se v kislem okolju reducira v Cr 3+
v nevtralnem okolju do Cr 2 O 3
v alkalnem okolju do CrO 4 2-
Redoks reakcije v organski kemiji vključujejo tvorbo kisikovih vezi ali eliminacijo vodika.
Pravilo za nastanek vezi: - OH → -1е
O → -2е
abstrakcija 1 atoma H → -1е
jaz V. Utrjevanje preučenega gradiva.
Za utrjevanje obravnavane snovi ponujam testne naloge.
Možnost 1
1. Katera nekovina je močan oksidant?
1) fluor 2) žveplo 3) ozon 4) silicij
2. Stopnja oksidacije žvepla v kalijevem sulfatu je enaka
1)+6 2)+4 3)0 4)-2
3. V kateri od naslednjih reakcij atom klora deluje kot reducent?
1) Cu + Cl 2 = CuCl 2
2) HCl + NaOH = NaCl + H 2 O
3) HCl + MnO 2 = MnCl 2 + Cl 2 + H 2 O
4) Cl 2 + H 2 = HCl
5) +2 → 0
6) 0 → - 1
5. Z metodo elektronske tehtnice sestavite reakcijsko enačbo:
PbS + H 2 O 2 → PbSO 4 + H 2 O
6. Z uporabo metode elektronskega ravnotežja sestavite reakcijsko enačbo:
KBr + KMnO 4 + H 2 SO 4 → …….. + Br 2 + K 2 SO 4 + H 2 O
Določite oksidant in redukcijsko sredstvo.
Odgovor: 1-1; 2-1; 3-3; 4-A3, B4, B2, G5.
Možnost 2
1. V kateri od naslednjih spojin je žveplov atom v oksidacijskem stanju +6
1) FeSO 3 2) S 3) SO 2 4) K 2 SO 4
2. Kateri element se reducira v reakciji Fe 2 O 3 + CO = Fe + CO 2
1) železo 2) kisik 3) ogljik
3. Izberite reakcijsko enačbo, v kateri je element ogljik oksidant.
1)2 C + O 2 = 2CO
2) CO 2 + 2Mg = 2MgO + C
3) CH 4 + 2O 2 = CO 2 + 2H 2 O
4) C + 2H 2 SO 4 = CO 2 + 2H 2 O + 2SO 2
4. Vzpostavite ujemanje med reakcijsko enačbo in spremembo oksidacijskega stanja oksidanta v tej reakciji:
Reakcijska enačba Sprememba oksidacijskega stanja oksidanta
A) S O 2 + N O 2 = S O 3 +NO 1) -1 → 0
B) 2NH 3 + 2Na = 2NaNH 2 + H 2 2) 0 → -2
B) 4N O 2 + O 2 + 2H 2 O = 4HN O 3 3) +4 → +2
D) 4NH 3 + 6NO = 5N 2 + 6H 2 O 4) +1 → 0
5) +2 → 0
6) 0 → - 1
5. Z metodo elektronske tehtnice sestavite enačbo reakcije:
NaNO 2 + NH 4 Cl → NaCl + 2H 2 O + N 2
Določite oksidant in redukcijsko sredstvo.
6. Z metodo elektronske tehtnice sestavite reakcijsko enačbo:
KI+H 2 SO 4 + NaNO 2 → …… + K 2 SO 4 +Na 2 SO 4 + NE + H 2 O
Določite oksidant in redukcijsko sredstvo.
Odgovor: 1-4; 2-1; 3-2; 4-A3, B4, B2, G5.
V. Domača naloga.
1. Dopolnite reakcijske enačbe in uredite koeficiente z metodo elektronske tehtnice:
1. K 2 Cr 2 O 7 + KNO 2 + …….→ KNO 3 + Cr 2 (SO 4 ) 3 + …..+H 2 O
2. C 6 H 5 -CH 3 + KMnO 4 + H 2 SO 4 → C 6 H 5 COOH +….+….+…..
3. C 2 H 5 OH + K 2 Cr 2 O 7 + H 2 SO 4 → CH 3 COOH +….+….+…..
4.Na 2 SO 3 + K 2 Cr 2 O 7 + H 2 SO 4 → ….+….+….+…..
2. Sestavite enačbo za oksidacijo formaldehida z raztopino kalijevega permanganata, nakisanega z žveplovo kislino, ob upoštevanju, da se formaldehid oksidira v CO 2, izberite koeficiente z metodo elektronskega ravnovesja. 2
povezave je običajno enako - 2, razen H 2 O 2 -1 in OF 2.
4. Oksidacijsko stanje vodikovega atoma v
povezave je običajno +1, razen MeH (hidridi).
5.Algebraična vsota oksidacijskih stanj
elementov v povezavah je 0.
Razmislite o diagramih reakcijskih enačb spodaj. Kakšna je njihova bistvena razlika? Ali so se oksidacijska stanja elementov pri teh reakcijah spremenila?
V prvi enačbi se oksidacijska stanja elementov niso spremenila, v drugi pa so se spremenila – za baker in železo.
Druga reakcija je redoks reakcija.
Reakcije, ki povzročijo spremembe v oksidacijskih stopnjah elementov, ki sestavljajo reaktante in reakcijske produkte, imenujemo oksidacijsko-redukcijske reakcije (ORR).
SESTAVLJANJE ENAČB ZA REDOKS REAKCIJE.
Obstajata dve metodi za sestavljanje redoks reakcij - metoda elektronskega ravnovesja in metoda polovične reakcije. Tukaj si bomo ogledali metodo elektronske bilance.
Pri tej metodi primerjamo oksidacijska stanja atomov v izhodnih snoveh in v reakcijskih produktih, pri čemer se ravnamo po pravilu: število elektronov, ki jih odda redukcijsko sredstvo, mora biti enako številu elektronov, ki jih pridobi oksidacijsko sredstvo.
Če želite ustvariti enačbo, morate poznati formule reaktantov in reakcijskih produktov. Oglejmo si to metodo na primeru.
|
Razporedite koeficiente v reakciji, katere shema je: HCl + MnO 2 = Cl 2 + MnCl 2 + H 2 O |
|
Algoritem za nastavitev koeficientov |
|
1. Navedemo oksidacijska stanja kemičnih elementov. Poudarjeni so kemijski elementi, pri katerih so se spremenila oksidacijska stanja. |
|
2. Sestavimo elektronske enačbe, v katerih navedemo število oddanih in prejetih elektronov. Za navpično črto zapišemo število prenesenih elektronov med procesoma oksidacije in redukcije. Poiščite najmanjši skupni večkratnik (prikazan v rdečem krogu). To število delimo s številom premaknjenih elektronov in dobimo koeficiente (prikazane v modrem krogu). To pomeni, da bo pred manganom koeficient -1, ki ga ne zapišemo, pred Cl 2 pa bo prav tako -1. |
|
Oglejmo si bolj zapleteno enačbo: |
|
H 2 S + KMnO 4 + H 2 SO 4 = S + MnSO 4 + K 2 SO 4 + H 2 O |
|
Urejamo oksidacijska stanja kemičnih elementov: |
|
Elektronske enačbe bodo imele naslednjo obliko Pred žveplo z oksidacijskimi stopnjami -2 in 0 postavimo koeficient 5, pred manganove spojine -2, izenačimo število atomov drugih kemijskih elementov in dobimo končno reakcijsko enačbo |
Osnovni principi teorije redoks reakcij
1. Oksidacija klical proces izgube elektronov s strani atoma, molekule ali iona.
Na primer :
Al – 3e - = Al 3+
Fe 2+ - e - = Fe 3+
H 2 – 2e - = 2H +
2Cl - - 2e - = Cl 2
Med oksidacijo se stopnja oksidacije poveča.
2. Obnovitev klical proces pridobivanja elektronov z atomom, molekulo ali ionom.
Na primer:
S + 2е - = S 2-
Z l 2 + 2е- = 2Сl -
Fe 3+ + e - = Fe 2+
Med redukcijo se stopnja oksidacije zmanjša.
3. Imenujemo atome, molekule ali ione, ki oddajajo elektrone restavratorji . Med reakcijooksidirajo.
Imenujemo atome, molekule ali ione, ki pridobijo elektrone oksidanti . Med reakcijookrevajo.
Ker so atomi, molekule in ioni del določenih snovi, se te snovi ustrezno imenujejo restavratorji ali oksidanti.
4. Redoks reakcije predstavljajo enotnost dveh nasprotujočih si procesov - oksidacije in redukcije.
Število elektronov, ki jih odda reducent, je enako številu elektronov, ki jih pridobi oksidant.
VAJE
Simulator št. 1 Oksidacijsko-redukcijske reakcije
Simulator št. 2 Metoda elektronskega ravnotežja
Simulator št. 3 Test "Oksidacijsko-redukcijske reakcije"
NALOGE NALOGE
št. 1. Določite oksidacijsko stanje atomov kemičnih elementov z uporabo formul njihovih spojin: H 2 S, O 2, NH 3, HNO 3, Fe, K 2 Cr 2 O 7
št. 2. Ugotovite, kaj se zgodi z oksidacijskim stanjem žvepla med naslednjimi prehodi:
A) H 2 S → SO 2 → SO 3
B ) SO 2 → H 2 SO 3 → Na 2 SO 3
Kakšen zaključek je mogoče narediti po zaključku druge genetske verige?
V katere skupine lahko razvrstimo kemijske reakcije glede na spremembo oksidacijskega stanja atomov kemijskih elementov?
št. 3. Z metodo elektronske tehtnice uredite koeficiente v CHR, navedite procese oksidacije (redukcije), oksidanta (reduktivnega sredstva); zapišite reakcije v popolni in ionski obliki:
A) Zn + HCl = H 2 + ZnCl 2
B) Fe + CuSO 4 = FeSO 4 + Cu
št. 4. Podani diagrami reakcijskih enačb:
СuS + HNO 3 (razredčen ) = Cu(NO 3) 2 + S + NO + H 2 O
K + H 2 O = KOH + H 2
Uredite koeficiente v reakcijah z metodo elektronske tehtnice.
Označite snov – oksidant in snov – reducent.