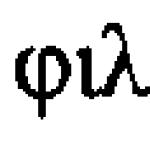Tema lecției este „Reacțiile de oxidare-reducere”.
Obiective:
Educativ: pde a familiariza elevii cu o nouă clasificare a reacțiilor chimice bazată pe modificări ale stărilor de oxidare ale elementelor - reacții de oxidare-reducere (ORR).Formează un concept despre oxidativ - restauratoarereacții, ca reacții chimice bazate pe modificări ale stării de oxidare a elementelor. Dați conceptele de „agent oxidant” și „agent reducător”. Caracterizați unitatea și continuitatea proceselor de oxidare și reducere, învață elevii să aranjeze coeficienții folosind metoda echilibrului electronic.
Educativ: pContinuați să dezvoltați abilitățile de a compune ecuații ale reacțiilor chimice. Contribuie la lărgirea orizontului elevilor, dezvoltând abilități în aplicarea cunoștințelor dobândite pentru a explica fenomenele lumii înconjurătoare.Continuați dezvoltarea gândirii logice, a abilităților de analiză și comparație.Îmbunătățiți abilitățile practice în lucrul cu echipamente de laborator și reactivi chimici; completează cunoștințele elevilor cu privire la regulile de lucru în laboratorul de chimie. Dezvoltați capacitatea de a observa și de a trage concluzii.
Educativ: de la să contribuie la formarea unei culturi a comunicării interpersonale prin exemplul abilității de a se asculta, de a-și pune întrebări, de a analiza răspunsurile camarazilor, de a prezice rezultatul muncii și de a-și evalua munca.Pentru a forma viziunea științifică asupra lumii a studenților și pentru a îmbunătăți abilitățile de lucru.
Tip de lecție: învăţarea de materiale noi.
Obiective didactice:crearea condițiilor pentru conștientizarea și înțelegerea unui bloc de informații educaționale noi.
Formatul lecției: lecție – discuție cu elemente de învățare bazată pe probleme.
Metode de predare:explicativ - ilustrativ, problematic, parțial explorator.
Progresul lecției
Moment organizatoric.
Călătorie în trecut:
Profesor: În secolul al III-lea î.Hr. pe insula Rodos a fost construit un monument sub forma unei statui uriașe a lui Helios (grecii au pe Zeul Soarelui Designul grandios și execuția perfectă a Colosului din Rodos - una dintre minunile lumii -). a uimit pe toți cei care l-au văzut (arătând colosul pe tobogan, nu știm cu siguranță cum arăta statuia, dar se știe că era din bronz și a ajuns la o înălțime de aproximativ 33 m). a fost creat de sculptorul Haret, a fost construit 12 ani. Carcasa de bronz a fost atașată de un cadru de fier. Statuia goală a început să fie construită de jos și, pe măsură ce a crescut, a fost umplută cu pietre pentru a o face mai stabilă, la aproximativ 50 de ani de la finalizarea construcției, Colosul s-a prăbușit. În timpul cutremurului s-a rupt la nivelul genunchiului. Oamenii de știință cred că motivul fragilității acestui miracol a fost coroziunea metalelor, iar procesul de coroziune se bazează pe reacții redox.Notați în caiet subiectul lecției: „Oxidativ- restauratoare reacții.”
Așadar, astăzi în lecție ne vom familiariza cu reacțiile redox și vom afla care este diferența dintre reacțiile metabolice și reacțiile redox. Să învățăm să identificăm agentul oxidant și agentul reducător în reacții. Să învățăm cum să diagramăm procesele de a da și de a primi electroni.
Actualizarea cunoștințelor.
Pentru început, să ne amintim care este numărul de oxidare și cum este determinat numărul de oxidare în substanțe simple și complexe.
Numărul de oxidare este sarcina condiționată a unui atom dintr-un compus. Starea de oxidare coincide cu valența, dar spre deosebire de valență, starea de oxidare este negativă.
Reguli pentru determinarea stărilor de oxidare:
1. Atomii liberi și substanțele simple au o stare de oxidare de 0:
Na, H 2 , N 2 , S, Al, F 2 .
2. Metalele din toți compușii au o stare de oxidare pozitivă (valoarea sa maximă este egală cu numărul grupului):
a) pentru metale din subgrupa principală a grupei I +1;
b) pentru metale din subgrupa principală a grupei II +2;
c) aluminiul are +3.
3. În compuși, oxigenul are o stare de oxidare de -2
(excepţieO +2 F 2 și peroxizi:H 2 O 2 -1 ; K 2 O 2 -1 ).
4. În compușii cu nemetale, hidrogenul are o stare de oxidare de +1, iar cu metalele -1.
5. În compuși, suma stărilor de oxidare ale tuturor atomilor este 0.
H +1 Cl -1 H 2 +1 S -2 H 2 +1 S +6 O 4 -2
1 - 1 = 0 (2 1) - 2 = 0 (1 2) + 6 - (2 4) = 0
Studierea unui subiect nou.
În clasa a VIII-a ai fost introdus în reacțiile de combinare, descompunere, substituție și schimb.Această clasificare a reacțiilor chimice se bazează pe numărul și compoziția substanțelor inițiale și rezultate. Să luăm în considerare reacțiile chimice din punctul de vedere al oxidării (donarea de electroni) și al reducerii (câștigarea de electroni) a atomilor elementelor. Deasupra semnelor elementelor chimice vom indica stările lor de oxidare.

S-au schimbat stările de oxidare ale elementelor în aceste reacții?
În prima ecuație, stările de oxidare ale elementelor nu s-au schimbat, dar în a doua, s-au schimbat pentru cupru și fier.
A doua reacție este o reacție redox.
Reacțiile care au ca rezultat modificări ale stărilor de oxidare ale elementelor care alcătuiesc reactanții și produșii de reacție se numesc reacții redox ( ).
În reacțiile redox, electronii sunt transferați de la un atom, moleculă sau ion la altul. Procesul de renunțare la electroni se numeșteoxidare .
H 2 0 - 2ē 2H + 2Br - - 2ē Br 2 0 S -2 - 2ēS 0
Procesul de adăugare a electronilor se numeșterecuperare :
Mn +4 + 2ē Mn +2 S 0 + 2ē S -2 Cr +6 +3ē Cr +3
Atomii sau ionii care câștigă electroni într-o reacție dată suntagenţi oxidanţi , și care donează electroni -restauratori .
Întocmirea ecuațiilor reacțiilor redox.
Există două metode de compunere a reacțiilor redox - metoda echilibrului electronic și metoda semireacției. Aici ne vom uita la.
În această metodă, se compară stările de oxidare ale atomilor din substanțele inițiale și din produsele de reacție și ne ghidăm după regula: numărul de electroni donați de agentul reducător trebuie să fie egal cu numărul de electroni adăugați de oxidant. agent.
Pentru a crea o ecuație, trebuie să cunoașteți formulele reactanților și produșilor de reacție. Să ne uităm la această metodă cu un exemplu.
Algoritm pentru compilarea ecuațiilor OVR folosind metoda echilibrului electronic:
Întocmește o diagramă a reacției.
Al + HCI → AlCl 3 + H 2
Determinați stările de oxidare ale elementelor din reactanți și produși de reacție.
Al 0 +H +1 Cl -1 → Al +3 Cl 3 -1 +H 2 0
Determinați dacă reacția este redox sau dacă are loc fără modificarea stărilor de oxidare ale elementelor.
Această reacție este OVR
Subliniați elementele, stările lor de oxidare, care se schimbă.
Al 0 + H +1 Cl -1 → Al +3 Cl 3 -1 + H 2 0
Determinați ce element este oxidat (starea de oxidare crește) și care element este redus (starea de oxidare scade) în timpul reacției.
Al 0 → Al +3 oxidează
H +1 → H 2 0 este în curs de restaurare
În partea stângă a diagramei, utilizați săgețile pentru a indica procesul de oxidare (deplasarea electronilor de la un atom element) și procesul de reducere (deplasarea electronilor la un atom element)
Al 0 – 3 ē →Al +3 proces de oxidare
2 H +1 + 2 ē →H 2 0 procesul de recuperare
Definiți un agent reducător și un agent oxidant.
Al 0 – 3 ē →Al +3 agent reducător
2 H +1 + 2 ē →H 2 0 oxidant
Echilibrează numărul de electroni dintre agentul de oxidare și agentul de reducere.
Al 0 – 3 → Al +3
2H +1 + 2 ē → H 2 0
Determinați coeficienții agentului oxidant și reductorului, produșilor de oxidare și reducere.
Al 0 – 3 → Al +3
x 2
2H +1 + 2 ē → H 2 0
x 3
Plasați coeficienții în fața formulelor agentului de oxidare și agentului reducător.
2 Al+ 6 HCI → 2 AlCl 3 + 3 H 2
Verificați ecuația reacției.
Să numărăm numărul de atomi din dreapta și din stânga dacă sunt numere egale, am egalat ecuația.
Consolidare.
№1. Determinați gradul de oxidare al atomilor elementelor chimice folosind formulele compușilor acestora:H 2 S, O 2 , N.H. 3 , HNO 3 , Fe, K 2 Cr 2 O 7
№2. Determinați ce se întâmplă cu starea de oxidare a sulfului în timpul următoarelor tranziții:H 2 S → AŞA 2 → AŞA 3
№3. Aranjați coeficienții în CHR folosind metoda balanței electronice, indicați procesele de oxidare (reducere), agent oxidant (agent reducător); notează reacțiile în formă completă și ionică:
A) Zn + HCI = H 2 + ZnCl 2
B) Fe + CuSO 4 = FeSO 4 + Cu
№4.
Dansschemeecuațiireactii:
CUSUA + HNO 3
(
diluat) = Cu(NR 3
)
2
+ S + NU + H 2
O
K+H 2
O = KOH + H 2
Aranjați coeficienții în reacții folosind metoda echilibrului electronic.
Indicați substanța - un agent oxidant și o substanță - un agent reducător.
Tema pentru acasă: p. 1, exercițiul 1, 6 pagina 7.









 Înapoi Înainte
Înapoi Înainte
Atenţie! Previzualizările diapozitivelor au doar scop informativ și este posibil să nu reprezinte toate caracteristicile prezentării. Dacă sunteți interesat de această lucrare, vă rugăm să descărcați versiunea completă.
Manual: Rudzitis G.E., Feldman F.G. Chimie: manual pentru clasa a IX-a instituţiilor de învăţământ / G.E. Rudzitis, F.G. Feldman. – Ed. a XII-a. – M.: Educație, SA „Manuale de la Moscova”, 2009. – 191 p.
Ţintă: pentru a forma înțelegerea de către elevi a proceselor redox și a mecanismului acestora
Rezultate așteptate
Subiect:
În timpul lucrărilor, elevii
va dobandi
- capacitatea de a analiza și evalua obiectiv situațiile de viață legate de chimie, abilități de manipulare în siguranță a substanțelor folosite în viața de zi cu zi;
- capacitatea de a analiza și planifica un comportament ecologic pentru a păstra sănătatea și mediul înconjurător
capacitatea de a stabili conexiuni între fenomenele și procesele chimice observate efectiv, explica motivele diversității substanțelor, dependența proprietăților substanțelor de structura lor;
stapaneste abordarea stiintifica a intocmirii ecuatiei reactiilor redox
Metasubiect În timpul lucrărilor, elevii
- definește concepte, creează generalizări, stabilește analogii, clasifică, selectează în mod independent bazele și criteriile de clasificare, stabilește relații cauză-efect, construiește raționament logic, inferență (inductivă, deductivă și prin analogie) și trage concluzii;
- să creeze, să aplice și să transforme semne și simboluri, modele și diagrame pentru a rezolva probleme educaționale și cognitive;
- să aplice gândirea ecologică în practica cognitivă, comunicativă, socială și orientare profesională
Personal
Metasubiect va dobandi
- fundamentele culturii ecologice corespunzătoare nivelului modern de gândire ecologică, experiența activităților reflexiv-evaluative și practice orientate spre mediu în situații de viață;
2.1. Reacție chimică. Condiții și semne ale reacțiilor chimice. Ecuații chimice.
2.2. Clasificarea reacțiilor chimice în funcție de modificările stărilor de oxidare ale elementelor chimice
2.6. Reacții redox. Agent oxidant și agent reducător.
Abilități și activități testate de KIM GIA
Cunoaște/înțelegi
- simboluri chimice: formule ale substanțelor chimice, ecuații ale reacțiilor chimice
- cele mai importante concepte chimice: stare de oxidare, agent oxidant și agent reducător, oxidare și reducere, principalele tipuri de reacții din chimia anorganică
1.2.1. trăsături caracteristice ale celor mai importante concepte chimice
1.2.2. despre existenţa unor relaţii între cele mai importante concepte chimice
Compune
2.5.3. ecuații ale reacțiilor chimice.
Forma de predare: lecție de utilizare a TIC, inclusiv forme pereche, individuale de organizare a activităților educaționale și cognitive ale elevilor.
Durata sesiunii de antrenament: 45 de minute.
Utilizarea tehnologiilor educaționale: metoda de predare euristică, învățarea colaborativă
Progresul lecției
I. Problematizare, actualizare, motivare – 10 min.
Conversație frontală
- Ce sunt atomii și ionii.
- Cum sunt ele diferite?
- Ce sunt electronii?
- Ce este starea de oxidare?
- Cum se calculează numărul de oxidare?
Pe tablă, elevii sunt rugați să plaseze stările de oxidare în următoarele substanțe:
Cl 2 O 7, SO 3, H 3 PO 4, P 2 O 5, Na 2 CO 3, CuSO 4, Cl 2, HClO 4, K 2 Cr 2 O 7, Cr 2 (SO 4) 3, Al(NO) 3) 3, CaSO 4,
NaMnO4, MnCl2, HNO3, N2, N2O, HNO2, H2S, Ca3 (PO4)2
II. Învățarea de materiale noi. Explicația profesorului. 15 min.
Concepte de bază (diapozitivul 2):
Reacții redox- sunt reacții în care se modifică stările de oxidare a două elemente, dintre care unul este agent reducător, iar celălalt este agent de oxidare
Agent reducător- acesta este elementul care renunță la electroni în timpul reacției și este el însuși oxidat
Oxidant- acesta este elementul care acceptă electroni în timpul reacției și este el însuși redus
Reguli pentru alcătuirea ecuațiilor redox(diapozitivul 3)
1. Notați ecuația reacției (diapozitivul 4).
CuS+HNO3 ->Cu(NO3)2 + S + NO+H2O
2. Să aranjam stările de oxidare ale tuturor elementelor
Cu +2 S -2 +H +1 N +5 O -2 3 -> Cu +2 (N +5 O -2 3) -1 2 + S 0 + N +2 O -2 +H +1 2 O -2
3. Să evidențiem elementele care și-au schimbat stările de oxidare
Cu +2 S -2 +H +1 N +5 O -2 3 -> Cu +2 (N +5 O -2 3) -1 2 + S 0 + N +2 O -2 +H +1 2 O -2
Vedem că, ca rezultat al reacției, stările de oxidare a două elemente s-au schimbat -
- sulf (S) schimbat complet (de la – 2 la 0 )
- azot (N) schimbat parțial (de la +5 la +2 schimbat), unele au rămas +5
4. Să notăm acele elemente care și-au schimbat stările de oxidare și să arătăm tranziția electronilor (diapozitivul 5.)
CuS -2 +HN +5 O 3 -> Cu(N +5 O 3) 2 + S 0 + N +2 O+H 2 O
S -2 - 2e S 0
5. Să alcătuim o balanță electronică și să găsim coeficienții
6. Să substituim coeficienții aflați în balanță în ecuație (coeficienții sunt stabiliți pentru substanțele ale căror elemente și-au schimbat starea de oxidare) (diapozitivul 6).
CuS -2 +HN +5 O 3 -> Cu(N + 5 O 3) 2 + 3 S0+ 2 N+2O+H2O
7. Să livrăm coeficienții lipsă folosind metoda de egalizare
3CuS -2 +8HN +5 O 3 -> 3Cu(N +5 O 3) 2 + 3S 0 + 2N +2 O+4H 2 O
8. Folosind oxigen, să verificăm corectitudinea ecuației (diapozitivul 7).
Before the reaction of oxygen 24 atoms = After the reaction of oxygen 24 atoms
9. Identificați agentul oxidant și agentul reducător și procesele - oxidare și reducere
S -2 (în CuS) este un agent reducător deoarece
donează electroni N +5
(în HNO 3) este un agent oxidant, deoarece donează electroni
III. Întărirea materialului învățat (25 min)
Elevii sunt rugați să finalizeze sarcina în perechi.
Sarcina 1. 10 min. (diapozitivul 8)
Elevii sunt rugați să creeze o ecuație de reacție în conformitate cu algoritmul.
Mg+H2S04 -> MgS04 + H2S + H2O
Verificarea jobului
| 4Mg 0 +5H 2 +1 S +6 O 4 -2 -> 4Mg +2 S +6 O 4 -2 + H 2 +1 S -2 + 4H 2 +1 O -2 – | Tranziție e | Numărul de electroni | NOC |
| 2 | 4 | ||
| 1 |
Cote
Sarcina 2. 15 min. (diapozitivele 9, 10) Elevii sunt rugați să completeze test
(în perechi). Elementele de testare sunt verificate și sortate pe tablă.
Întrebarea nr. 1
- Care ecuație corespunde unei reacții redox?
- CaCO3 = CaO + CO2
- Zn + H2S04 = ZnS04 + H2
- Na2CO3 + CO2 + H2O = 2NaHCO3
Întrebarea nr. 2
În ecuația de reacție 2Al + 3Br 2 = 2AlBr 3 coeficientul din fața formulei agentului reducător este egal cu
Întrebarea nr. 3
În ecuația reacției 5Ca + 12HNO 3 = 5Ca(NO 3) 2 + N 2 + 6H 2 O agentul de oxidare este
- Ca(NO3)2
- HNO3
- H2O
Întrebarea nr. 4
Care dintre schemele propuse va corespunde agentului reducător?
- S0 > S-2
- S +4 -> S +6
- S -2 > S -2
- S +6 -> S +4
Întrebarea nr. 5
În ecuaţia reacţiei 2SO 2 + O 2 -> 2 SO3 sulf
- oxidează
- este în curs de restaurare
- nici oxidat, nici redus
- atât oxidează, cât și reduce
Întrebarea nr. 6
Care element este agentul reducător în ecuația reacției
2KClO 3 -> 2KCl + 3O 2
- potasiu
- oxigen
- hidrogen
Întrebarea nr. 7
Schema Br -1 -> Br +5 corespunde elementului
- agent oxidant
- restaurator
- atât un agent oxidant, cât și un agent reducător
Întrebarea nr. 8
Acidul clorhidric este agentul reducător în reacție
- PbO2 + 4HCl = PbCl2 + CI2 + 2H2O
- Zn + 2HCI = ZnCI2 + H2
- PbO + 2HCI = PbCl2 + H2O
- Na2CO3 + 2HCI = 2NaCl+ CO2 + H2O
Răspunsuri la întrebările testului.
numărul întrebării 1 2 3 4 5 6 7 8 răspuns 3 1 3 2 1 3 2 1
Teme pentru acasă: paragraful 5 ex. 6,7,8 p. 22 (manual).
Lecția examinează esența reacțiilor redox și diferența lor față de reacțiile de schimb ionic. Sunt explicate modificările stărilor de oxidare ale agentului de oxidare și ale agentului reducător. Se introduce conceptul de echilibru electronic.
Subiect: Reacții redox
Lecția: Reacții Redox
Luați în considerare reacția magneziului cu oxigenul. Să notăm ecuația acestei reacții și să aranjam valorile stărilor de oxidare ale atomilor elementelor:
După cum se poate observa, atomii de magneziu și oxigen din materiile prime și produșii de reacție au stări de oxidare diferite. Să scriem diagrame ale proceselor de oxidare și reducere care au loc cu atomii de magneziu și oxigen.
Înainte de reacție, atomii de magneziu au avut o stare de oxidare zero, după reacție - +2. Astfel, atomul de magneziu a pierdut 2 electroni:
Magneziul donează electroni și este el însuși oxidat, ceea ce înseamnă că este un agent reducător.
Înainte de reacție, starea de oxidare a oxigenului era zero, iar după reacție a devenit -2. Astfel, atomul de oxigen și-a adăugat 2 electroni:
Oxigenul acceptă electroni și este el însuși redus, ceea ce înseamnă că este un agent oxidant.
Să scriem schema generală de oxidare și reducere:
Numărul de electroni dat este egal cu numărul de electroni primiți. Echilibrul electronic este menținut.
ÎN reacții redox au loc procese de oxidare și reducere, ceea ce înseamnă că stările de oxidare ale elementelor chimice se modifică. Acesta este un semn distinctiv reacții redox.
Reacțiile redox sunt reacții în care elementele chimice își schimbă starea de oxidare
Să ne uităm la exemple specifice despre cum să distingem o reacție redox de alte reacții.
1. NaOH + HCl = NaCI + H2O
Pentru a spune dacă o reacție este redox, este necesar să se atribuie valorile stărilor de oxidare ale atomilor elementelor chimice.
1-2+1 +1-1 +1 -1 +1 -2
1. NaOH + HCl = NaCI + H2O
Vă rugăm să rețineți că stările de oxidare ale tuturor elementelor chimice din stânga și dreapta semnului egal rămân neschimbate. Aceasta înseamnă că această reacție nu este redox.
4 +1 0 +4 -2 +1 -2
2. CH4 + 2O2 = CO2 + 2H2O
Ca rezultat al acestei reacții, stările de oxidare ale carbonului și oxigenului s-au schimbat. Mai mult, carbonul și-a crescut starea de oxidare, iar oxigenul a scăzut. Să notăm schemele de oxidare și reducere:
C -8e = C - proces de oxidare
О +2е = О - procesul de recuperare
Astfel încât numărul de electroni dat să fie egal cu numărul de electroni primiți, adică. respectat balanță electronică, este necesar să se înmulțească a doua jumătate de reacție cu un factor de 4:
C -8e = C - agent reducător, se oxidează
O +2е = O 4 agent oxidant, redus
În timpul reacției, agentul de oxidare acceptă electroni, scăzându-și starea de oxidare și este redus.
Agentul reducător renunță la electroni în timpul reacției, crescându-i starea de oxidare, se oxidează.
1. Mikityuk A.D. Culegere de probleme și exerciții de chimie. 8-11 clase / A.D. Mikityuk. - M.: Editura. „Examen”, 2009. (p.67)
2. Orjekovski P.A. Chimie: clasa a IX-a: manual. pentru învăţământul general stabilire / P.A. Orjekovski, L.M. Meshcheryakova, L.S. Pontak. - M.: AST: Astrel, 2007. (§22)
3. Rudzitis G.E. Chimie: anorganică. chimie. Organ. chimie: manual. pentru clasa a IX-a. / G.E. Rudzitis, F.G. Feldman. - M.: Educație, OJSC „Manuale de la Moscova”, 2009. (§5)
4. Hhomcenko I.D. Culegere de probleme și exerciții de chimie pentru liceu. - M.: RIA „New Wave”: Editura Umerenkov, 2008. (p.54-55)
5. Enciclopedie pentru copii. Volumul 17. Chimie / Capitolul. ed. V.A. Volodin, Ved. ştiinţific ed. I. Leenson. - M.: Avanta+, 2003. (p. 70-77)
Resurse web suplimentare
1. O colecție unificată de resurse educaționale digitale (experiențe video pe această temă) ().
2. O colecție unificată de resurse educaționale digitale (sarcini interactive pe această temă) ().
3. Versiunea electronică a revistei „Chimie și viață” ().
Teme pentru acasă
1. Nr 10.40 - 10.42 din „Culegere de probleme şi exerciţii de chimie pentru liceu” de I.G. Khomchenko, ed. a 2-a, 2008
2. Participarea la reacția substanțelor simple este un semn sigur al unei reacții redox. Explicați de ce. Scrieți ecuațiile pentru reacțiile compusului, substituție și descompunere care implică oxigen O 2 .
Lecția din clasa a IX-a pe tema:
„REACȚII DE OXIDARE-REDUCERE (ORR)”
TDC
Educarea: creați condiții pentru promovarea activității și a independenței atunci când studiați acest subiect, precum și capacitatea de a lucra în grup și capacitatea de a vă asculta colegii de clasă.
Dezvoltare: continuă să-și dezvolte gândirea logică, abilitățile de a observa, analiza și compara, de a găsi relații cauză-efect, de a trage concluzii, de a lucra cu algoritmi și de a dezvolta interesul pentru subiect.
Educațional:
- consolidarea conceptelor de „stare de oxidare”, procese de „oxidare”, „reducere”;
- consolidarea abilităților de întocmire a ecuațiilor reacțiilor redox folosind metoda balanței electronice;
- învață să prezică produsele reacțiilor redox.
PROGRESUL LECȚIEI:
- Moment organizatoric.
- Actualizarea cunoștințelor.
- Ce reguli pentru determinarea gradului de atomi ale elementelor chimice cunoașteți? (diapozitivul 1)
- Finalizați sarcina (diapozitivul 2)
- Finalizați autotestul (diapozitivul 3)
- Învățarea de materiale noi.
- Finalizați sarcina (diapozitivul 4)
Determinați ce se întâmplă cu starea de oxidare a sulfului în timpul următoarelor tranziții:
A) H 2 S → SO 2 → SO 3
B) SO2 → H2SO3 → Na2SO3
Ce concluzie se poate trage după finalizarea celui de-al doilea lanț genetic?
În ce grupe pot fi clasificate reacțiile chimice pe baza modificărilor stării de oxidare a atomilor elementelor chimice?
- Să verificăm (diapozitivul 5).
- Conchidem: Pe baza schimbării stării de oxidare a atomilor elementelor chimice care participă la o reacție chimică, se disting reacțiile - cu o modificare a CO și fără o modificare a CO.
- Deci, să definim subiectul lecțieiREACȚII REDOX (ORR).
- Scriem definiția
OVR – reacții care apar cu modificarea stării de oxidare a atomilor,
Conțin reactanți
- Să încercăm să ne dăm seama - care este particularitatea proceselor de oxidare și reducere a elementelor în timpul formării unei legături ionice, folosind exemplul unei molecule de fluorură de sodiu?
Privește cu atenție diagramă și răspunde la întrebări:
- Ce se poate spune despre completitudinea nivelului extern al atomilor de fluor și sodiu?
- Care atom este mai ușor de acceptat și care este mai ușor să renunți la electroni de valență pentru a completa nivelul exterior?
- Cum puteți formula definiția oxidării și reducerii?
Este mai ușor pentru un atom de sodiu să renunțe la un electron înainte de a-și finaliza nivelul exterior (decât să accepte 7 ē la opt, adică până la finalizare), prin urmare, își donează electronul de valență atomului de fluor și îl ajută să-și completeze nivelul exterior, în timp ce este un agent reducător, oxidează și crește CO2. Este mai ușor pentru atomul de fluor, ca element mai electronegativ, să accepte 1 electron pentru a-și completa nivelul exterior, ia un electron din sodiu, în timp ce este redus, scăzând CO și fiind un agent oxidant;
„Oxidizer ca un răufăcător notoriu
Ca un pirat, bandit, agresor, Barmaley
Ia electroni - și OK!
După ce a suferit daune, restaurator
Exclamă: „Iată-mă, ajutor!
Dă-mi electronii înapoi!”
Dar nimeni nu ajută și nu dăunează
Nu rambursează..."
- Scrierea definițiilor
Procesul de renunțare la electroni de către un atom se numește oxidare.
Un atom care donează electroni și își mărește starea de oxidare este oxidat și se numeșteagent reducător.
Procesul prin care un atom acceptă electroni se numeșterestaurare.
Un atom care acceptă electroni și își scade starea de oxidare este redus și se numește agent oxidant.
- GAMA DE COEFICIENȚI ÎN OVR UTILIZAREA METODEI DE EQUILIBRARE ELECTRONICĂ
Multe reacții chimice pot fi egalizate prin simpla selectare a coeficienților.
Dar uneori apar complicații în ecuațiile reacțiilor redox. Pentru setarea coeficienților se folosește metoda echilibrului electronic.
Îți sugerez să te uițiANIMAŢIE
Studiați algoritmul de compilare a ecuațiilor OVR folosind metoda echilibrului electronic (Anexa 1).
- Consolidare
Aranjați coeficienții în UHR
Al203 +H2=H2 O+Al prin metoda echilibrului electronic, indicați procesele de oxidare (reducere), agent oxidant (agent reducător), efectuați un autotest.
- Reflecţie
Răspundeți la întrebările din tabelul „Întrebări pentru elev” (Anexa 2).
- Rezumând lecția. DZ
- Notare comentată.
- Tema pentru acasă: finalizați autotestul (Anexa 3)
Previzualizare:
Pentru a utiliza previzualizările prezentării, creați un cont Google și conectați-vă la el: https://accounts.google.com
Subtitrările diapozitivelor:
Reacții de oxidare-reducere (ORR)
Reguli pentru calcularea stării de oxidare (CO) a elementelor:
Determinați stările de oxidare ale atomilor elementelor chimice folosind formulele compușilor acestora: H 2 S, O 2, NH 3, HNO 3, Fe, K 2 Cr 2 O 7 Finalizați sarcina
1 -2 0 -3 +1 +1 +5 -2 H 2 S O 2 NH 3 HNO 3 0 +1 +7 -2 Fe K 2 Cr 2 O 7 Efectuați autotestul
Determinați ce se întâmplă cu starea de oxidare a sulfului în timpul următoarelor tranziții: A) H 2 S → SO 2 → SO 3 B) SO 2 → H 2 SO 3 → Na 2 SO 3 Ce concluzie se poate trage după finalizarea celui de-al doilea lanț genetic ? În ce grupe pot fi clasificate reacțiile chimice pe baza modificărilor stării de oxidare a atomilor elementelor chimice? Finalizați sarcina
A) H 2 S -2 → S +4 O 2 → S +6 O 3 B) S +4 O 2 → H 2 S +4 O 3 → Na 2 S +4 O 3 În primul lanț de transformări, sulful își crește CO de la (-2) la (+6). În al doilea lanț, starea de oxidare a sulfului nu se modifică. Control
Reacțiile de oxidare-reducere (ORR) sunt reacții care apar cu o schimbare a stării de oxidare a atomilor care formează reactanții. Să notăm definiția
Formarea unei legături ionice, folosind exemplul unei molecule de fluorură de sodiu
Ce se poate spune despre completitudinea nivelului extern al atomilor de fluor și sodiu? Care atom este mai ușor de acceptat și care este mai ușor să renunți la electroni de valență pentru a completa nivelul exterior? Cum puteți formula definiția oxidării și reducerii? Răspunde la întrebările
Oxidarea este procesul de cedare a electronilor de către un atom. Un agent de oxidare este un atom care acceptă electroni și își scade starea de oxidare în timpul reacției și este redus. Un agent reducător este un atom care donează electroni și își mărește starea de oxidare este oxidat în timpul reacției. Reducerea este procesul prin care un atom acceptă electroni. Să scriem definițiile
1. Urmăriți animația. 2. Studiați algoritmul de compilare a ecuațiilor OVR folosind metoda echilibrului electronic (în folder). GAMA DE COEFICIENȚI ÎN OVR UTILIZAREA METODEI DE EQUILIBRARE ELECTRONICĂ
Aranjați coeficienții în UHR Al 2 O 3 + H 2 = H 2 O + Al folosind metoda balanței electronice, indicați procesele de oxidare (reducere), agent oxidant (agent reducător), efectuați un autotest. Consolidare
Răspundeți la întrebările din tabelul „Întrebări pentru elev”. Reflecţie
Previzualizare:
Anexa 2
Întrebări pentru student
Data_________________Clasa______________________
Încercați să vă amintiți exact ce ați auzit în clasă și răspundeți la întrebările adresate:
Nu. | Întrebări | Răspunsuri |
Care a fost subiectul lecției? | ||
Care a fost scopul tău în timpul lecției? | ||
Cum au lucrat colegii tăi la clasă? | ||
Cum ai lucrat la clasă? | ||
Azi am aflat... | ||
am fost surprins... | ||
Acum pot... | ||
as vrea... |
Previzualizare:
Anexa 3
Test pe tema „REACȚII REDOX”
Partea „A” - alegeți o opțiune de răspuns dintre cele sugerate
1. Reacțiile redox se numesc
A) Reacţii care apar cu modificarea stării de oxidare a atomilor care alcătuiesc substanţele care reacţionează;
B) Reacţii care au loc fără modificarea stării de oxidare a atomilor care alcătuiesc substanţele care reacţionează;
B) Reacții între substanțe complexe care își schimbă constituenții
2. Un agent oxidant este...
A) Un atom care donează electroni și își scade starea de oxidare;
B) Un atom care acceptă electroni și își scade starea de oxidare;
B) Un atom care acceptă electroni și își mărește starea de oxidare;
D) Un atom care donează electroni și își mărește starea de oxidare
3. Procesul de recuperare este un proces...
A) Recul electronilor;
B) Acceptarea electronilor;
B) Creșterea stării de oxidare a unui atom
4. Această substanță este doar un agent oxidant
A) H2S; B) H2S04; B) Na2S03; D) SO 2
5. Această substanță este doar un agent reducător
A) NH3; B) HN03; B) NR 2; D) HNO2
Partea "B" - meci(De exemplu, A – 2)
1. Potriviți semireacția cu numele procesului
2. Stabiliți o corespondență între ecuația unei reacții chimice și tipul acesteia
A) 2H2 +O2 = 2H2O | 1) Descompuneri, OVR |
B) 2CuO=2Cu+O2 | 2) Conexiuni, nu OVR |
B) Na20+2HCI=2NaCI+H20 | 3) Schimb, nu OVR |
D) 4HNO3=4NO2+2H2O+O2 | 4) Conexiuni, OVR |
3. Stabiliți o corespondență între atomul de fosfor din formula substanței și proprietățile sale redox pe care le poate prezenta
Partea "C" - rezolvați problema
Din reacțiile propuse, selectați numai ORR, determinați stările de oxidare ale atomilor, indicați agentul de oxidare, agentul reducător, procesele de oxidare și reducere, aranjați coeficienții folosind metoda echilibrului electronic:
NaOH + HCI = NaCI + H2O
Fe(OH)3 = Fe2O3 +H2O
Na + H2S04 = Na2S04 + H2
9.1. Care sunt reacțiile chimice?
Să ne amintim că numim orice fenomen chimic din natură reacții chimice. În timpul unei reacții chimice, unele legături chimice sunt rupte, iar altele se formează. Ca rezultat al reacției, din unele substanțe chimice se obțin și alte substanțe (vezi capitolul 1).
În timp ce vă făceai temele pentru § 2.5, v-ați familiarizat cu selecția tradițională a patru tipuri principale de reacții din întregul set de transformări chimice, apoi ați propus și numele acestora: reacții de combinare, descompunere, substituție și schimb.
Exemple de reacții compuse:
C + O2 = C02; (1)
Na20 + CO2 = Na2CO3; (2)
NH3 + CO2 + H20 = NH4HCO3. (3)
Exemple de reacții de descompunere:
2Ag2O4Ag + O2; (4)
CaC03CaO + CO2; (5)
(NH4)2Cr2O7N2 + Cr2O3 + 4H2O. (6)
Exemple de reacții de substituție:
CuS04 + Fe = FeS04 + Cu; (7)
2NaI + CI2 = 2NaCI + I2; (8)
CaC03 + SiO2 = CaSiO3 + CO2. (9)
| Reacții de schimb- reacţii chimice în care substanţele iniţiale par să-şi schimbe părţile constitutive. |
Exemple de reacții de schimb:
Ba(OH)2 + H2S04 = BaS04 + 2H20; (10)
HCI + KNO2 = KCI + HNO2; (11)
AgNO3 + NaCl = AgCl + NaNO3. (12)
Clasificarea tradițională a reacțiilor chimice nu acoperă toată diversitatea lor - pe lângă cele patru tipuri principale de reacții, există și reacții mult mai complexe.
Identificarea altor două tipuri de reacții chimice se bazează pe participarea la acestea a două particule nechimice importante: electron și proton.
În timpul unor reacții, are loc transferul complet sau parțial de electroni de la un atom la altul. În acest caz, se modifică stările de oxidare ale atomilor elementelor care alcătuiesc substanțele inițiale; dintre exemplele date, acestea sunt reacțiile 1, 4, 6, 7 și 8. Aceste reacții se numesc redox.
Într-un alt grup de reacții, un ion de hidrogen (H +), adică un proton, trece de la o particulă care reacţionează la alta. Astfel de reacții se numesc reacții acido-bazice sau reacții de transfer de protoni.
Printre exemplele date, astfel de reacții sunt reacțiile 3, 10 și 11. Prin analogie cu aceste reacții, reacțiile redox sunt uneori numite reacții de transfer de electroni. Veți face cunoștință cu OVR în § 2 și cu KOR în capitolele următoare.
REACȚII DE COMPUSARE, REACȚII DE DESCOMPUNERE, REACȚII DE SUBSTITUȚIE, REACȚII DE SCHIMB, REACȚII REDOX, REACȚII ACID-BAZĂ.
Scrieți ecuațiile de reacție corespunzătoare următoarelor scheme:
a) HgO Hg + O 2 ( t); b) Li2O + SO2Li2SO3; c) Cu(OH) 2 CuO + H 2 O ( t);
d) Al + I2AlI3; e) CuCl2 + Fe FeCl2 + Cu; e) Mg + H3P04Mg3 (P04)2 + H2;
g) Al + O 2 Al 2 O 3 ( t); i) KClO 3 + P P 2 O 5 + KCl ( t); j) CuS04 + Al Al2 (S04)3 + Cu;
l) Fe + Cl 2 FeCl 3 ( t); m) NH3 + O2N2 + H2O ( t); m) H2S04 + CuO CuS04 + H2O.
Indicați tipul tradițional de reacție. Etichetați reacțiile redox și acido-bazice. În reacțiile redox, indicați care atomi de elemente își schimbă stările de oxidare.
9.2. Reacții redox
Să luăm în considerare reacția redox care are loc în furnalele în timpul producției industriale de fier (mai precis, fontă) din minereu de fier:
Fe 2 O 3 + 3CO = 2Fe + 3CO 2.
Să determinăm stările de oxidare ale atomilor care alcătuiesc atât substanțele inițiale, cât și produșii de reacție
| Fe2O3 | + | = | 2Fe | + |
După cum puteți vedea, starea de oxidare a atomilor de carbon a crescut ca urmare a reacției, starea de oxidare a atomilor de fier a scăzut, iar starea de oxidare a atomilor de oxigen a rămas neschimbată. În consecință, atomii de carbon din această reacție au suferit oxidare, adică au pierdut electroni ( oxidat), iar atomii de fier – reducerea, adică au adăugat electroni ( recuperat) (vezi § 7.16). Pentru a caracteriza OVR se folosesc conceptele oxidantŞi agent reducător.

Astfel, în reacția noastră atomii oxidanți sunt atomi de fier, iar atomii reducători sunt atomi de carbon.
În reacția noastră, agentul de oxidare este oxidul de fier (III), iar agentul de reducere este monoxidul de carbon (II).
În cazurile în care atomii oxidanți și atomii reducători fac parte din aceeași substanță (exemplu: reacția 6 din paragraful anterior), conceptele de „substanță oxidantă” și „substanță reducătoare” nu sunt utilizate.
Astfel, agenții oxidanți tipici sunt substanțe care conțin atomi care tind să câștige electroni (în întregime sau parțial), scăzând starea lor de oxidare. Dintre substanțele simple, acestea sunt în primul rând halogeni și oxigen și, într-o măsură mai mică, sulf și azot. Din substanțe complexe - substanțe care conțin atomi în stări superioare de oxidare care nu sunt înclinați să formeze ioni simpli în aceste stări de oxidare: HNO 3 (N +V), KMnO 4 (Mn +VII), CrO 3 (Cr +VI), KClO 3 (CI +V), KClO 4 (CI +VII), etc.
Agenții reducători tipici sunt substanțele care conțin atomi care tind să doneze complet sau parțial electroni, crescându-le starea de oxidare. Substanțele simple includ hidrogenul, metalele alcaline și alcalino-pământoase și aluminiul. Dintre substanțele complexe - H 2 S și sulfuri (S –II), SO 2 și sulfiți (S +IV), ioduri (I –I), CO (C +II), NH 3 (N –III), etc.
În general, aproape toate substanțele complexe și multe substanțe simple pot prezenta atât proprietăți oxidante, cât și reducătoare. De exemplu:
SO 2 + Cl 2 = S + Cl 2 O 2 (SO 2 este un agent reducător puternic);
S02 + C = S + CO2 (t) (SO2 este un agent de oxidare slab);
C + O2 = CO2 (t) (C este un agent reducător);
C + 2Ca = Ca 2 C (t) (C este un agent de oxidare).
Să revenim la reacția despre care am discutat la începutul acestei secțiuni.
| Fe2O3 | + | = | 2Fe | + |
Vă rugăm să rețineți că, în urma reacției, atomii de oxidare (Fe + III) s-au transformat în atomi reducători (Fe 0), iar atomii reducători (C + II) s-au transformat în atomi de oxidare (C + IV). Dar CO 2 este un agent oxidant foarte slab în orice condiții, iar fierul, deși este un agent reducător, este în aceste condiții mult mai slab decât CO. Prin urmare, produșii de reacție nu reacționează unul cu celălalt și nu are loc reacția inversă. Exemplul dat este o ilustrare a principiului general care determină direcția fluxului OVR:
Reacțiile redox au loc în direcția formării unui agent oxidant mai slab și a unui agent reducător mai slab.
Proprietățile redox ale substanțelor pot fi comparate numai în condiții identice. În unele cazuri, această comparație poate fi făcută cantitativ.
În timp ce îți făcea temele pentru primul paragraf al acestui capitol, te-ai convins că este destul de dificil să selectezi coeficienți în unele ecuații de reacție (în special ORR). Pentru a simplifica această sarcină în cazul reacțiilor redox, se folosesc următoarele două metode:
O) metoda echilibrului electronicŞi
b) metoda echilibrului electron-ion.
Veți învăța acum metoda echilibrului electronilor, iar metoda echilibrului electron-ion este de obicei studiată în instituțiile de învățământ superior.
Ambele metode se bazează pe faptul că electronii din reacțiile chimice nici nu dispar și nici nu apar nicăieri, adică numărul de electroni acceptați de atomi este egal cu numărul de electroni cedați de alți atomi.
Numărul de electroni dați și acceptați în metoda echilibrului electronic este determinat de modificarea stării de oxidare a atomilor. Atunci când se utilizează această metodă, este necesar să se cunoască compoziția atât a substanțelor inițiale, cât și a produselor de reacție.
Să ne uităm la aplicarea metodei balanței electronice folosind exemple.
Exemplul 1. Să creăm o ecuație pentru reacția fierului cu clorul. Se știe că produsul acestei reacții este clorura de fier (III). Să scriem schema de reacție:
Fe + Cl2FeCl3.
Să determinăm stările de oxidare ale atomilor tuturor elementelor care alcătuiesc substanțele care participă la reacție:
Atomii de fier donează electroni, iar moleculele de clor îi acceptă. Să exprimăm aceste procese ecuații electronice:
Fe – 3 e– = Fe +III,
CI2+2 e –= 2Cl –I.
Pentru ca numărul de electroni dat să fie egal cu numărul de electroni primiți, prima ecuație electronică trebuie înmulțită cu doi, iar a doua cu trei:
| Fe – 3 e– = Fe +III, CI2+2 e– = 2Cl –I |
2Fe – 6 e– = 2Fe +III, 3CI2 + 6 e– = 6Cl –I. |
Prin introducerea coeficienților 2 și 3 în schema de reacție, obținem ecuația reacției:
2Fe + 3Cl 2 = 2FeCl 3.
Exemplul 2. Să creăm o ecuație pentru reacția de ardere a fosforului alb în exces de clor. Se știe că clorura de fosfor (V) se formează în următoarele condiții:
| +V –I | ||||
| P 4 | + | Cl2 | PCl 5. |
Moleculele albe de fosfor renunță la electroni (se oxidează), iar moleculele de clor îi acceptă (reduc):
| P 4 – 20 e– = 4P +V CI2+2 e– = 2Cl –I |
1 10 |
2 20 |
P 4 – 20 e– = 4P +V CI2+2 e– = 2Cl –I |
P 4 – 20 e– = 4P +V 10Cl2+20 e– = 20Cl –I |
Factorii obținuți inițial (2 și 20) au avut un divizor comun, prin care (ca și coeficienții viitori din ecuația de reacție) au fost împărțiți. Ecuația reacției:
P4 + 10Cl2 = 4PCl5.
Exemplul 3. Să creăm o ecuație pentru reacția care are loc atunci când sulfura de fier (II) este prăjită în oxigen.
Schema de reactie:
| +III –II | +IV –II | |||||
| + | O2 | + |
În acest caz, atât atomii de fier (II) cât și de sulf (–II) sunt oxidați. Compoziția sulfurei de fier (II) conține atomi ai acestor elemente într-un raport de 1:1 (vezi indicii în formula cea mai simplă).
Balanta electronica:
| 4 | Fe+II – e– = Fe +III S–II–6 e– = S + IV |
În total dau 7 e – |
| 7 | O 2 + 4e – = 2O –II |
Ecuația reacției: 4FeS + 7O 2 = 2Fe 2 O 3 + 4SO 2.
Exemplul 4. Să creăm o ecuație pentru reacția care are loc atunci când disulfura de fier (II) (pirită) este prăjită în oxigen.
Schema de reactie:
| +III –II | +IV –II | |||||
| + | O2 | + |
Ca și în exemplul anterior, atât atomii de fier(II), cât și atomii de sulf sunt de asemenea oxidați aici, dar cu o stare de oxidare de I. Atomii acestor elemente sunt incluși în compoziția piritei într-un raport de 1:2 (vezi indici în cea mai simplă formulă). În acest sens, atomii de fier și sulf reacționează, ceea ce este luat în considerare la compilarea balanței electronice:
| Fe+III – e– = Fe +III 2S–I – 10 e– = 2S +IV |
În total, dau 11 e – | |
| O2+4 e– = 2O –II |
Ecuația reacției: 4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2.
Există, de asemenea, cazuri mai complexe de ODD, dintre care unele vă veți familiariza în timp ce vă faceți temele.
ATOM OXIDANT, ATOM REDUCTOR, SUBSTANȚĂ OXIDANȚĂ, SUBSTANTĂ REDUCătoare, METODA DE ECHILIBRARE ELECTRONICĂ, ECUAȚII ELECTRONICE.
1. Alcătuiți o balanță electronică pentru fiecare ecuație OVR dată în textul § 1 al acestui capitol.
2. Alcătuiți ecuații pentru ORR-urile pe care le-ați descoperit în timp ce finalizați sarcina pentru § 1 din acest capitol. De data aceasta, utilizați metoda echilibrului electronic pentru a stabili cotele. 3.Folosind metoda echilibrului de electroni, creați ecuații de reacție corespunzătoare următoarelor scheme: a) Na + I 2 NaI;
b) Na + O2Na2O2;
c) Na202 + Na Na20;
d) Al + Br2AlBr3;
e) Fe + O 2 Fe 3 O 4 ( t);
e) Fe 3 O 4 + H 2 FeO + H 2 O ( t);
g) FeO + O 2 Fe 2 O 3 ( t);
i) Fe 2 O 3 + CO Fe + CO 2 ( t);
j) Cr + O 2 Cr 2 O 3 ( t);
l) CrO 3 + NH 3 Cr 2 O 3 + H 2 O + N 2 ( t);
m) Mn2O7 + NH3MnO2 + N2 + H20;
m) MnO2 + H2Mn + H2O ( t);
n) MnS + O 2 MnO 2 + SO 2 ( t)
p) PbO 2 + CO Pb + CO 2 ( t);
c) Cu 2 O + Cu 2 S Cu + SO 2 ( t);
t) CuS + O 2 Cu 2 O + SO 2 ( t);
y) Pb 3 O 4 + H 2 Pb + H 2 O ( t).
9.3. Reacții exoterme. Entalpie
De ce apar reacțiile chimice?
Pentru a răspunde la această întrebare, să ne amintim de ce atomii individuali se combină în molecule, de ce se formează un cristal ionic din ioni izolați și de ce se aplică principiul energiei minime atunci când se formează învelișul de electroni a unui atom. Răspunsul la toate aceste întrebări este același: pentru că este benefic din punct de vedere energetic. Aceasta înseamnă că în timpul unor astfel de procese se eliberează energie. S-ar părea că reacțiile chimice ar trebui să aibă loc din același motiv. Într-adevăr, pot fi efectuate multe reacții, în timpul cărora este eliberată energie. Energia este eliberată, de obicei sub formă de căldură.
Dacă în timpul unei reacții exoterme căldura nu are timp să fie îndepărtată, atunci sistemul de reacție se încălzește.
De exemplu, în reacția de ardere a metanului
CH4 (g) + 2O2 (g) = CO2 (g) + 2H2O (g)
se eliberează atât de multă căldură încât metanul este folosit drept combustibil.
Faptul că această reacție eliberează căldură poate fi reflectat în ecuația reacției:
CH4 (g) + 2O2 (g) = CO2 (g) + 2H2O (g) + Q.
Acesta este așa-numitul ecuația termochimică. Aici simbolul „+ Q„ înseamnă că atunci când metanul este ars, căldură este eliberată. Această căldură se numește efectul termic al reacției.
De unde vine căldura degajată?
Știți că în timpul reacțiilor chimice se rup și se formează legăturile chimice. În acest caz, legăturile dintre atomii de carbon și hidrogen din moleculele de CH 4, precum și dintre atomii de oxigen din moleculele de O 2 sunt rupte. În acest caz, se formează noi legături: între atomii de carbon și oxigen din moleculele de CO 2 și între atomii de oxigen și hidrogen din moleculele de H 2O Pentru a rupe legăturile, trebuie să consumați energie (vezi „energie de legătură”, „energia de atomizare”. ), iar atunci când se formează legături, se eliberează energie. Evident, dacă legăturile „noile” sunt mai puternice decât cele „vechi”, atunci va fi eliberată mai multă energie decât absorbită. Diferența dintre energia eliberată și cea absorbită este efectul termic al reacției.
Efectul termic (cantitatea de căldură) este măsurat în kilojuli, de exemplu:
2H2 (g) + O2 (g) = 2H20 (g) + 484 kJ.
Această notație înseamnă că vor fi eliberați 484 kilojulii de căldură dacă doi moli de hidrogen reacţionează cu un mol de oxigen pentru a produce doi moli de apă gazoasă (vapori de apă).
Astfel, în ecuațiile termochimice, coeficienții sunt numeric egali cu cantitățile de substanță ale reactanților și produșilor de reacție.
Ce determină efectul termic al fiecărei reacții specifice?
Efectul termic al reacției depinde
a) asupra stărilor agregative ale substanțelor inițiale și ale produselor de reacție,
b) pe temperatură şi
c) dacă transformarea chimică are loc la volum constant sau la presiune constantă.
Dependența efectului termic al unei reacții de starea de agregare a substanțelor se datorează faptului că procesele de trecere de la o stare de agregare la alta (ca și alte procese fizice) sunt însoțite de eliberarea sau absorbția de căldură. Aceasta poate fi exprimată și printr-o ecuație termochimică. Exemplu – ecuația termochimică pentru condensarea vaporilor de apă:
H20 (g) = H20 (l) + Q.
În ecuațiile termochimice și, dacă este necesar, în ecuațiile chimice obișnuite, stările agregative ale substanțelor sunt indicate folosind indici de litere:
(d) – gaz,
(g) – lichid,
(t) sau (cr) – substanță solidă sau cristalină.
Dependența efectului termic de temperatură este asociată cu diferențele de capacități termice
materii prime şi produşi de reacţie.
Deoarece volumul sistemului crește întotdeauna ca urmare a unei reacții exoterme la presiune constantă, o parte din energie este cheltuită pentru a lucra pentru a crește volumul, iar căldura eliberată va fi mai mică decât dacă aceeași reacție are loc la un volum constant. .
Efectele termice ale reacțiilor sunt de obicei calculate pentru reacțiile care au loc la volum constant la 25 °C și sunt indicate prin simbol Q o.
Dacă energia este eliberată numai sub formă de căldură și o reacție chimică are loc la un volum constant, atunci efectul termic al reacției ( Q V) este egală cu modificarea energie internă(D U) substanțe care participă la reacție, dar cu semnul opus:
Q V = – U.
Energia internă a unui corp este înțeleasă ca energia totală a interacțiunilor intermoleculare, a legăturilor chimice, a energiei de ionizare a tuturor electronilor, a energiei de legătură a nucleonilor din nuclee și a tuturor celorlalte tipuri de energie cunoscute și necunoscute „stocate” de acest corp. Semnul „–” se datorează faptului că atunci când căldura este eliberată, energia internă scade. Adică
U= – Q V .
Dacă reacția are loc la presiune constantă, atunci volumul sistemului se poate modifica. Efectuarea lucrărilor de creștere a volumului implică și o parte din energia internă. În acest caz
U = –(QP+A) = –(QP+PV),
Unde Qp– efectul termic al unei reacții care are loc la presiune constantă. De aici
Q P = – SUSV .
O valoare egală cu U+PV a primit numele modificarea entalpieiși notat cu D H.
H=U+PV.
Prin urmare
Q P = – H.
Astfel, pe măsură ce căldura este eliberată, entalpia sistemului scade. De aici și vechea denumire a acestei cantități: „conținut de căldură”.
Spre deosebire de efectul termic, o modificare a entalpiei caracterizează o reacție indiferent dacă are loc la volum constant sau la presiune constantă. Se numesc ecuațiile termochimice scrise folosind modificarea entalpiei ecuații termochimice în formă termodinamică. În acest caz, este dată valoarea modificării entalpiei în condiții standard (25 °C, 101,3 kPa), notată H o. De exemplu:
2H2 (g) + O2 (g) = 2H2O (g) H o= – 484 kJ;
CaO (cr) + H2O (l) = Ca(OH)2 (cr) H o= – 65 kJ.
Dependența cantității de căldură eliberată în reacție ( Q) din efectul termic al reacției ( Q o) și cantitatea de substanță ( n B) unul dintre participanții la reacție (substanța B - substanța de pornire sau produsul de reacție) este exprimat prin ecuația:
Aici B este cantitatea de substanță B, specificată de coeficientul din fața formulei substanței B în ecuația termochimică.
Sarcină
Determinați cantitatea de substanță hidrogen arsă în oxigen dacă s-au eliberat 1694 kJ de căldură.
Soluţie
2H2 (g) + O2 (g) = 2H20 (g) + 484 kJ. |
|
|
Q = 1694 kJ, 6. Efectul termic al reacției dintre aluminiul cristalin și clorul gazos este de 1408 kJ. Scrieți ecuația termochimică pentru această reacție și determinați masa de aluminiu necesară pentru a produce 2816 kJ de căldură folosind această reacție. 9.4. Reacții endoterme. Entropie Pe lângă reacțiile exoterme, sunt posibile reacții în care căldura este absorbită, iar dacă nu este furnizată, sistemul de reacție este răcit. Astfel de reacții se numesc endotermic. Efectul termic al unor astfel de reacții este negativ. De exemplu: Astfel, energia eliberată în timpul formării legăturilor în produsele acestor reacții și similare este mai mică decât energia necesară pentru a rupe legăturile din substanțele inițiale.
Să luăm două baloane și să umplem unul dintre ele cu azot (gaz incolor) și celălalt cu dioxid de azot (gaz maro), astfel încât atât presiunea, cât și temperatura din baloane să fie aceleași. Se știe că aceste substanțe nu reacționează chimic între ele. Să conectăm strâns baloanele cu gâtul lor și să le instalăm vertical, astfel încât balonul cu dioxid de azot mai greu să fie în partea de jos (Fig. 9.1). După ceva timp, vom vedea că dioxidul de azot maro se răspândește treptat în balonul superior, iar azotul incolor pătrunde în cel inferior. Ca urmare, gazele se amestecă, iar culoarea conținutului baloanelor devine aceeași. Astfel,
Ecuații de legătură între entropie ( S) și alte cantități sunt studiate la cursurile de fizică și chimie fizică. unitate de entropie [ S] = 1 J/K. G= H–T S Condiții pentru reacție spontană: G< 0. La temperaturi scăzute, factorul care determină posibilitatea apariției unei reacții este în mare măsură factorul de energie, iar la temperaturi ridicate este factorul de entropie. Din ecuația de mai sus, în special, este clar de ce reacțiile de descompunere care nu au loc la temperatura camerei (crește entropia) încep să apară la temperaturi ridicate. REACȚIE ENDTERMICĂ, ENTROPIE, FACTOR DE ENERGIE, FACTOR DE ENTROPIE, ENERGIE GIBBS. 2CuO (cr) + C (grafit) = 2Cu (cr) + CO 2 (g) este de –46 kJ. Scrieți ecuația termochimică și calculați câtă energie este necesară pentru a produce 1 kg de cupru din această reacție. CaCO 3 (cr) = CaO (cr) + CO 2 (g) – 179 kJ S-au format 24,6 litri de dioxid de carbon. Stabiliți câtă căldură a fost irosită inutil. Câte grame de oxid de calciu s-au format? |