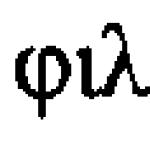განმარტება
წყალბადი- პერიოდული ცხრილის პირველი ელემენტი. აღნიშვნა - H. მდებარეობს პირველ პერიოდში, ჯგუფი I, ქვეჯგუფი A.
ეხება არალითონებს. ბირთვული მუხტი არის 1. ატომური წონა შეიძლება განსხვავდებოდეს: 1, 2, 3, რაც განპირობებულია დეიტერიუმის და ტრიტიუმის იზოტოპების არსებობით.
წყალბადის ატომის ელექტრონული სტრუქტურა
წყალბადის ატომს აქვს დადებითად დამუხტული ბირთვი (+1), 1 პროტონი და ერთი ელექტრონი. ვინაიდან წყალბადს აქვს უმარტივესი ატომური სტრუქტურა პერიოდული ცხრილის ყველა ელემენტს შორის, ის კარგად არის შესწავლილი. 1913 წელს ნილს ბორმა შემოგვთავაზა წყალბადის ატომის სტრუქტურის სქემა, რომლის მიხედვითაც დადებითად დამუხტული ბირთვი მდებარეობს ცენტრში, ხოლო ელექტრონი მოძრაობს მის გარშემო ერთ ორბიტალში (ნახ. 1). ამ სქემის შესაბამისად, მან გამოიტანა ამ ქიმიური ელემენტის ემისიის სპექტრი. რაც მოგვიანებით დადასტურდა შროდინგერის განტოლების კვანტური მექანიკური გამოთვლებით (1925-1930 წწ).
ბრინჯი. 1. წყალბადის ატომის აგებულების სქემა.
წყალბადის ატომის ელექტრონული კონფიგურაცია ასე გამოიყურება:
წყალბადი მიეკუთვნება s-ელემენტების ოჯახს. წყალბადის ატომის ენერგეტიკული დიაგრამა ასე გამოიყურება:
წყალბადის ერთადერთი ელექტრონი არის ვალენტური, რადგან მონაწილეობს ქიმიური ბმების ფორმირებაში. ურთიერთქმედების შედეგად წყალბადს შეუძლია ან დაკარგოს ელექტრონი, ე.ი. იყოს მისი დონორი და მიიღოს იგი, ე.ი. იყავი მიმღები. ამ შემთხვევაში, ატომი იქცევა დადებითად ან უარყოფითად დამუხტულ იონად (H + / H -):
H 0 +e →H — .
პრობლემის გადაჭრის მაგალითები
მაგალითი 1
მაგალითი 2
| ვარჯიში | ჩამოთვალეთ პროტონებისა და ნეიტრონების რაოდენობა, რომლებიც შეიცავს აზოტის (ატომის ნომერი 14), სილიციუმის (ატომის ნომერი 28) და ბარიუმის (ატომის ნომერი 137) ბირთვებში. |
| გამოსავალი | ქიმიური ელემენტის ატომის ბირთვში პროტონების რაოდენობა განისაზღვრება პერიოდულ ცხრილში მისი სერიული ნომრით, ხოლო ნეიტრონების რაოდენობა არის სხვაობა მასის რიცხვსა (M) და ბირთვის მუხტს შორის (Z). აზოტი: n(N)= M -Z = 14-7 = 7. სილიკონი: n(Si)= M -Z = 28-14 = 14. ბარიუმი: n (Ba)= M -Z = 137-56 = 81. |
| უპასუხე | აზოტის ბირთვში პროტონების რაოდენობა 7-ია, ნეიტრონების - 7; სილიციუმის ატომის ბირთვში არის 14 პროტონი და 14 ნეიტრონი; ბარიუმის ატომის ბირთვში არის 56 პროტონი და 81 ნეიტრონი. |
ატომური ბირთვიარის ატომის ცენტრალური ნაწილი, რომელიც შედგება პროტონებისა და ნეიტრონებისგან (ერთად ე.წ ნუკლეონები).
ბირთვი აღმოაჩინა ე. რეზერფორდმა 1911 წელს გადაცემის შესწავლისას α - ნაწილაკები მატერიის გავლით. აღმოჩნდა, რომ ატომის თითქმის მთელი მასა (99,95%) კონცენტრირებულია ბირთვში. ატომის ბირთვის ზომა არის 10 -1 3 -10 - 12 სმ სიდიდის რიგის, რაც 10000-ჯერ მცირეა ელექტრონული გარსის ზომაზე.
ე. რეზერფორდის მიერ შემოთავაზებული ატომის პლანეტარული მოდელი და მისი ექსპერიმენტული დაკვირვება წყალბადის ბირთვებზე დაარტყა α -სხვა ელემენტების ბირთვების ნაწილაკებმა (1919-1920 წწ.) მიიყვანა მეცნიერი იდეამდე. პროტონი. ტერმინი პროტონი შემოიღეს XX საუკუნის 20-იანი წლების დასაწყისში.
პროტონი (ბერძნულიდან. პროტონები- პირველი, სიმბოლო გვ) არის სტაბილური ელემენტარული ნაწილაკი, წყალბადის ატომის ბირთვი.
პროტონი- დადებითად დამუხტული ნაწილაკი, რომლის აბსოლუტური მუხტი უდრის ელექტრონის მუხტს ე= 1,6 · 10 -1 9 კლ. პროტონის მასა 1836-ჯერ მეტია ელექტრონის მასაზე. პროტონული დასვენების მასა მ რ= 1,6726231 · 10 -27 კგ = 1,007276470 ამუ
ბირთვში შემავალი მეორე ნაწილაკი არის ნეიტრონი.
ნეიტრონი (ლათ. ნეიტრალური- არც ერთი და არც მეორე სიმბოლო ნ) არის ელემენტარული ნაწილაკი, რომელსაც არ აქვს მუხტი, ანუ ნეიტრალური.
ნეიტრონის მასა 1839-ჯერ მეტია ელექტრონის მასაზე. ნეიტრონის მასა თითქმის ტოლია (ოდნავ მეტი) პროტონის მასის: თავისუფალი ნეიტრონის დანარჩენი მასა m n= 1,6749286 · 10 -27 კგ = 1,0008664902 ა.მ. და აჭარბებს პროტონის მასას ელექტრონის მასაზე 2,5-ჯერ. ნეიტრონი, პროტონთან ერთად ზოგადი სახელწოდებით ნუკლეონიარის ატომის ბირთვების ნაწილი.
ნეიტრონი აღმოაჩინა 1932 წელს ე. რეზერფორდის სტუდენტმა დ. ჩადვიგმა ბერილიუმის დაბომბვის დროს. α - ნაწილაკები. მიღებულმა გამოსხივებამ მაღალი შეღწევადობის უნარით (გადალახა ტყვიის ფირფიტისგან 10-20 სმ სისქის ბარიერი) გააძლიერა მისი მოქმედება პარაფინის ფირფიტაზე გავლისას (იხ. სურათი). ამ ნაწილაკების ენერგიის შეფასებამ ღრუბლოვანი კამერიდან მიღებული ჯოლიოტ-კურიის წყვილის მიერ და დამატებითი დაკვირვებებმა შესაძლებელი გახადა გამორიცხულიყო საწყისი ვარაუდი, რომ ეს γ -კვანტა. ნეიტრონების წოდებული ახალი ნაწილაკების უფრო დიდი შეღწევადობის უნარი აიხსნება მათი ელექტრული ნეიტრალიტეტით. ყოველივე ამის შემდეგ, დამუხტული ნაწილაკები აქტიურად ურთიერთობენ მატერიასთან და სწრაფად კარგავენ ენერგიას. ნეიტრონების არსებობა იწინასწარმეტყველა ე. რეზერფორდმა დ. ჩადვიგის ექსპერიმენტებამდე 10 წლით ადრე. როცა მოხვდა α - ნაწილაკები ბერილიუმის ბირთვებში ხდება შემდეგი რეაქცია:
აქ არის ნეიტრონის სიმბოლო; მისი მუხტი ნულის ტოლია და მისი ფარდობითი ატომური მასა დაახლოებით ერთობის ტოლია. ნეიტრონი არის არასტაბილური ნაწილაკი: თავისუფალი ნეიტრონი ~ 15 წუთში. იშლება პროტონად, ელექტრონად და ნეიტრინოდ - ნაწილაკად, რომელსაც არ აქვს დასვენების მასა.
1932 წელს ჯ. ჩადვიკის მიერ ნეიტრონის აღმოჩენის შემდეგ, დ. ივანენკომ და ვ. ჰაიზენბერგმა დამოუკიდებლად შესთავაზეს ბირთვის პროტონ-ნეიტრონის (ნუკლეონის) მოდელი. ამ მოდელის მიხედვით, ბირთვი შედგება პროტონებისა და ნეიტრონებისგან. პროტონების რაოდენობა ზემთხვევა მენდელეევის ცხრილის ელემენტის რიგით რიცხვს.
ძირითადი მუხტი ქგანისაზღვრება პროტონების რაოდენობით ზ, შედის ბირთვში და არის ელექტრონის მუხტის აბსოლუტური მნიშვნელობის ჯერადი ე:
Q = +Ze.
ნომერი ზდაურეკა ბირთვის დამუხტვის ნომერიან ატომური ნომერი.
ბირთვის მასური რაოდენობა აარის ნუკლეონების მთლიანი რაოდენობა, ანუ მასში შემავალი პროტონები და ნეიტრონები. ბირთვში ნეიტრონების რაოდენობა მითითებულია ასოებით ნ. ასე რომ, მასობრივი რიცხვია:
A = Z + N.
ნუკლეონებს (პროტონს და ნეიტრონს) ენიჭება მასური რიცხვი, რომელიც ტოლია ერთის, ხოლო ელექტრონს ენიჭება მასური რიცხვი ნული.
აღმოჩენამ ხელი შეუწყო ბირთვის შემადგენლობის იდეასაც იზოტოპები.
იზოტოპები (ბერძნულიდან. isos- თანაბარი, იდენტური და ტოპოა- ადგილი) არის ერთი და იგივე ქიმიური ელემენტის ატომების ჯიშები, რომელთა ატომურ ბირთვებს აქვთ პროტონების იგივე რაოდენობა ( ზ) და სხვადასხვა რაოდენობის ნეიტრონები ( ნ).
ასეთი ატომების ბირთვებს იზოტოპებსაც უწოდებენ. იზოტოპები არიან ნუკლიდებიერთი ელემენტი. ნუკლიდი (ლათ. ბირთვი- ბირთვი) - ნებისმიერი ატომის ბირთვი (შესაბამისად, ატომი) მოცემული რიცხვებით ზდა ნ. ნუკლიდების ზოგადი აღნიშვნაა……. სად X- ქიმიური ელემენტის სიმბოლო, A = Z + N- მასობრივი ნომერი.
იზოტოპებს იგივე ადგილი უჭირავთ ელემენტების პერიოდულ სისტემაში, საიდანაც მოდის მათი სახელი. იზოტოპები, როგორც წესი, მნიშვნელოვნად განსხვავდებიან ბირთვული თვისებებით (მაგალითად, ბირთვულ რეაქციებში მოხვედრის უნარით). იზოტოპების ქიმიური (და თითქმის იგივე ზომით ფიზიკური) თვისებები იგივეა. ეს აიხსნება იმით, რომ ელემენტის ქიმიური თვისებები განისაზღვრება ბირთვის მუხტით, რადგან სწორედ ეს მუხტი მოქმედებს ატომის ელექტრონული გარსის სტრუქტურაზე.
გამონაკლისია მსუბუქი ელემენტების იზოტოპები. წყალბადის იზოტოპები 1 ნ — პროტიუმი, 2 ნ— დეიტერიუმი, 3 ნ — ტრიტიუმიიმდენად განსხვავდებიან მასით, რომ მათი ფიზიკური და ქიმიური თვისებები განსხვავებულია. დეიტერიუმი სტაბილურია (ანუ არ არის რადიოაქტიური) და შედის როგორც მცირე მინარევები (1: 4500) ჩვეულებრივ წყალბადში. დეიტერიუმის ჟანგბადთან შერწყმისას წარმოიქმნება მძიმე წყალი. ნორმალურ ატმოსფერულ წნევაზე ის ადუღდება 101,2 °C-ზე და იყინება +3,8 °C-ზე. ტრიტიუმი β -რადიოაქტიური, ნახევარგამოყოფის პერიოდით დაახლოებით 12 წელი.
ყველა ქიმიურ ელემენტს აქვს იზოტოპები. ზოგიერთ ელემენტს აქვს მხოლოდ არასტაბილური (რადიოაქტიური) იზოტოპები. რადიოაქტიური იზოტოპები ხელოვნურად იქნა მიღებული ყველა ელემენტისთვის.
ურანის იზოტოპები.ელემენტს ურანს აქვს ორი იზოტოპი - მასობრივი ნომრებით 235 და 238. იზოტოპი უფრო გავრცელებულის მხოლოდ 1/140-ია.
როდესაც გაირკვა, რომ ატომების ბირთვებს რთული სტრუქტურა აქვთ, გაჩნდა კითხვა, თუ რა ნაწილაკებისგან შედგება ისინი.
1913 წელს რეზერფორდმა წამოაყენა ჰიპოთეზა, რომ ერთ-ერთი ნაწილაკი, რომელიც ქმნის ყველა ქიმიური ელემენტის ატომურ ბირთვს, არის წყალბადის ატომის ბირთვი.
ამ ვარაუდის საფუძველი იყო იმ დროისთვის გაჩენილი და ექსპერიმენტულად მიღებული არაერთი ფაქტი. კერძოდ, ცნობილი იყო, რომ ქიმიური ელემენტების ატომების მასები აჭარბებს წყალბადის ატომის მასას მთელი რიცხვით (ე.ი. ისინი მისი მრავლობითია). 1919 წელს რეზერფორდმა მოაწყო ექსპერიმენტი, რათა შეესწავლა α-ნაწილაკების ურთიერთქმედება აზოტის ატომების ბირთვებთან.
ამ ექსპერიმენტში, ალფა ნაწილაკმა, რომელიც დაფრინავდა უზარმაზარი სიჩქარით, როდესაც ის მოხვდა აზოტის ატომის ბირთვში, ჩამოაგდო მისგან ზოგიერთი ნაწილაკი. რეზერფორდის ვარაუდით, ეს ნაწილაკი იყო წყალბადის ატომის ბირთვი, რომელსაც რეზერფორდი პროტონს უწოდებდა (ბერძნულიდან პროტოს - პირველი). მაგრამ ვინაიდან ამ ნაწილაკებზე დაკვირვება სცინტილაციის მეთოდით ხდებოდა, შეუძლებელი იყო ზუსტად დაედგინა, რომელი ნაწილაკი გამოიყოფა აზოტის ატომის ბირთვიდან.
შესაძლებელი გახდა იმის დადასტურება, რომ პროტონი ატომის ბირთვიდან რეალურად გამოვიდა მხოლოდ რამდენიმე წლის შემდეგ, როდესაც რეაქცია α ნაწილაკსა და აზოტის ატომის ბირთვს შორის განხორციელდა ღრუბლის კამერაში.
ღრუბლის კამერის გამჭვირვალე მრგვალი ფანჯრის მეშვეობით, შეუიარაღებელი თვალითაც კი შეგიძლიათ იხილოთ მასში სწრაფად მოძრავი ნაწილაკების ბილიკები (ანუ ტრაექტორიები) (სურ. 161).
ბრინჯი. 161. ღრუბლიან კამერაში მიღებული დამუხტული ნაწილაკების კვალის ფოტოები
ფიგურაში ნაჩვენებია სწორი ხაზები, რომლებიც განსხვავდებიან გულშემატკივართა მსგავსად. ეს არის α-ნაწილაკების კვალი, რომლებიც გაფრინდნენ კამერის სივრცეში აზოტის ატომების ბირთვებთან შეჯახების გარეშე. მაგრამ ერთი ალფა ნაწილაკის კვალი ორად იშლება და ქმნის ე.წ. ეს ნიშნავს, რომ ბილიკის ბიფურკაციის წერტილში α-ნაწილაკი ურთიერთქმედებს აზოტის ატომის ბირთვთან, რის შედეგადაც წარმოიქმნება ჟანგბადის და წყალბადის ატომების ბირთვები. ის ფაქტი, რომ ეს კონკრეტული ბირთვები წარმოიქმნება, განისაზღვრა ტრასების გამრუდების ბუნებით, როდესაც ღრუბლის კამერა მოთავსდა მაგნიტურ ველში.
აზოტის ბირთვის α- ნაწილაკებთან ურთიერთქმედების რეაქცია ჟანგბადისა და წყალბადის ბირთვების წარმოქმნით იწერება შემდეგნაირად:
სადაც სიმბოლო H აღნიშნავს პროტონს, ანუ წყალბადის ატომის ბირთვს, რომლის მასა დაახლოებით ტოლია 1 ა. amu (უფრო ზუსტად, 1.0072765 amu) და დადებითი მუხტი ელემენტარული მუხტის ტოლი (ე.ი. ელექტრონის მუხტის მოდული). სიმბოლო ასევე გამოიყენება პროტონის აღსანიშნავად.
შემდგომში შეისწავლეს ალფა ნაწილაკების ურთიერთქმედება სხვა ელემენტების ატომების ბირთვებთან: ბორი (B), ნატრიუმი (Na), ალუმინი (Al), მაგნიუმი (Mg) და მრავალი სხვა. შედეგად, გაირკვა, რომ ალფა ნაწილაკებმა დაარტყა პროტონები ყველა ამ ბირთვიდან. ამან საფუძველი მისცა ვიფიქროთ, რომ პროტონები ყველა ქიმიური ელემენტის ატომის ბირთვების ნაწილია.
პროტონის აღმოჩენამ არ გასცა სრული პასუხი კითხვაზე, თუ რა ნაწილაკებისგან შედგება ატომების ბირთვები. თუ ვივარაუდებთ, რომ ატომის ბირთვები შედგება მხოლოდ პროტონებისგან, მაშინ წარმოიქმნება წინააღმდეგობა.
მოდით ვაჩვენოთ, ბერილიუმის ატომის ბირთვის () მაგალითის გამოყენებით, რა არის ეს წინააღმდეგობა.
დავუშვათ, რომ ბირთვი შედგება მხოლოდ პროტონებისგან. ვინაიდან თითოეული პროტონის მუხტი უდრის ერთ ელემენტარულ მუხტს, ბირთვში პროტონების რაოდენობა უნდა იყოს მუხტის რიცხვის ტოლი, ამ შემთხვევაში ოთხი.
მაგრამ თუ ბერილიუმის ბირთვი ნამდვილად შედგებოდა მხოლოდ ოთხი პროტონისგან, მაშინ მისი მასა იქნებოდა დაახლოებით 4 ა. amu (რადგან თითოეული პროტონის მასა არის დაახლოებით 1 amu).
თუმცა, ეს ეწინააღმდეგება ექსპერიმენტულ მონაცემებს, რომლის მიხედვითაც ბერილიუმის ატომის ბირთვის მასა არის დაახლოებით 9 AU. ე.მ.
ამრიგად, ცხადი ხდება, რომ პროტონების გარდა, ატომების ბირთვები შეიცავს სხვა ნაწილაკებს.
ამასთან დაკავშირებით, 1920 წელს, რეზერფორდმა ვარაუდობს, რომ არსებობს ელექტრულად ნეიტრალური ნაწილაკი, რომლის მასა დაახლოებით პროტონის მასის ტოლია.
30-იანი წლების დასაწყისში. XX საუკუნე აღმოაჩინეს მანამდე უცნობი სხივები, რომლებსაც ბერილიუმის გამოსხივება უწოდეს, რადგან ისინი წარმოიქმნება ბერილიუმის ალფა ნაწილაკებით დაბომბვისას.

ჯეიმს ჩადვიკი (1891-1974)
ინგლისელი ექსპერიმენტატორი ფიზიკოსი. მუშაობს რადიოაქტიურობისა და ბირთვული ფიზიკის დარგში. აღმოაჩინა ნეიტრონი
1932 წელს ინგლისელმა მეცნიერმა ჯეიმს ჩადვიკმა (რაზერფორდის სტუდენტი), ღრუბლის კამერაში ჩატარებული ექსპერიმენტების გამოყენებით დაამტკიცა, რომ ბერილიუმის გამოსხივება არის ელექტრული ნეიტრალური ნაწილაკების ნაკადი, რომლის მასა დაახლოებით პროტონის მასის ტოლია. შესწავლილ ნაწილაკებში ელექტრული მუხტის არარსებობა მოჰყვა, კერძოდ, იმ ფაქტს, რომ ისინი არ გადახრილებია არც ელექტრულ და არც მაგნიტურ ველში. და ნაწილაკების მასა შეფასდა მათი ურთიერთქმედებით სხვა ნაწილაკებთან.
ამ ნაწილაკებს ნეიტრონები ეწოდა. ზუსტმა გაზომვებმა აჩვენა, რომ ნეიტრონის მასა არის 1,0086649 ა. ე.მ., ე.ი. ოდნავ აღემატება პროტონის მასას. ხშირ შემთხვევაში ნეიტრონის მასა (ისევე როგორც პროტონის მასა) ითვლება 1 ა-ის ტოლად. ე.მ. მაშასადამე, ერთეული მოთავსებულია ზევით ნეიტრონული სიმბოლოს წინ. ძირში ნული ნიშნავს ელექტრული მუხტის არარსებობას.
კითხვები
- რა დასკვნა გაკეთდა ღრუბლის კამერაში ნაწილაკების კვალის ფოტოზე დაყრდნობით (იხ. სურ. 161)?
- რა არის წყალბადის ატომის ბირთვის სხვა სახელი და სიმბოლო? რა არის მისი მასა და მუხტი?
- რა ვარაუდის დაშვების საშუალებას მისცა (ბირთვების შემადგენლობასთან დაკავშირებით) ცდების შედეგებმა α-ნაწილაკების ურთიერთქმედების შესახებ სხვადასხვა ელემენტის ატომების ბირთვებთან?
- რა წინააღმდეგობას იწვევს ვარაუდი, რომ ატომის ბირთვები მხოლოდ პროტონებისგან შედგება? ახსენით ეს მაგალითით.
- როგორ დადასტურდა, რომ ნეიტრონებს არ აქვთ ელექტრული მუხტი? როგორ შეფასდა მათი მასა?
- როგორ არის დანიშნული ნეიტრონი, რა არის მისი მასა პროტონის მასასთან შედარებით?
სავარჯიშო 47
განვიხილოთ აზოტისა და ჰელიუმის ბირთვების ურთიერთქმედების ბირთვული რეაქციის ჩანაწერი, რის შედეგადაც წარმოიქმნება ჟანგბადის და წყალბადის ბირთვები. შეადარეთ ურთიერთმოქმედი ბირთვების მთლიანი მუხტი ამ ურთიერთქმედების შედეგად წარმოქმნილი ბირთვების მთლიან მუხტს. დაასკვნეთ, დაკმაყოფილებულია თუ არა ელექტრული მუხტის შენარჩუნების კანონი ამ რეაქციაში.ელექტრონები
ატომის კონცეფცია წარმოიშვა ძველ სამყაროში მატერიის ნაწილაკების აღსანიშნავად. ბერძნულიდან თარგმნილი ატომი ნიშნავს "განუყოფელს".

ირლანდიელი ფიზიკოსი სტოუნი, ექსპერიმენტებზე დაყრდნობით, მივიდა დასკვნამდე, რომ ელექტროენერგია გადადის ყველა ქიმიური ელემენტის ატომში არსებული უმცირესი ნაწილაკებით. 1891 წელს სტოუნიმ შესთავაზა ამ ნაწილაკებს ეწოდოს ელექტრონები, რაც ბერძნულად ნიშნავს "ქარვას". ელექტრონის სახელის მიღებიდან რამდენიმე წლის შემდეგ, ინგლისელმა ფიზიკოსმა ჯოზეფ ტომსონმა და ფრანგმა ფიზიკოსმა ჟან პერენმა დაადასტურეს, რომ ელექტრონები უარყოფით მუხტს ატარებენ. ეს არის ყველაზე პატარა უარყოფითი მუხტი, რომელიც ქიმიაში აღებულია როგორც ერთი (-1). ტომსონმა კი მოახერხა ელექტრონის სიჩქარის დადგენა (ორბიტაზე ელექტრონის სიჩქარე უკუპროპორციულია ორბიტალური რიცხვის n-ის. ორბიტების რადიუსი იზრდება ორბიტალური რიცხვის კვადრატის პროპორციულად. პირველ ორბიტაზე წყალბადის ატომი (n=1; Z=1) სიჩქარე არის ≈ 2,2·106 მ/წმ, ანუ დაახლოებით ასჯერ ნაკლები სინათლის სიჩქარეზე c = 3·108 მ/წმ) და ელექტრონის მასაზე. (ეს თითქმის 2000-ჯერ ნაკლებია წყალბადის ატომის მასაზე).

ელექტრონების მდგომარეობა ატომში
ატომში ელექტრონის მდგომარეობა გაგებულია როგორც ინფორმაციის ერთობლიობა კონკრეტული ელექტრონის ენერგიისა და სივრცის შესახებ, რომელშიც ის მდებარეობს. ატომში ელექტრონს არ აქვს მოძრაობის ტრაექტორია, ანუ ჩვენ შეგვიძლია მხოლოდ ვისაუბროთ მისი პოვნის ალბათობა ბირთვის გარშემო არსებულ სივრცეში.
 ის შეიძლება განთავსდეს ბირთვის მიმდებარე სივრცის ნებისმიერ ნაწილში და მისი სხვადასხვა პოზიციების მთლიანობა განიხილება, როგორც ელექტრონული ღრუბელი გარკვეული უარყოფითი მუხტის სიმკვრივით. ფიგურალურად, ეს შეიძლება ასე წარმოვიდგინოთ: თუ შესაძლებელი იქნებოდა ელექტრონის პოზიციის გადაღება ატომში წამის მეასედი ან მემილიონედების შემდეგ, როგორც ფოტო დასრულებაში, მაშინ ელექტრონი ასეთ ფოტოებში წარმოდგენილი იქნებოდა წერტილების სახით. უთვალავი ასეთი ფოტოსურათის ზედმიწევნით, სურათი იქნება ელექტრონული ღრუბელი უდიდესი სიმკვრივით, სადაც იქნება ყველაზე მეტი ეს წერტილი.
ის შეიძლება განთავსდეს ბირთვის მიმდებარე სივრცის ნებისმიერ ნაწილში და მისი სხვადასხვა პოზიციების მთლიანობა განიხილება, როგორც ელექტრონული ღრუბელი გარკვეული უარყოფითი მუხტის სიმკვრივით. ფიგურალურად, ეს შეიძლება ასე წარმოვიდგინოთ: თუ შესაძლებელი იქნებოდა ელექტრონის პოზიციის გადაღება ატომში წამის მეასედი ან მემილიონედების შემდეგ, როგორც ფოტო დასრულებაში, მაშინ ელექტრონი ასეთ ფოტოებში წარმოდგენილი იქნებოდა წერტილების სახით. უთვალავი ასეთი ფოტოსურათის ზედმიწევნით, სურათი იქნება ელექტრონული ღრუბელი უდიდესი სიმკვრივით, სადაც იქნება ყველაზე მეტი ეს წერტილი.
ატომის ბირთვის ირგვლივ სივრცეს, რომელშიც ელექტრონის ყველაზე დიდი ალბათობაა, ორბიტალი ეწოდება. შეიცავს დაახლოებით 90% ელექტრონული ღრუბელი, და ეს ნიშნავს, რომ დროის დაახლოებით 90% ელექტრონი არის სივრცის ამ ნაწილში. ისინი გამოირჩევიან ფორმის მიხედვით ამჟამად ცნობილი ორბიტალის 4 ტიპი, რომლებიც ლათინურად არის დანიშნული ასოები s, p, d და f. ელექტრონული ორბიტალების ზოგიერთი ფორმის გრაფიკული გამოსახულება წარმოდგენილია ნახატზე.

ელექტრონის მოძრაობის ყველაზე მნიშვნელოვანი მახასიათებელი გარკვეულ ორბიტალში არის ბირთვთან მისი კავშირის ენერგია. მსგავსი ენერგეტიკული მნიშვნელობების მქონე ელექტრონები ქმნიან ერთ ელექტრონულ ფენას, ანუ ენერგიის დონეს. ენერგიის დონეები დანომრილია ბირთვიდან დაწყებული - 1, 2, 3, 4, 5, 6 და 7.
მთელ რიცხვს n, რომელიც მიუთითებს ენერგეტიკული დონის რაოდენობას, ეწოდება ძირითადი კვანტური რიცხვი. იგი ახასიათებს ელექტრონების ენერგიას, რომლებიც იკავებენ მოცემულ ენერგეტიკულ დონეს. ბირთვთან ყველაზე ახლოს მყოფი პირველი ენერგეტიკული დონის ელექტრონებს აქვთ ყველაზე დაბალი ენერგია.პირველი დონის ელექტრონებთან შედარებით, შემდგომი დონის ელექტრონები ხასიათდება ენერგიის დიდი მარაგით. შესაბამისად, გარე დონის ელექტრონები ყველაზე ნაკლებად მჭიდროდ არიან მიბმული ატომის ბირთვთან.
ენერგეტიკულ დონეზე ელექტრონების უდიდესი რაოდენობა განისაზღვრება ფორმულით:
N = 2n 2,
სადაც N არის ელექტრონების მაქსიმალური რაოდენობა; n არის დონის რიცხვი, ან მთავარი კვანტური რიცხვი. შესაბამისად, ბირთვთან ყველაზე ახლოს პირველი ენერგეტიკული დონე შეიძლება შეიცავდეს არაუმეტეს ორი ელექტრონისა; მეორეზე - არაუმეტეს 8; მესამეზე - არაუმეტეს 18; მეოთხეზე - არაუმეტეს 32.
მეორე ენერგეტიკული დონიდან დაწყებული (n = 2), თითოეული დონე იყოფა ქვედონეებად (ქვეფენებად), რომლებიც ოდნავ განსხვავდება ერთმანეთისგან ბირთვთან შეკავშირების ენერგიით. ქვედონეების რაოდენობა უდრის მთავარი კვანტური რიცხვის მნიშვნელობას: პირველ ენერგეტიკულ დონეს აქვს ერთი ქვედონე; მეორე - ორი; მესამე - სამი; მეოთხე - ოთხი ქვედონე. ქვედონეები, თავის მხრივ, იქმნება ორბიტალებით. თითოეული ღირებულებაn შეესაბამება n-ის ტოლი ორბიტალების რაოდენობას.
ქვედონეები, როგორც წესი, აღინიშნება ლათინური ასოებით, ასევე ორბიტალების ფორმით, საიდანაც ისინი შედგება: s, p, d, f.

პროტონები და ნეიტრონები

ნებისმიერი ქიმიური ელემენტის ატომი შედარებულია პატარა მზის სისტემასთან. ამიტომ ე.რეზერფორდის მიერ შემოთავაზებული ატომის ეს მოდელი ე.წ პლანეტარული.
ატომის ბირთვი, რომელშიც კონცენტრირებულია ატომის მთელი მასა, შედგება ორი ტიპის ნაწილაკებისგან - პროტონები და ნეიტრონები.
პროტონებს აქვთ მუხტი ელექტრონების მუხტის ტოლი, მაგრამ საპირისპირო ნიშნით (+1) და მასა ტოლია წყალბადის ატომის მასის (ქიმიაში ის აღებულია როგორც ერთი). ნეიტრონები არ ატარებენ მუხტს, ისინი ნეიტრალურია და აქვთ პროტონის მასის ტოლი მასა.
პროტონებსა და ნეიტრონებს ერთად უწოდებენ ნუკლეონებს (ლათინური ბირთვიდან - ბირთვი). ატომში პროტონებისა და ნეიტრონების რაოდენობის ჯამს მასური რიცხვი ეწოდება. მაგალითად, ალუმინის ატომის მასური რიცხვია:

13 + 14 = 27
პროტონების რაოდენობა 13, ნეიტრონების რაოდენობა 14, მასა ნომერი 27
ვინაიდან ელექტრონის მასა, რომელიც უმნიშვნელოდ მცირეა, შეიძლება უგულებელყო, აშკარაა, რომ ატომის მთელი მასა კონცენტრირებულია ბირთვში. ელექტრონები აღინიშნება e - .
ატომიდან მოყოლებული ელექტრონულად ნეიტრალური, მაშინ ასევე აშკარაა, რომ ატომში პროტონებისა და ელექტრონების რაოდენობა ერთნაირია. ის უდრის პერიოდულ ცხრილში მისთვის მინიჭებული ქიმიური ელემენტის სერიულ ნომერს. ატომის მასა შედგება პროტონებისა და ნეიტრონების მასისგან. ელემენტის (Z) ატომური რიცხვის ცოდნა, ანუ პროტონების რაოდენობა და მასური რიცხვი (A), პროტონებისა და ნეიტრონების რიცხვების ჯამის ტოლია, შეგიძლიათ იპოვოთ ნეიტრონების რაოდენობა (N) ფორმულის გამოყენებით. :

N = A - Z
მაგალითად, ნეიტრონების რაოდენობა რკინის ატომში არის:
56 — 26 = 30
იზოტოპები
ეწოდება ერთი და იგივე ელემენტის ატომების ჯიშებს, რომლებსაც აქვთ იგივე ბირთვული მუხტი, მაგრამ განსხვავებული მასის რიცხვები იზოტოპები. ბუნებაში ნაპოვნი ქიმიური ელემენტები იზოტოპების ნაზავია. ამრიგად, ნახშირბადს აქვს სამი იზოტოპი 12, 13, 14 მასით; ჟანგბადი - სამი იზოტოპი მასებით 16, 17, 18 და ა.შ. ქიმიური ელემენტის ფარდობითი ატომური მასა, როგორც წესი, მოცემულია პერიოდულ ცხრილში, არის მოცემული ელემენტის იზოტოპების ბუნებრივი ნარევის ატომური მასების საშუალო მნიშვნელობა. მათი შედარებითი სიმრავლე ბუნებაში. ქიმიური ელემენტების უმეტესობის იზოტოპების ქიმიური თვისებები ზუსტად იგივეა. თუმცა, წყალბადის იზოტოპები ძლიერ განსხვავდებიან თვისებებით მათი ფარდობითი ატომური მასის მკვეთრი მრავალჯერადი ზრდის გამო; მათ ცალკეული სახელები და ქიმიური სიმბოლოებიც კი ეძლევათ.

პირველი პერიოდის ელემენტები
წყალბადის ატომის ელექტრონული სტრუქტურის დიაგრამა:

ატომების ელექტრონული სტრუქტურის დიაგრამები აჩვენებს ელექტრონების განაწილებას ელექტრონულ ფენებზე (ენერგიის დონეები).

წყალბადის ატომის გრაფიკული ელექტრონული ფორმულა (გვიჩვენებს ელექტრონების განაწილებას ენერგიის დონისა და ქვედონეების მიხედვით):

ატომების გრაფიკული ელექტრონული ფორმულები აჩვენებს ელექტრონების განაწილებას არა მხოლოდ დონეებსა და ქვედონეებს შორის, არამედ ორბიტალებს შორისაც.
ჰელიუმის ატომში პირველი ელექტრონული ფენა დასრულებულია - მას აქვს 2 ელექტრონი. წყალბადი და ჰელიუმი s-ელემენტებია; ამ ატომების s-ორბიტალი სავსეა ელექტრონებით.

მეორე პერიოდის ყველა ელემენტისთვის პირველი ელექტრონული ფენა ივსებადა ელექტრონები ავსებენ მეორე ელექტრონული ფენის s- და p-ორბიტალებს უმცირესი ენერგიის პრინციპის (ჯერ s და შემდეგ p) და პაულისა და ჰუნდის წესების შესაბამისად.
ნეონის ატომში მეორე ელექტრონული ფენა დასრულებულია - მას აქვს 8 ელექტრონი.
მესამე პერიოდის ელემენტების ატომებისთვის პირველი და მეორე ელექტრონული ფენები დასრულებულია, ამიტომ ივსება მესამე ელექტრონული ფენა, რომელშიც ელექტრონებს შეუძლიათ დაიკავონ 3s-, 3p- და 3d-ქვედონეები.
მაგნიუმის ატომი ასრულებს თავის 3s ელექტრონის ორბიტალს. Na და Mg არის s-ელემენტები.
ალუმინის და შემდგომ ელემენტებში 3p ქვედონე ივსება ელექტრონებით.
მესამე პერიოდის ელემენტებს აქვთ შეუვსებელი 3D ორბიტალები.
ყველა ელემენტი Al-დან Ar-მდე არის p-ელემენტები. s- და p- ელემენტები ქმნიან პერიოდულ ცხრილში მთავარ ქვეჯგუფებს.

მეოთხე-მეშვიდე პერიოდის ელემენტები
მეოთხე ელექტრონული ფენა ჩნდება კალიუმის და კალციუმის ატომებში და 4s ქვედონე ივსება, რადგან მას აქვს უფრო დაბალი ენერგია, ვიდრე 3D ქვედონე.
K, Ca - s-ელემენტები, რომლებიც შედის ძირითად ქვეჯგუფებში. Sc-დან Zn-მდე ატომებისთვის 3D ქვედონე ივსება ელექტრონებით. ეს არის 3D ელემენტები. ისინი შედიან მეორად ქვეჯგუფებში, მათი ყველაზე გარე ელექტრონული ფენა შევსებულია და კლასიფიცირდება როგორც გარდამავალი ელემენტები.
ყურადღება მიაქციეთ ქრომის და სპილენძის ატომების ელექტრონული გარსების სტრუქტურას. მათში ერთი ელექტრონი „ჩავარდა“ 4-დან 3D ქვედონემდე, რაც აიხსნება შედეგად მიღებული ელექტრონული კონფიგურაციების უფრო დიდი ენერგეტიკული სტაბილურობით 3d 5 და 3d 10:

თუთიის ატომში დასრულებულია მესამე ელექტრონული ფენა – მასში ივსება ყველა ქვედონე 3s, 3p და 3d, სულ 18 ელექტრონით. თუთიის შემდეგ ელემენტებში, მეოთხე ელექტრონული ფენა, 4p ქვედონე, აგრძელებს შევსებას.
ელემენტები Ga-დან Kr-მდე არის p-ელემენტები.
კრიპტონის ატომს აქვს გარე შრე (მეოთხე), რომელიც სრულია და აქვს 8 ელექტრონი. მაგრამ მეოთხე ელექტრონულ შრეში სულ შეიძლება იყოს 32 ელექტრონი; კრიპტონის ატომს ჯერ კიდევ აქვს შეუვსებელი 4d და 4f ქვედონეები მეხუთე პერიოდის ელემენტებისთვის, ქვედონეები ივსება შემდეგი თანმიმდევრობით: 5s - 4d - 5p. და ასევე არის გამონაკლისები, რომლებიც დაკავშირებულია " წარუმატებლობა» ელექტრონები, y 41 Nb, 42 Mo, 44 Ru, 45 Rh, 46 Pd, 47 Ag.
მეექვსე და მეშვიდე პერიოდებში ჩნდება f-ელემენტები, ანუ ელემენტები, რომლებშიც ივსება მესამე გარე ელექტრონული შრის 4f- და 5f-ქვედონეები, შესაბამისად.
4f ელემენტებს ლანთანიდები ეწოდება.
5f ელემენტებს აქტინიდები ეწოდება.
მეექვსე პერიოდის ელემენტების ატომებში ელექტრონული ქვედონეების შევსების რიგი: 55 Cs და 56 Ba - 6s ელემენტები; 57 La … 6s 2 5d x - 5d ელემენტი; 58 Ce - 71 Lu - 4f ელემენტები; 72 Hf - 80 Hg - 5d ელემენტები; 81 T1 - 86 Rn - 6d ელემენტები. მაგრამ აქაც არის ელემენტები, რომლებშიც „ირღვევა“ ელექტრონული ორბიტალების შევსების თანმიმდევრობა, რაც, მაგალითად, ასოცირდება ნახევრად და სრულად შევსებული f-ქვედონეების უფრო დიდ ენერგეტიკულ სტაბილურობასთან, ანუ nf 7 და nf 14. იმისდა მიხედვით, თუ ატომის რომელი ქვედონე ივსება ბოლოს ელექტრონებით, ყველა ელემენტი იყოფა ოთხ ელექტრონულ ოჯახად ან ბლოკად:
- s-ელემენტები. ატომის გარე დონის s-ქვედონე ივსება ელექტრონებით; s-ელემენტებში შედის წყალბადი, ჰელიუმი და I და II ჯგუფების ძირითადი ქვეჯგუფების ელემენტები.
- p-ელემენტები. ატომის გარე დონის p-ქვედონე ივსება ელექტრონებით; p-ელემენტები მოიცავს III-VIII ჯგუფების ძირითადი ქვეჯგუფების ელემენტებს.
- d-ელემენტები. ატომის წინა გარე დონის d-ქვედონე ივსება ელექტრონებით; d-ელემენტები მოიცავს I-VIII ჯგუფების მეორადი ქვეჯგუფების ელემენტებს, ანუ s- და p- ელემენტებს შორის განლაგებული დიდი პერიოდების ათწლეულების დანამატის ელემენტებს. მათ ასევე უწოდებენ გარდამავალ ელემენტებს.
- f-ელემენტები. ატომის მესამე გარე დონის f-ქვედონე ივსება ელექტრონებით; მათ შორისაა ლანთანიდები და ანტინოიდები.

შვეიცარიელმა ფიზიკოსმა ვ. პაულიმ 1925 წელს დაადგინა, რომ ატომში ერთ ორბიტალში არ შეიძლება იყოს ორი ელექტრონის მეტი საპირისპირო (ანტიპარალელური) სპინები (ინგლისურიდან ითარგმნა როგორც "spindle"), ანუ ისეთი თვისებების მქონე, რაც პირობითად შეიძლება წარმოვიდგინოთ. როგორც ელექტრონის ბრუნვა მისი წარმოსახვითი ღერძის გარშემო: საათის ისრის მიმართულებით ან საწინააღმდეგოდ.

ამ პრინციპს ე.წ პაულის პრინციპი. თუ ორბიტალში არის ერთი ელექტრონი, მაშინ მას უწოდებენ დაუწყვილებელს, თუ არის ორი, მაშინ ეს არის დაწყვილებული ელექტრონები, ანუ ელექტრონები საპირისპირო სპინებით. ნახატზე ნაჩვენებია ენერგიის დონეების ქვედონეებად დაყოფის დიაგრამა და მათი შევსების თანმიმდევრობა.


ძალიან ხშირად, ატომების ელექტრონული გარსების სტრუქტურა გამოსახულია ენერგიის ან კვანტური უჯრედების გამოყენებით - იწერება ე.წ. გრაფიკული ელექტრონული ფორმულები. ამ აღნიშვნებისთვის გამოიყენება შემდეგი აღნიშვნა: თითოეული კვანტური უჯრედი აღინიშნება უჯრედით, რომელიც შეესაბამება ერთ ორბიტალს; თითოეული ელექტრონი მითითებულია სპინის მიმართულების შესაბამისი ისრით. გრაფიკული ელექტრონული ფორმულის დაწერისას უნდა გახსოვდეთ ორი წესი: პაულის პრინციპი და ფ.ჰუნდის წესი, რომლის მიხედვითაც ელექტრონები ჯერ სათითაოდ იკავებენ თავისუფალ უჯრედებს და აქვთ იგივე სპინის მნიშვნელობა და მხოლოდ ამის შემდეგ წყვილდებიან, მაგრამ სპინები, პაულის პრინციპის მიხედვით, უკვე საპირისპირო მიმართულებით იქნება.
ჰუნდის წესი და პაულის პრინციპი
ჰუნდის წესი- კვანტური ქიმიის წესი, რომელიც განსაზღვრავს გარკვეული ქვეფენის ორბიტალების შევსების თანმიმდევრობას და ჩამოყალიბებულია შემდეგნაირად: მოცემული ქვეფენის ელექტრონების სპინის კვანტური რაოდენობის ჯამური მნიშვნელობა უნდა იყოს მაქსიმალური. ჩამოყალიბებულია ფრიდრიხ ჰუნდის მიერ 1925 წელს.
ეს ნიშნავს, რომ ქვეფენის თითოეულ ორბიტალში ჯერ ერთი ელექტრონი ივსება და მხოლოდ შეუვსებელი ორბიტალების ამოწურვის შემდეგ ემატება მეორე ელექტრონი ამ ორბიტალს. ამ შემთხვევაში, ერთ ორბიტალში არის ორი ელექტრონი საპირისპირო ნიშნის ნახევარმთლიანი სპინით, რომლებიც წყვილდებიან (ქმნიან ორელექტრონულ ღრუბელს) და შედეგად, ორბიტალის ჯამური სპინი ხდება ნულის ტოლი.
სხვა ფორმულირება: ენერგიაში უფრო დაბალია ატომური ვადა, რომლისთვისაც ორი პირობაა დაკმაყოფილებული.
- სიმრავლე მაქსიმალურია
- როდესაც სიმრავლეები ერთმანეთს ემთხვევა, მთლიანი ორბიტალური იმპულსი L არის მაქსიმალური.
მოდით გავაანალიზოთ ეს წესი p-ქვედონის ორბიტალების შევსების მაგალითის გამოყენებით გვ-მეორე პერიოდის ელემენტები (ანუ ბორონიდან ნეონამდე (ქვემოთ მოცემულ დიაგრამაში ჰორიზონტალური ხაზები მიუთითებს ორბიტალებზე, ვერტიკალური ისრები მიუთითებს ელექტრონებს, ხოლო ისრის მიმართულება მიუთითებს სპინის ორიენტაციაზე).
კლეჩკოვსკის წესი
კლეჩკოვსკის წესი -ატომებში ელექტრონების მთლიანი რაოდენობის მატებასთან ერთად (მათი ბირთვების მუხტის ან ქიმიური ელემენტების სერიული ნომრების მატებასთან ერთად), ატომური ორბიტალები ისეა დასახლებული, რომ უფრო მაღალი ენერგიის მქონე ორბიტალში ელექტრონების გამოჩენა დამოკიდებულია. მხოლოდ მთავარ კვანტურ რიცხვზე n და არ არის დამოკიდებული ყველა სხვა კვანტურ რიცხვზე, მათ შორის l-ზე. ფიზიკურად, ეს ნიშნავს, რომ წყალბადის მსგავს ატომში (ინტერელექტრონული მოგერიების არარსებობის შემთხვევაში), ელექტრონის ორბიტალური ენერგია განისაზღვრება მხოლოდ ბირთვიდან ელექტრონის მუხტის სიმკვრივის სივრცით დაშორებით და არ არის დამოკიდებული მისი მახასიათებლებზე. მოძრაობა ბირთვის ველში.
კლეჩკოვსკის ემპირიული წესი და მისგან გამომდინარე მოწესრიგების სქემა გარკვეულწილად ეწინააღმდეგება ატომური ორბიტალების რეალურ ენერგეტიკულ თანმიმდევრობას მხოლოდ ორ მსგავს შემთხვევაში: Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au ატომებისთვის. , ხდება ელექტრონის „მარცხი“ s-ით - გარე შრის ქვედონე იცვლება წინა ფენის d-ქვედონით, რაც იწვევს ატომის ენერგიულად უფრო სტაბილურ მდგომარეობას, კერძოდ: ორბიტალი 6-ის ორით შევსების შემდეგ. ელექტრონები ს
ატომი არის ქიმიური ელემენტის უმცირესი ნაწილაკი, რომელიც ინარჩუნებს მის ყველა ქიმიურ თვისებას. ატომი შედგება ბირთვისგან, რომელსაც აქვს დადებითი ელექტრული მუხტი და უარყოფითად დამუხტული ელექტრონები. ნებისმიერი ქიმიური ელემენტის ბირთვის მუხტი უდრის Z და e-ს ნამრავლს, სადაც Z არის ამ ელემენტის რიგითი ნომერი ქიმიური ელემენტების პერიოდულ სისტემაში, e არის ელემენტარული ელექტრული მუხტის მნიშვნელობა.
ელექტრონიარის უარყოფითი ელექტრული მუხტის მქონე ნივთიერების უმცირესი ნაწილაკი e=1,6·10 -19 კულონი, აღებული ელემენტარული ელექტრული მუხტის სახით. ბირთვის ირგვლივ მოძრავი ელექტრონები განლაგებულია ელექტრონულ გარსებში K, L, M და ა.შ. K არის ბირთვთან ყველაზე ახლოს მდებარე გარსი. ატომის ზომა განისაზღვრება მისი ელექტრონული გარსის ზომით. ატომს შეუძლია დაკარგოს ელექტრონები და გახდეს დადებითი იონი ან მოიპოვოს ელექტრონები და გახდეს უარყოფითი იონი. იონის მუხტი განსაზღვრავს დაკარგული ან მიღებული ელექტრონების რაოდენობას. ნეიტრალური ატომის დამუხტულ იონად გადაქცევის პროცესს იონიზაცია ეწოდება.
ატომური ბირთვი(ატომის ცენტრალური ნაწილი) შედგება ელემენტარული ბირთვული ნაწილაკებისგან - პროტონებისა და ნეიტრონებისგან. ბირთვის რადიუსი დაახლოებით ასი ათასი ჯერ მცირეა ატომის რადიუსზე. ატომის ბირთვის სიმკვრივე უკიდურესად მაღალია. პროტონები- ეს არის სტაბილური ელემენტარული ნაწილაკები ერთი დადებითი ელექტრული მუხტით და მასით 1836-ჯერ მეტი ელექტრონის მასაზე. პროტონი არის ყველაზე მსუბუქი ელემენტის, წყალბადის ატომის ბირთვი. ბირთვში პროტონების რაოდენობაა Z. ნეიტრონიარის ნეიტრალური (ელექტრული მუხტის გარეშე) ელემენტარული ნაწილაკი, რომლის მასა ძალიან ახლოს არის პროტონის მასასთან. ვინაიდან ბირთვის მასა შედგება პროტონებისა და ნეიტრონების მასისგან, ატომის ბირთვში ნეიტრონების რაოდენობა უდრის A - Z, სადაც A არის მოცემული იზოტოპის მასური რიცხვი (იხ.). პროტონს და ნეიტრონს, რომლებიც ქმნიან ბირთვს, ეწოდება ნუკლეონები. ბირთვში ნუკლეონები დაკავშირებულია სპეციალური ბირთვული ძალებით.
ატომის ბირთვი შეიცავს ენერგიის უზარმაზარ რეზერვს, რომელიც გამოიყოფა ბირთვული რეაქციების დროს. ბირთვული რეაქციები ხდება, როდესაც ატომური ბირთვები ურთიერთქმედებენ ელემენტარულ ნაწილაკებთან ან სხვა ელემენტების ბირთვებთან. ბირთვული რეაქციების შედეგად წარმოიქმნება ახალი ბირთვები. მაგალითად, ნეიტრონს შეუძლია პროტონად გარდაქმნა. ამ შემთხვევაში, ბეტა ნაწილაკი, ანუ ელექტრონი, გამოიდევნება ბირთვიდან.
ბირთვში პროტონის ნეიტრონზე გადასვლა შეიძლება განხორციელდეს ორი გზით: ან ელექტრონის მასის ტოლი, მაგრამ დადებითი მუხტის მქონე ნაწილაკი, რომელსაც ეწოდება პოზიტრონი (პოზიტრონის დაშლა), გამოიყოფა. ბირთვი, ანუ ბირთვი იჭერს ერთ-ერთ ელექტრონს მასთან ყველაზე ახლოს K- გარსიდან (K -დაჭერა).
ზოგჯერ მიღებულ ბირთვს აქვს ენერგიის ჭარბი რაოდენობა (აღგზნებულ მდგომარეობაშია) და ნორმალურ მდგომარეობაში გადასვლისას ათავისუფლებს ჭარბ ენერგიას ელექტრომაგნიტური გამოსხივების სახით ძალიან მოკლე ტალღის სიგრძით -. ბირთვული რეაქციების დროს გამოთავისუფლებული ენერგია პრაქტიკულად გამოიყენება სხვადასხვა ინდუსტრიაში.
ატომი (ბერძნ. atomos - განუყოფელი) არის ქიმიური ელემენტის უმცირესი ნაწილაკი, რომელსაც აქვს თავისი ქიმიური თვისებები. თითოეული ელემენტი შედგება კონკრეტული ტიპის ატომისგან. ატომი შედგება ბირთვისგან, რომელიც ატარებს დადებით ელექტრულ მუხტს და უარყოფითად დამუხტული ელექტრონებისაგან (იხ.), რომლებიც ქმნიან მის ელექტრონულ გარსებს. ბირთვის ელექტრული მუხტის სიდიდე უდრის Z-e, სადაც e არის ელემენტარული ელექტრული მუხტი, სიდიდით ელექტრონის მუხტის ტოლი (4,8·10 -10 ელექტრული ერთეული), ხოლო Z არის ამ ელემენტის ატომური რიცხვი. ქიმიური ელემენტების პერიოდულ სისტემაში (იხ.). ვინაიდან არაიონიზირებული ატომი ნეიტრალურია, მასში შემავალი ელექტრონების რაოდენობა ასევე უდრის Z-ს. ბირთვის შემადგენლობაში (იხ. ატომური ბირთვი) შედის ნუკლეონები, ელემენტარული ნაწილაკები, რომელთა მასა დაახლოებით 1840-ჯერ აღემატება ელექტრონის მასას. (ტოლია 9,1 10 - 28 გ), პროტონები (იხ.), დადებითად დამუხტული და ნეიტრონები მუხტის გარეშე (იხ.). ბირთვში ნუკლეონების რაოდენობას ეწოდება მასური რიცხვი და აღინიშნება ასო A. ბირთვში პროტონების რაოდენობა, Z-ის ტოლი, განსაზღვრავს ატომში შემავალი ელექტრონების რაოდენობას, ელექტრონული გარსების სტრუქტურას და ქიმიურ ნივთიერებას. ატომის თვისებები. ბირთვში ნეიტრონების რაოდენობაა A-Z. იზოტოპები ერთი და იგივე ელემენტის ჯიშებია, რომელთა ატომები განსხვავდებიან ერთმანეთისგან A მასის რიცხვით, მაგრამ აქვთ იგივე Z. ამრიგად, ერთი და იგივე ელემენტის სხვადასხვა იზოტოპების ატომების ბირთვებში არის სხვადასხვა რაოდენობის ნეიტრონები ერთი და იგივე. პროტონების რაოდენობა. იზოტოპების აღნიშვნისას ელემენტის სიმბოლოს ზემოთ მასობრივი რიცხვი A იწერება, ქვემოთ კი ატომური რიცხვი; მაგალითად, ჟანგბადის იზოტოპები აღინიშნება: ![]()
ატომის ზომები განისაზღვრება ელექტრონული გარსების ზომებით და ყველა Z-სთვის არის 10-8 სმ რიგის მნიშვნელობა, ვინაიდან ატომის ყველა ელექტრონის მასა რამდენიმე ათასჯერ ნაკლებია ბირთვის მასაზე ატომის მასა მასის რიცხვის პროპორციულია. მოცემული იზოტოპის ატომის ფარდობითი მასა განისაზღვრება C12 ნახშირბადის იზოტოპის ატომის მასასთან მიმართებაში, რომელიც აღებულია 12 ერთეულით და ეწოდება იზოტოპური მასა. გამოდის, რომ ახლოსაა შესაბამისი იზოტოპის მასურ რიცხვთან. ქიმიური ელემენტის ატომის ფარდობითი წონა არის იზოტოპური წონის საშუალო (მოცემული ელემენტის იზოტოპების ფარდობითი სიმრავლის გათვალისწინებით) ღირებულება და ეწოდება ატომური წონა (მასა).
ატომი მიკროსკოპული სისტემაა და მისი სტრუქტურისა და თვისებების ახსნა შესაძლებელია მხოლოდ კვანტური თეორიის გამოყენებით, რომელიც შეიქმნა ძირითადად მე-20 საუკუნის 20-იან წლებში და მიზნად ისახავს ატომური მასშტაბის ფენომენების აღწერას. ექსპერიმენტებმა აჩვენა, რომ მიკრონაწილაკებს - ელექტრონებს, პროტონებს, ატომებს და ა.შ. - გარდა კორპუსკულურისა, აქვთ ტალღური თვისებები, გამოიხატება დიფრაქციით და ინტერფერენციით. კვანტურ თეორიაში მიკრო ობიექტების მდგომარეობის აღსაწერად გამოიყენება გარკვეული ტალღური ველი, რომელიც ხასიათდება ტალღის ფუნქციით (Ψ-ფუნქცია). ეს ფუნქცია განსაზღვრავს მიკროობიექტის შესაძლო მდგომარეობის ალბათობას, ანუ ახასიათებს პოტენციურ შესაძლებლობებს მისი გარკვეული თვისებების გამოვლენისთვის. სივრცეში და დროში Ψ ფუნქციის ცვალებადობის კანონი (შროდინგერის განტოლება), რომელიც ამ ფუნქციის პოვნის საშუალებას იძლევა, კვანტურ თეორიაში იგივე როლს ასრულებს, როგორც ნიუტონის მოძრაობის კანონები კლასიკურ მექანიკაში. შროდინგერის განტოლების ამოხსნა ხშირ შემთხვევაში იწვევს სისტემის დისკრეტულ შესაძლო მდგომარეობას. ასე, მაგალითად, ატომის შემთხვევაში, მიიღება ელექტრონების ტალღური ფუნქციების სერია, რომლებიც შეესაბამება სხვადასხვა (კვანტიზებული) ენერგიის მნიშვნელობებს. კვანტური თეორიის მეთოდებით გამოთვლილმა ატომური ენერგიის დონეების სისტემამ ბრწყინვალე დადასტურება მიიღო სპექტროსკოპიაში. ატომის გადასვლა ძირითადი მდგომარეობიდან E 0 ენერგეტიკული დონის შესაბამისი E 0 რომელიმე აღგზნებულ მდგომარეობაზე E i - E 0 ენერგიის გარკვეული ნაწილის შთანთქმისას. აღგზნებული ატომი მიდის ნაკლებად აგზნებად ან ძირითად მდგომარეობაში, ჩვეულებრივ, ფოტონის გამოსხივებით. ამ შემთხვევაში ფოტონის ენერგია hv ტოლია ატომის ენერგიების სხვაობას ორ მდგომარეობაში: hv = E i - E k სადაც h არის პლანკის მუდმივი (6.62·10 -27 erg·sec), v არის სიხშირე. სინათლის.
ატომური სპექტრების გარდა, კვანტურმა თეორიამ შესაძლებელი გახადა ატომების სხვა თვისებების ახსნა. კერძოდ, ახსნილი იქნა ვალენტობა, ქიმიური ბმების ბუნება და მოლეკულების აგებულება და შეიქმნა ელემენტების პერიოდული ცხრილის თეორია.