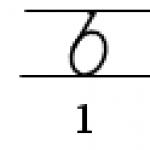Η ανόργανη χημεία είναι ένας βασικός κλάδος της χημείας. - Επιπλέον, αυτό είναι το απλούστερο τμήμα της χημείας, η οργανική χημεία είναι πολύ πιο περίπλοκη. Γι' αυτό θα ξεκινήσουμε τη μελέτη μας για τη χημεία με την ανόργανη χημεία. Όπως ήδη γνωρίζετε από την ανόργανη χημεία είναι η επιστήμη των χημικών στοιχείων και αυτώνανόργανες ενώσεις . Τι είναι αυτόχημικό στοιχείο; Ένα χημικό στοιχείο είναι μια αφηρημένη έννοια που υποδηλώνει μια απλή ουσία που αποτελείται από άτομα του ίδιου τύπου.Κάθε χημικό στοιχείο έχει έναν αύξοντα αριθμό in περιοδικός πίνακας, που συμπίπτει με τον αριθμό των πρωτονίων μέσα
ατομικό πυρήνα . Είναι απαραίτητο να διακρίνουμε το ίδιο το χημικό στοιχείο από την ουσία που αντιπροσωπεύει.Ένα χημικό στοιχείο είναι απλώς το όνομα για τα άτομα μιας ουσίας. Αλλά η ίδια η ουσία, ακόμη και αποτελούμενη από ένα άτομο, μπορεί να έχει διαφορετικές μορφές.
Ένα χαρακτηριστικό παράδειγμα αυτού είναι ο άνθρακας. Μπορεί να έχει τη μορφή μαύρων κάρβουνων που παραμένουν μετά τη φωτιά, με τη μορφή μπρικέτες άνθρακα ή τύρφης, που χρησιμοποιούνται για τη θέρμανση μιας σόμπας, με τη μορφή ράβδου γραφίτη, που βρίσκεται μέσα σε ένα μολύβι, ακόμη και σε τη μορφή των διαμαντιών. Όλα αυτά είναι ποικιλίες του ίδιου χημικού στοιχείου - άνθρακα. Η μόνη διαφορά είναι πώς τα άτομα είναι διατεταγμένα μεταξύ τους. Για παράδειγμα, στο διαμάντι, τα άτομα άνθρακα σχηματίζουν ένα τρισδιάστατο χωρικό πλέγμα σε σχήμα τετραέδρου (πυραμίδα):
Τι είναι λοιπόν ένα άτομο; Και είναι ένας πυρήνας που βρίσκεται στο κέντρο του ατόμου, γύρω από τον οποίο περιστρέφονται τα ηλεκτρόνια. Ταυτόχρονα, δεν πρέπει να φανταστεί κανείς ότι απλώς πετούν γύρω από τον πυρήνα, όπως οι δορυφόροι γύρω από τη Γη ή ένας πλανήτης γύρω από τον Ήλιο. Στην πραγματικότητα, τα ηλεκτρόνια, τα πρωτόνια και άλλα στοιχειώδη σωματίδια είναι ένα τόσο άγνωστο, ακατανόητο πράγμα με πολύ εξωτικές ιδιότητες που μπορεί να βρίσκονται ταυτόχρονα σε διαφορετικά μέρη. Επομένως, τα ηλεκτρόνια είναι, σαν να λέγαμε, «αλειμμένα» κατά μήκος των τροχιών τους. Και τέτοιες τροχιές ηλεκτρονίων σε άτομα ονομάζονται τροχιακά.
Ο πυρήνας αποτελείται από νετρόνια και πρωτόνια. Τα νετρόνια είναι ουδέτερα φορτισμένα σωματίδια, τα πρωτόνια είναι θετικά φορτισμένα σωματίδια και τα ηλεκτρόνια είναι αρνητικά φορτισμένα. Επομένως, μεταξύ των τελευταίων υπάρχουν δυνάμεις ηλεκτρομαγνητικής έλξης, με αποτέλεσμα τα ηλεκτρόνια συνήθως να μην πετούν μακριά από τα άτομα. Ναι, συνήθως δεν πετούν μακριά, γιατί μερικές φορές συμβαίνει ότι τα ηλεκτρόνια εξακολουθούν να αποσπώνται από τους πυρήνες τους. Για ποιο λόγο; Για παράδειγμα, εάν εφαρμοστεί ένα ηλεκτρικό πεδίο σε ένα κομμάτι ουσίας, το οποίο θα τραβήξει ηλεκτρόνια από τα άτομα (θα πάει ηλεκτρικό ρεύμα). Ή μερικοί στοιχειώδες σωματίδιοόπως ένα φωτόνιο (ένα κομμάτι φωτός) μπορεί να το χτυπήσει. Αλλά η συζήτηση της φυσικής είναι πέρα από το πεδίο εφαρμογής αυτών των μαθημάτων, εδώ έχουμε χημεία. Ας προχωρήσουμε λοιπόν.
Λοιπόν, πιστεύετε ότι ένας πυρήνας μπορεί να προσελκύσει ένα ηλεκτρόνιο από ένα γειτονικό άτομο; Γιατί όχι; Τέτοιες δυνάμεις ηλεκτρομαγνητικής αλληλεπίδρασης δρουν μεταξύ τους. Είναι αλήθεια ότι το άλλο άτομο έχει επίσης έναν πυρήνα που θα εμποδίσει το ηλεκτρόνιο να πετάξει μακριά. Αλλά η δύναμη της έλξης δεν εξαφανίζεται. Τι πιστεύετε ότι θα συμβεί με τα άτομα που είναι αρκετά κοντά το ένα στο άλλο; Σωστά, θα αλληλεπιδράσουν με κάποιο τρόπο. Από τη μια πλευρά, οι πυρήνες προσπαθούν να πάρουν ηλεκτρόνια από τον γείτονά τους, δημιουργώντας μια ελκτική δύναμη από την άλλη, τα ηλεκτρόνια των γειτονικών ατόμων θα απωθούνται μεταξύ τους. Έτσι, τα άτομα θα μετατοπιστούν σε τέτοια απόσταση που αυτές οι δυνάμεις θα εξισορροπηθούν. Εάν όλα τα άτομα είναι ίδια, τότε το αποτέλεσμα θα είναι ένα κρυσταλλικό πλέγμα (αν είναι στερεός), ή, ας πούμε, για τα αέρια, σχηματίζονται διατομικά μόρια. Υπάρχουν, φυσικά, και άλλες επιλογές, αλλά θα τις δούμε αργότερα στις κατάλληλες ενότητες.
Τι γίνεται αν τα άτομα είναι διαφορετικά; Τότε μπορούν να σχηματίσουν διαφορετικές συνδέσεις μεταξύ τους, που συνήθως ονομάζονται χημικούς δεσμούς. Διακρίνονται οι ακόλουθοι τύποι χημικών δεσμών:
1 . Ομοιοπολικός μη πολικός δεσμός.Οφείλεται στην επικάλυψη των λεγόμενων σύννεφα ηλεκτρονίωνδύο άτομα. Έχω ήδη πει ότι ένα ηλεκτρόνιο σε ένα άτομο δεν βρίσκεται σε ένα μέρος, αλλά είναι, σαν να λέγαμε, απλωμένο στην τροχιά του (τροχιακό). Αυτό το ηλεκτρόνιο που «απλώνεται» σε όλο το διάστημα είναι το σύννεφο ηλεκτρονίων. Έτσι τα σύννεφα επικαλύπτονται εν μέρει μεταξύ τους με έναν ομοιοπολικό μη πολικό δεσμό. Αυτή η σύνδεση είναι χαρακτηριστική για απλά μόρια, για παράδειγμα, H 2 - υδρογόνο, O 2 - οξυγόνο.
2. Ομοιοπολικός δεσμός.Αυτό είναι ουσιαστικά το ίδιο με έναν ομοιοπολικό μη πολικό δεσμό, αλλά ένα από τα άτομα τραβά ελαφρώς το ηλεκτρόνιο του άλλου ατόμου πάνω του.
3. Ιωνικός δεσμός.Στην περίπτωση ενός τέτοιου δεσμού, ένα από τα άτομα χάνει ένα ηλεκτρόνιο και το άλλο το «αρπάζει» μόνο του. Ως αποτέλεσμα, και τα δύο γίνονται ιόντα με αντίθετα φορτία, τα οποία, όπως γνωρίζουμε, ελκύουν το ένα το άλλο.
4. Μεταλλική σύνδεση.Όλα τα άτομα σε ένα κομμάτι μετάλλου συνδέονται με έναν τέτοιο δεσμό. Η ουσία του είναι ότι τα μεταλλικά άτομα δεν μπορούν να συγκρατήσουν ένα από τα ηλεκτρόνια και να το χάνουν εύκολα. Επομένως, τα ελεύθερα ηλεκτρόνια κυκλοφορούν εύκολα μεταξύ των ατόμων.
5. Δεσμός υδρογόνου.Είναι ένας δεσμός που σχηματίζεται μεταξύ ενός ατόμου υδρογόνου ενός μορίου και ενός εξαιρετικά ηλεκτραρνητικού ατόμου ενός άλλου μορίου. Ηλεκτραρνητικότηταείναι η ικανότητα των ατόμων να προσελκύουν ηλεκτρόνια από άλλα άτομα. Η μεγαλύτερη ηλεκτραρνητικότητα είναι στα αλογόνα - φθόριο, χλώριο, καθώς και σε ισχυρούς οξειδωτικούς παράγοντες, για παράδειγμα, οξυγόνο. Η ουσία ενός τέτοιου δεσμού είναι ότι ένα μόριο που περιέχει ένα ισχυρό ηλεκτραρνητικό άτομο έλκει ένα άτομο υδρογόνου από ένα άλλο μόριο.
Μπορεί να προκύψει το ερώτημα: Γιατί το υδρογόνο σχηματίζει τέτοιους δεσμούς;
Αυτό εξηγείται από το γεγονός ότι η ατομική ακτίνα του υδρογόνου είναι πολύ μικρή. Επιπλέον, όταν το υδρογόνο εκτοπίζει ή εγκαταλείπει τελείως το μοναδικό του ηλεκτρόνιο, αποκτά ένα σχετικά υψηλό θετικό φορτίο, λόγω του οποίου το υδρογόνο ενός μορίου αλληλεπιδρά με άτομα ηλεκτραρνητικών στοιχείων που έχουν μερική αρνητικό φορτίο, το οποίο είναι μέρος άλλων μορίων (HF, H 2 O, NH 3).
Ένας δεσμός υδρογόνου αντιπροσωπεύεται συνήθως με κουκκίδες ή μια διακεκομμένη γραμμή επειδή είναι κάτι μεταξύ ενός χημικού δεσμού (ομοιοπολικού, ιοντικού) και ενός κανονικού μοριακού δεσμού: πολύ πιο αδύναμος από τον πρώτο αλλά ισχυρότερος από τον δεύτερο.
Οχι ακόμη οργανική χημείαΕίναι σύνηθες να ταξινομούνται οι ανόργανες ουσίες. Πρώτον, ομαδοποιούνται σε απλά και σύνθετα.
Απλές ουσίες είναι εκείνες οι ουσίες που αποτελούνται από ένα μόνο στοιχείο. Αυτοί, με τη σειρά τους, χωρίζονται σε ομάδες:
μέταλλα.Πρόκειται για ουσίες που έχουν έντονες μεταλλικές ιδιότητες, συγκεκριμένα: υψηλή θερμική και ηλεκτρική αγωγιμότητα και χαρακτηριστική μεταλλική λάμψη, σκληρότητα.. Στα μέταλλα περιλαμβάνονται ουσίες όπως σίδηρος (Fe), χαλκός (Cu), νάτριο (Na), κάλιο (K), λίθιο (Li), ασήμι (Ag), χρυσό (Au) και άλλα.Κ χημικές ιδιότητεςΤα μέταλλα έχουν το γεγονός ότι εγκαταλείπουν εύκολα τα ηλεκτρόνια τους από τα τελευταία τροχιακά.
Αμέταλλα.Αυτές είναι ουσίες που έχουν τυπικές μη μεταλλικές ιδιότητες: κακή ηλεκτρική αγωγιμότητα μεταξύ των μη μετάλλων υπάρχουν πολλές ουσίες που βρίσκονται σε αέρια κατάσταση σε θερμοκρασία δωματίου, για παράδειγμα, οξυγόνο (O 2), άζωτο (N 2). Αλλά μεταξύ των μη μετάλλων υπάρχουν και στερεές ουσίες, για παράδειγμα, θείο (S 2), πυρίτιο (Si).
Οι χημικές ιδιότητες των μη μετάλλων περιλαμβάνουν το γεγονός ότι παίρνουν πιο εύκολα ηλεκτρόνια στον εαυτό τους παρά τα εγκαταλείπουν.Αδρανή αέρια. Υπάρχει μια ολόκληρη ομάδαχημικά στοιχεία , των οποίων τα άτομα δεν αλληλεπιδρούν με τίποτα και δεν σχηματίζουν καμία ένωση. Σε θερμοκρασία δωματίου, τέτοιες ουσίες βρίσκονται σε αέρια κατάσταση. Αυτά είναι το ήλιο (He), το νέο (Ne), το αργό (Ar) και άλλα. Τέτοια αέρια ονομάζονται.
αδρανή αέρια
Οι σύνθετες ουσίες ομαδοποιούνται επίσης:Οξείδια.
Ένα από τα συστατικά αυτών των ουσιών είναι το οξυγόνο.Υδροξύλια.
Ένα από τα συστατικά τέτοιων ενώσεων είναι η υδροξυλομάδα (ΟΗ - οξυγόνο + υδρογόνο). Καθαρά τέτοιες ενώσεις έχουν αλκαλικές ιδιότητες.Οξέα.
Ένας συνδυασμός υδρογόνου με όξινη ομάδα, τέτοιες ουσίες είναι πολύ συχνά χημικά ενεργές, αντιδρώντας με πολλές ουσίες, συμπεριλαμβανομένης της διάβρωσης πολλών μετάλλων.Αλας.
Εάν ένα άτομο υδρογόνου σε ένα οξύ αντικατασταθεί από ένα άτομο μετάλλου, το αποτέλεσμα είναι ένα άλας. Για παράδειγμα, ο τύπος για το υδροχλωρικό οξύ είναι HCl. Και φόρουμ το επιτραπέζιο αλάτι NaCl που λαμβάνεται με βάση του.Δυαδικές ενώσεις.
Αυτές είναι ενώσεις δύο στοιχείων, για παράδειγμα, το υδρόθειο H 2 S (ένα δηλητηριώδες και πολύ δύσοσμο αέριο).Ανθρακικά.
Άλατα και εστέρες ανθρακικού οξέος (H 2 CO 3)Καρβίδια.
Ενώσεις μετάλλων και μη μετάλλων με άνθρακα.Κυανίδια.
Άλατα υδροκυανικού οξέος (HCN).Οξείδια του άνθρακα.
Διαχωρίστηκαν σε μια ξεχωριστή ομάδα επειδή δεν είναι σαφές αν είναι μονοξείδιο του άνθρακα ή καρβίδιο του οξυγόνου. αλλά εξακολουθεί να είναι γενικά αποδεκτό ότι η ένωση του άνθρακα με το οξυγόνο είναι ακριβώς το μονοξείδιο του άνθρακα.
Άλλες εξωτικές ενώσεις. Σε αυτόσύντομη εκδρομή Vανόργανη χημεία
τελειώσει, η ίδια η χημεία θα ξεκινήσει στο επόμενο μάθημα.
Ο κύριος στόχος του ιστότοπού μας είναι να βοηθήσει τους μαθητές και τους μαθητές που αντιμετωπίζουν δυσκολίες στην επίλυση μιας συγκεκριμένης εργασίας ή που έχουν χάσει οποιοδήποτε σχολικό θέμα. Ο πόρος μας θα βοηθήσει επίσης γονείς μαθητών που αντιμετωπίζουν δυσκολίες στον έλεγχο της εργασίας των παιδιών τους.
Στον πόρο μας μπορείτε να βρείτε έτοιμες εργασίες για όλες τις τάξεις από την 1η έως την 11η τάξη. ακαδημαϊκά θέματα. Για παράδειγμα, μπορείτε να βρείτε το GDZ στα μαθηματικά, ξένες γλώσσες, φυσική, βιολογία, λογοτεχνία κ.λπ. Για να το κάνετε αυτό, απλά πρέπει να επιλέξετε απαιτούμενη τάξη, το απαιτούμενο θέμα και τα βιβλία εργασίας GDZ από κατάλληλους συγγραφείς, μετά από τα οποία πρέπει να βρείτε την απαιτούμενη ενότητα και να λάβετε απάντηση στην εργασία. Τα GD σας επιτρέπουν να ελέγξετε γρήγορα την εργασία που έχει ανατεθεί στον μαθητή στο σπίτι, καθώς και να προετοιμάσετε το παιδί για τη δοκιμή.
Πώς να πάρετε ένα Α στην εργασία σας;
Για να το κάνετε αυτό, πρέπει να μεταβείτε στον πόρο μας, όπου δημοσιεύονται έτοιμες εργασίες για το σπίτι για όλους τους κλάδους. σχολικό πρόγραμμα σπουδών. Ταυτόχρονα, δεν χρειάζεται να ανησυχείτε για λάθη, τυπογραφικά λάθη και άλλες ελλείψεις στο GDZ, επειδή όλα τα εγχειρίδια που δημοσιεύτηκαν μαζί μας ελέγχθηκαν από έμπειρους ειδικούς. Όλες οι απαντήσεις στην εργασία είναι σωστές, οπότε μπορούμε να πούμε με σιγουριά ότι για οποιαδήποτε από αυτές θα λάβετε ένα Α! Αλλά δεν πρέπει να αντιγράψετε τα πάντα στο σημειωματάριό σας, αντίθετα, πρέπει να κάνετε τις εργασίες μόνοι σας, στη συνέχεια να τις ελέγξετε με τη βοήθεια του GDZ και μόνο μετά να τις ξαναγράψετε σε ένα καθαρό αντίγραφο. Αυτό θα σας επιτρέψει να αποκτήσετε τις απαραίτητες γνώσεις και έναν υψηλό βαθμό.
GDZ σε απευθείας σύνδεση
Τώρα κανείς δεν αντιμετωπίζει προβλήματα πρόσβασης στο GDZ, επειδή ο πόρος μας στο Διαδίκτυο είναι προσαρμοσμένος για όλες τις σύγχρονες συσκευές: υπολογιστές, φορητούς υπολογιστές, tablet και smartphone που έχουν πρόσβαση στο Διαδίκτυο. Τώρα, ακόμη και κατά τη διάρκεια του διαλείμματος, μπορείτε να μεταβείτε στον ιστότοπό μας από το τηλέφωνό σας και να μάθετε την απάντηση σε οποιαδήποτε εργασία. Η βολική πλοήγηση και η γρήγορη φόρτωση του ιστότοπου σάς επιτρέπουν να αναζητάτε και να βλέπετε το GDZ όσο το δυνατόν πιο γρήγορα και άνετα. Η πρόσβαση στον πόρο μας είναι δωρεάν και η εγγραφή είναι πολύ γρήγορη.
GDZ του νέου προγράμματος
Το σχολικό πρόγραμμα αλλάζει περιοδικά, έτσι οι μαθητές χρειάζονται συνεχώς νέα διδακτικά βοηθήματα, σχολικά βιβλία και GDZ. Οι ειδικοί μας παρακολουθούν συνεχώς τις καινοτομίες και, μετά την εφαρμογή τους, δημοσιεύουν αμέσως νέα σχολικά βιβλία και GD στον πόρο, ώστε οι χρήστες να έχουν διαθέσιμες τις πιο πρόσφατες εκδόσεις. Ο πόρος μας είναι ένα είδος βιβλιοθήκης για μαθητές, που χρειάζεται κάθε μαθητής για επιτυχημένες σπουδές. Σχεδόν κάθε χρόνο το σχολικό πρόγραμμα γίνεται πιο σύνθετο, με νέα μαθήματα και υλικά να εισάγονται. Η μελέτη γίνεται ολοένα και πιο δύσκολη, αλλά ο ιστότοπός μας διευκολύνει τη ζωή για γονείς και μαθητές.
Βοήθεια για μαθητές
Δεν ξεχνάμε τη σύνθετη, πολυάσχολη ζωή των μαθητών. Κάθε νέο ακαδημαϊκό έτοςανεβάζει τον πήχη σε επίπεδο γνώσεων, επομένως δεν είναι όλοι οι μαθητές ικανοί να αντεπεξέλθουν σε ένα τόσο μεγάλο φορτίο. Μακρά μαθήματα, διάφορες περιλήψεις, εργαστήριο και διατριβέςκαταλαμβάνουν σχεδόν όλο τον ελεύθερο χρόνο των μαθητών. Με τη βοήθεια της ιστοσελίδας μας, κάθε μαθητής μπορεί να φτιάξει το δικό του καθημερινή ζωή. Για να γίνει αυτό, σχεδόν καθημερινά οι ειδικοί μας δημοσιεύουν νέα έργα στην πύλη. Τώρα οι μαθητές μπορούν να βρουν φύλλα απάτης για οποιαδήποτε εργασία μαζί μας και εντελώς δωρεάν.
Τώρα δεν χρειάζεται να μεταφέρετε έναν τεράστιο αριθμό σχολικών βιβλίων στο σχολείο κάθε μέρα
Για τη φροντίδα των μαθητών, οι ειδικοί μας έχουν αναρτήσει όλα τα σχολικά εγχειρίδια στον ιστότοπο σε δημόσιο τομέα. Ως εκ τούτου, σήμερα οποιοσδήποτε μαθητής ή γονέας μπορεί να τα χρησιμοποιήσει και οι μαθητές δεν χρειάζεται πλέον να ζορίζουν την πλάτη τους κάθε μέρα μεταφέροντας βαριά σχολικά βιβλία στο σχολείο. Αρκεί να κατεβάσετε τα απαραίτητα σχολικά βιβλία στο tablet, στο τηλέφωνο ή σε άλλη σύγχρονη συσκευή και τα σχολικά βιβλία θα είναι πάντα μαζί σας οπουδήποτε. Μπορείτε επίσης να τα διαβάσετε ηλεκτρονικά απευθείας στον ιστότοπο - είναι πολύ άνετο, γρήγορο και εντελώς δωρεάν.
Έτοιμα σχολικά δοκίμια
Εάν ξαφνικά σας ζητηθεί να γράψετε ένα δοκίμιο για ένα βιβλίο, τότε θυμηθείτε ότι στον ιστότοπό μας μπορείτε πάντα να βρείτε έναν τεράστιο αριθμό έτοιμων σχολικών δοκιμίων που γράφτηκαν από δασκάλους και εγκρίθηκαν από δασκάλους. Επεκτείνουμε τη λίστα με τα δοκίμια κάθε μέρα, γράφοντας νέα δοκίμια για πολλά θέματα και λαμβάνοντας υπόψη τις συστάσεις των χρηστών. Αυτό μας επιτρέπει να καλύψουμε τις καθημερινές ανάγκες όλων των μαθητών.
Για ανεξάρτητη συγγραφή δοκιμίων, παρέχουμε συντομευμένες εργασίες που μπορούν επίσης να προβληθούν και να ληφθούν στον ιστότοπο. Περιέχουν το κύριο νόημα των σχολικών λογοτεχνικών έργων, το οποίο μειώνει σημαντικά τη μελέτη των βιβλίων και εξοικονομεί την ενέργεια του μαθητή, την οποία χρειάζεται για να μελετήσει άλλα μαθήματα.
Παρουσιάσεις για διάφορα θέματα
Εάν πρέπει επειγόντως να κάνετε μια σχολική παρουσίαση για ένα συγκεκριμένο θέμα για το οποίο δεν γνωρίζετε τίποτα, τότε με τη βοήθεια της ιστοσελίδας μας μπορείτε να το κάνετε. Τώρα δεν χρειάζεται να αφιερώνετε πολύ χρόνο στην αναζήτηση εικόνων, φωτογραφιών, έντυπων πληροφοριών και διαβούλευσης για το θέμα με ειδικούς κ.λπ., επειδή ο πόρος μας δημιουργεί παρουσιάσεις υψηλής ποιότητας με περιεχόμενο πολυμέσωνσε οποιοδήποτε θέμα. Οι ειδικοί μας έχουν δημοσιεύσει στον ιστότοπο μεγάλο αριθμόπαρουσιάσεις του συγγραφέα που μπορείτε να δείτε και να κατεβάσετε δωρεάν. Επομένως, η μάθηση θα είναι πιο εκπαιδευτική και άνετη για εσάς, γιατί θα έχετε περισσότερο χρόνο για ξεκούραση και άλλα θέματα.
Τα πλεονεκτήματά μας:
* Μεγάλη βάση δεδομένων βιβλίων και δημόσιων αρχείων.
* Τα υλικά ενημερώνονται καθημερινά.
* πρόσβαση από οποιονδήποτε σύγχρονο gadget;
* λαμβάνουμε υπόψη τις επιθυμίες των χρηστών.
* Κάνουμε τη ζωή των μαθητών, των μαθητών και των γονέων πιο ελεύθερες και πιο χαρούμενες.
Βελτιώνουμε συνεχώς τους πόρους μας για να κάνουμε τη ζωή των χρηστών μας πιο άνετη και ξέγνοιαστη. Με τη βοήθεια του gdz.host θα είσαι άριστος μαθητής, οπότε θα σου ανοίξουν μεγάλες προοπτικές στο ενήλικη ζωή. Ως αποτέλεσμα, οι γονείς σου θα είναι περήφανοι για σένα γιατί εσύ θα το κάνεις καλό παράδειγμαγια όλους τους ανθρώπους.
Ακόμη και στο γυμνάσιο, πολλοί μαθητές έρχονται αντιμέτωποι με το ερώτημα πώς να μάθουν τη χημεία μόνοι τους από την αρχή, επειδή αυτή η επιστήμη σπάνια κατακτάται την πρώτη φορά. καθηγητές σχολείωνΣυχνά δεν πιστεύεται ότι τα παιδιά δεν λαμβάνουν όλες τις απαραίτητες γνώσεις που τους επιτρέπουν να σπουδάσουν την επιστήμη σε πιο σύνθετο επίπεδο. Ως εκ τούτου, τα παιδιά δεν καταλαβαίνουν όλο και περισσότερα νέα καθήκοντα, καταλήγοντας στο συμπέρασμα ότι έχουν κακή προδιάθεση για το θέμα. Στην πραγματικότητα, τα κενά γνώσης μπορεί να προκύψουν όχι λόγω προβλημάτων με τη σκέψη, αλλά λόγω λανθασμένων σχολικών μεθόδων διδασκαλίας.
Ας μιλήσουμε για το πώς να μάθετε χημεία μόνοι σας από την αρχή στο σπίτι. Αυτή η ερώτηση είναι επίσης σχετική για τους αποφοίτους σχολείων που σχεδιάζουν να λάβουν μέρος στην Ενιαία Κρατική Εξέταση και να εισέλθουν σε πανεπιστήμια.
Πολλοί φοιτητές που σπουδάζουν στα ιατρικά πανεπιστήμια αντιμετωπίζουν καθημερινά τη χημεία. Και την ίδια στιγμή, δεν γνώριζαν όλοι καλά αυτή την επιστήμη στο σχολείο. Ιδού οι συμβουλές που δίνουν στη νέα γενιά:
- Για να περάσετε τις εξετάσεις, χρειάζεστε γνώση ολόκληρου του σχολικού μαθήματος χημείας. Αλλά για να σπουδάσεις στο πανεπιστήμιο θα χρειαστείς μόνο τα βασικά της ανόργανης επιστήμης έμπειροι καθηγητές θα σου διδάξουν όλα τα άλλα. Επομένως, αναπτύξτε τη βραχυπρόθεσμη μνήμη σας. Ολοι περιττές πληροφορίεςμετά περνώντας από την Ενιαία Κρατική Εξέτασηθα πρέπει να το βγάλεις από το μυαλό σου.
- Τα μαθήματα με δάσκαλο θα φέρουν πολύ περισσότερα οφέλη από το να μελετάς μόνος σου. Ωστόσο, αν δεν έχετε την ευκαιρία να παρακολουθήσετε ατομικά μαθήματα, μην απελπίζεστε, γιατί μπορείτε να μάθετε μόνοι σας χημεία, αλλά θα χρειαστεί σκληρή δουλειά.
- Να θυμάστε ότι η ανθρωπότητα δεν έχει βρει μια ακόμη πιο αποτελεσματική μέθοδο μελέτης των κλάδων από το να εργάζεστε σκληρά πάνω στις γνώσεις και τις δεξιότητές σας. Η συνεχής εξάσκηση είναι το κλειδί της επιτυχίας σας.
Είναι η συνέχεια στη μάθηση που είναι ο βασικός παράγοντας για την επίτευξη του στόχου. Για να εξασκηθείτε αποτελεσματικά, πρέπει να δημιουργήσετε την κατάλληλη ψυχολογική διάθεση.

Πολλοί μαθητές ενδιαφέρονται όχι τόσο για την ποιότητα της γνώσης που λαμβάνουν, όσο για τον χρόνο που θα χρειαστεί για να σπουδάσουν. Πιστέψτε με, όσο πιο διεξοδικά μελετάτε τα βασικά της επιστήμης, όσο πιο ξεκάθαρο γίνεται το νόημα κάθε εξίσωσης για εσάς, τόσο πιο γρήγορα θα κατακτήσετε περισσότερα σύνθετα θέματα. ΣΕ σε αυτή την περίπτωσηΘα σας είναι δύσκολο μόνο στην αρχή. Μπείτε στην ουσία των βασικών εννοιών και τότε η επίγνωση κάθε χημικού νόμου θα έρθει στο μυαλό σας.
Απλώς μη δίνοντας προσοχή στις προθεσμίες, μπορείτε να μάθετε γρήγορα τη χημεία. Είναι δυνατό να γίνει αυτό σε ένα μήνα, αν μιλάμε για σχολικό μάθημα. Συνήθως, οι μαθητές που ετοιμάζονται να δώσουν εξετάσεις θέτουν αυτόν τον στόχο. Χρησιμοποιήστε την τεχνική που προτείνεται παρακάτω για να δημιουργήσετε την κατάλληλη ψυχολογική διάθεση.

Το κίνητρο είναι το κλειδί της επιτυχίας
Για να δημιουργήσετε κατάλληλα κίνητρα για τον εαυτό σας και να το διατηρήσετε καθ' όλη τη διάρκεια της προπόνησής σας, χρησιμοποιήστε τις ακόλουθες συστάσεις:
- Θέστε έναν στόχο για τον εαυτό σας, διατυπώστε τον, κατανοώντας ξεκάθαρα ποιο αποτέλεσμα θέλετε να επιτύχετε.
- Θυμηθείτε να μην προσπαθήσετε να μάθετε πολλές πληροφορίες σε σύντομο χρονικό διάστημα. Δεν θα μείνει για πολύ στις σκέψεις σας και όλες οι φόρμουλες θα συγχωνευτούν.
- Το θεωρητικό υλικό δεν θα γίνει πλήρως κατανοητό από εσάς εάν δεν το εμπεδώσετε λύνοντας πρακτικές εργασίες. Επιπλέον, η αυτοεκτίμησή σας θα αυξηθεί σημαντικά εάν λύνετε προβλήματα.
- Κανονίστε μόνοι σας τεστ στα οποία θα ελέγξετε τον βαθμό κυριαρχίας της ύλης.
Η χημεία είναι απλώς επιστήμη. Ανθρώπινος εγκέφαλοςσχεδιασμένο με τέτοιο τρόπο ώστε να μπορούμε να θυμόμαστε και να κατανοούμε απολύτως οποιαδήποτε πληροφορία. Επομένως, σταματήστε να λέτε στον εαυτό σας ότι η χημεία δεν είναι το πράγμα σας, τότε θα πετύχετε.

Γίνε δάσκαλος
Όσο κι αν ακούγεται περίεργο, θα μάθετε καλύτερα το υλικό αν το εξηγήσετε σε κάποιον. Μάθατε ένα νέο θέμα αλλά δεν είστε σίγουροι ότι το καταλάβατε πλήρως; Βρείτε ένα άτομο που δεν το καταλαβαίνει καθόλου και εξηγήστε του την ουσία του υλικού. Πιστέψτε με, μετά από αυτό το μάθημα, στο οποίο θα ενεργείτε ως δάσκαλος, όχι μόνο ο «μαθητής» σας θα αποκτήσει περισσότερες γνώσεις, αλλά και εσείς.
Γιατί η χημεία είναι ένα προβληματικό θέμα
Συνήθως, η χημεία αρχικά δεν ενθουσιάζει τους μαθητές. Μετά το πρώτο μάθημα, τα περισσότερα παιδιά εγκαταλείπουν τη μελέτη αυτής της επιστήμης, πιστεύοντας ότι δεν έχουν την ικανότητα. Αυτό οφείλεται στο γεγονός ότι από την παιδική ηλικία διδασκόμαστε ότι η χημεία είναι μια επιστήμη που έχει δώσει στην ανθρωπότητα πολλά ενδιαφέροντα πειράματα, εκπληκτικά αξιοθέατα και εκπληκτικές καινοτομίες. Όταν οι μαθητές γυμνάσιοΌταν έρχονται στο πρώτο τους μάθημα, ετοιμάζονται να λάβουν μια αξέχαστη εμπειρία και να συμμετάσχουν σε ενδιαφέροντα πειράματα. Αντίθετα, οι μαθητές βλέπουν μόνο στεγνή θεωρία και πολλά ακατανόητα προβλήματα. Απογοητεύονται από το αντικείμενο και όταν έρχεται η ώρα να δώσουν εξετάσεις, συνειδητοποιούν ότι δεν έχουν γνώσεις.
Αυτό φταίνε οι μεγάλοι. Το παιδί πρέπει να καταλάβει ότι τα θεάματα στη χημεία διαμορφώνονται με σκληρή δουλειά και μόνο με κάποια προσπάθεια μπορούν να πραγματοποιηθούν ενδιαφέροντα πειράματα.

Επιτυχία στην Ενιαία Κρατική Εξέταση
Οι απόφοιτοι συχνά σκέφτονται πώς να μάθουν μόνοι τους χημεία από την αρχή για να περάσουν την Ενιαία Κρατική Εξέταση. Η απάντηση σε αυτό το ερώτημα είναι πολύ απλή. Απλά χρειάζεται να σπουδάσεις χημεία χωρίς να σκέφτεσαι τις εξετάσεις. Οι γνώσεις σας θα είναι πολύ καλύτερες και βαθύτερες αν κατακτήσετε το θέμα για τον εαυτό σας και όχι για την είσοδο στο πανεπιστήμιο. Έχοντας εμβαθύνει στην ουσία της επιστήμης, ακολουθώντας τις παραπάνω συμβουλές, μπορείτε εύκολα να γράψετε τεστ για
Η επιστήμη της χημείας είναι πολύ ενδιαφέρουσα και η γνώση της μπορεί να είναι χρήσιμη στη ζωή για κάθε άτομο. Αλλά αποδεικνύεται ότι δεν είναι τόσο εύκολο να το καταλάβουμε μελετώντας το από ένα σχολικό εγχειρίδιο, ειδικά λαμβάνοντας υπόψη το γεγονός ότι ο δάσκαλος δεν έχει πάντα χρόνο να απαντήσει σε όλες τις ερωτήσεις των μαθητών. Αυτό το βιβλίο αυτο-οδηγίας, που συντάχθηκε από τον E. N. Frenkel, δημιουργήθηκε ακριβώς για να βρει απαντήσεις σε όλες τις ερωτήσεις σας σε αυτό.
Οι πληροφορίες του βιβλίου παρουσιάζονται με τέτοιο τρόπο ώστε να είναι όσο το δυνατόν πιο κατανοητές, δηλ. Δεν υπάρχουν απλά ξερά γεγονότα εδώ. Μπορεί να διαβαστεί θεωρητική θέσηκαι αμέσως δείτε εξηγήσεις που δεν βρίσκονται σε κανονικά σχολικά βιβλία. Το βιβλίο εξηγεί επίσης πώς να επιλύσετε προβλήματα, δίνει εργασίες για την ενίσχυση της ύλης και περιλαμβάνει εργασίες που βρέθηκαν στην Εξεταστική Ενιαία Πολιτεία. Αυτό το βιβλίο θα είναι χρήσιμο σε όλους όσους θέλουν να κατανοήσουν καλύτερα το μάθημα της σχολικής χημείας, να εμβαθύνουν τις γνώσεις τους και να θυμούνται όσα έχουν μάθει στο παρελθόν. Μπορεί να χρησιμοποιηθεί από μαθητές και υποψήφιους κατά την προετοιμασία για εξετάσεις σε ιατρικά πανεπιστήμια ή τμήματα χημείας. Θα ενδιαφέρει επίσης οποιονδήποτε ενδιαφέρεται απλώς για την επιστήμη της χημείας, αλλά για κάποιο λόγο δεν έδινε αρκετή προσοχή σε αυτήν στο σχολείο. Αφού μελετήσετε το βιβλίο, καταλαβαίνετε ότι η χημεία δεν είναι τόσο περίπλοκη, και το πιο σημαντικό, είναι μια ενδιαφέρουσα επιστήμη.
Το έργο ανήκει στο είδος της εκπαιδευτικής λογοτεχνίας. Εκδόθηκε το 2016 από τον Εκδοτικό Οίκο AST. Το βιβλίο είναι μέρος της σειράς «Γυμνάσιο και Λύκειο. Βέλτιστες πρακτικέςεκπαίδευση." Στην ιστοσελίδα μας μπορείτε να κατεβάσετε το βιβλίο "Χημεία. Εγχειρίδιο αυτο-οδηγίας. Ένα βιβλίο για όσους θέλουν να περάσουν εξετάσεις, καθώς και να κατανοήσουν και να αγαπήσουν τη χημεία. Στοιχεία γενικής, ανόργανης και οργανικής χημείας" σε μορφή fb2, rtf, epub, pdf, txt ή διαβάστε online. Η βαθμολογία του βιβλίου είναι 4,5 στα 5. Εδώ, πριν διαβάσετε, μπορείτε επίσης να ανατρέξετε στις κριτικές αναγνωστών που είναι ήδη εξοικειωμένοι με το βιβλίο και μάθετε τη γνώμη τους Στο ηλεκτρονικό κατάστημα του συνεργάτη μας μπορείτε να αγοράσετε και να διαβάσετε το βιβλίο σε έντυπη έκδοση.
E.N.Frenkel
Φροντιστήριο χημείας
Ένα εγχειρίδιο για όσους δεν ξέρουν, αλλά θέλουν να μάθουν και να κατανοήσουν τη χημεία
Μέρος Ι. Στοιχεία γενική χημεία
(πρώτο επίπεδο δυσκολίας)
Εγώ, Frenkel Evgenia Nikolaevna, Επίτιμος Εργάτης Τριτοβάθμιας Εκπαίδευσης της Ρωσικής Ομοσπονδίας, απόφοιτος της Χημικής Σχολής του Κρατικού Πανεπιστημίου της Μόσχας το 1972, διδακτική εμπειρία 34 ετών.
Επιπλέον, είμαι μητέρα τριών παιδιών και γιαγιά τεσσάρων εγγονιών, το μεγαλύτερο από τα οποία πηγαίνει σχολείο. Με απασχολεί το πρόβλημα των σχολικών εγχειριδίων.Το κύριο πρόβλημα πολλών από αυτά είναι η δύσκολη γλώσσα, η οποία απαιτεί επιπλέον «μετάφραση» σε μια γλώσσα που μπορούν να κατανοήσουν οι μαθητές για να παρουσιάσουν εκπαιδευτικό υλικό. Οι μαθητές της δευτεροβάθμιας εκπαίδευσης έρχονται συχνά σε μένα με το εξής αίτημα: «Μετάφρασε το κείμενο του σχολικού βιβλίου ώστε να είναι σαφές». Γι' αυτό έγραψα έναν «Αυτοδάσκαλο στη Χημεία», στο οποίο πολλά δύσκολες ερωτήσεις. Εκατοντάδες μαθητές μαθήτευσαν εκεί. Πολλοί από αυτούς ξεκίνησαν από το μηδέν και μετά από 40 μαθήματα κατάλαβαν τόσο πολύ το θέμα που έδωσαν εξετάσεις με «4» και «5». Γι' αυτό στην πόλη μας τα εγχειρίδια αυτοδιδασκαλίας μου πωλούνται σαν κέικ.
Ίσως και άλλοι να βρουν χρήσιμη τη δουλειά μου;
Το άρθρο ετοιμάστηκε με την υποστήριξη του εκπαιδευτικού κέντρου MakarOFF. Το εκπαιδευτικό κέντρο σας προσφέρει φθηνά μαθήματα μανικιούρ στη Μόσχα. Η επαγγελματική σχολή μανικιούρ παρέχει εκπαίδευση στο μανικιούρ, πεντικιούρ, επεκτάσεις και σχεδιασμό νυχιών, καθώς και μαθήματα για γενικούς τεχνικούς νυχιών, επεκτάσεις βλεφαρίδων, microblading, ζαχαροπλαστική και αποτρίχωση με κερί. Το κέντρο εκδίδει διπλώματα μετά από εκπαίδευση και εγγυημένη απασχόληση. Λεπτομερείς πληροφορίες για όλα τα προγράμματα εκπαίδευσης, τιμές, χρονοδιαγράμματα, προσφορές και εκπτώσεις, επαφές στον ιστότοπο: www.akademiyauspeha.ru.
Πρόλογος
Αγαπητοί αναγνώστες! Ο «Αυτοδάσκαλος Χημείας» που φέρνουμε στην προσοχή σας δεν είναι ένα συνηθισμένο εγχειρίδιο. Δεν αναφέρει απλώς κάποια γεγονότα ή περιγράφει τις ιδιότητες των ουσιών. Το "Tutorial" εξηγεί και διδάσκει ακόμη και σεσε εκείνη την περίπτωση
, εάν, δυστυχώς, δεν γνωρίζετε και δεν καταλαβαίνετε τη χημεία και δεν μπορείτε να απευθυνθείτε στον δάσκαλο για διευκρίνιση ή ντρέπεστε. Σε χειρόγραφο, αυτό το βιβλίο χρησιμοποιείται από μαθητές από το 1991 και δεν υπήρξε ούτε ένας μαθητής που να απέτυχε στις εξετάσεις χημείας τόσο στο σχολείο όσο και στα πανεπιστήμια. Επιπλέον, πολλοί από αυτούς δεν ήξεραν καθόλου χημεία.
Ο «Αυτοδάσκαλος» έχει σχεδιαστεί για ανεξάρτητη εργασία από τον μαθητή. Το κύριο πράγμα είναι να απαντήσετε στις ερωτήσεις που εμφανίζονται στο κείμενο καθώς διαβάζετε. Εάν δεν μπορέσατε να απαντήσετε στην ερώτηση, διαβάστε ξανά προσεκτικά το κείμενο - όλες οι απαντήσεις είναι κοντά. Συνιστάται επίσης να κάνετε όλες τις ασκήσεις που εμφανίζονται κατά την επεξήγηση νέου υλικού. Σε αυτό θα βοηθήσουν πολλοί εκπαιδευτικοί αλγόριθμοι που πρακτικά δεν βρίσκονται σε άλλα σχολικά βιβλία. Με τη βοήθειά τους θα μάθετε:
Σχεδιάστε χημικούς τύπους με βάση το σθένος. Γράψτε εξισώσειςχημικές αντιδράσεις
, τακτοποιήστε τους συντελεστές σε αυτά, συμπεριλαμβανομένων των εξισώσεων των διεργασιών οξειδοαναγωγής.
Σύνθεση ηλεκτρονικών τύπων (συμπεριλαμβανομένων σύντομων ηλεκτρονικών τύπων) ατόμων και προσδιορισμός των ιδιοτήτων των αντίστοιχων χημικών στοιχείων.
Προβλέψτε τις ιδιότητες ορισμένων ενώσεων και προσδιορίστε εάν μια δεδομένη διαδικασία είναι δυνατή ή όχι. Το εγχειρίδιο έχει δύο επίπεδα δυσκολίας. Εγχειρίδιο αυτο-οδηγίαςπρώτο επίπεδο δυσκολίας
αποτελείται από τρία μέρη. Μέρος Ι. Στοιχεία γενικής χημείας ().
δημοσιευμένο
Μέρος III. Στοιχεία οργανικής χημείας.
Βιβλία δεύτερο επίπεδο δυσκολίαςεπίσης τρεις.
Θεωρητικές βάσειςγενική χημεία.
Θεωρητικά θεμέλια της ανόργανης χημείας.
Θεωρητικά θεμέλια της οργανικής χημείας.
|
Κεφάλαιο 1. Βασικές έννοιες της χημείας.
Κεφάλαιο 2. Οι σημαντικότερες κατηγορίες ανόργανων ενώσεων.
Κεφάλαιο 3. Βασικές πληροφορίες για τη δομή του ατόμου. Περιοδικός νόμος του D.I.Mendeleev.
Κεφάλαιο 4. Η έννοια του χημικού δεσμού. Κεφάλαιο 5. Λύσεις. Κεφάλαιο 6. Ηλεκτρολυτική διάσταση.
Κεφάλαιο 7. Η έννοια των οξειδοαναγωγικών αντιδράσεων. Κεφάλαιο 8. Υπολογισμοί με χρήση χημικών τύπων και εξισώσεων.
Εφαρμογή. |
Κεφάλαιο 1. Βασικές έννοιες της χημείας
Τι είναι η χημεία; Πού συναντάμε χημικά φαινόμενα;
Η χημεία είναι παντού. Η ίδια η ζωή είναι μια αμέτρητη ποικιλία χημικών αντιδράσεων χάρη στις οποίες αναπνέουμε, βλέπουμε τον γαλάζιο ουρανό, μυρίζουμε την εκπληκτική μυρωδιά των λουλουδιών.
Τι σπουδάζει η χημεία;
Η Χημεία μελετά τις ουσίες, καθώς και τις χημικές διεργασίες στις οποίες συμμετέχουν αυτές οι ουσίες.
Τι είναι μια ουσία;
Η ύλη είναι από τι αποτελείται ο κόσμος γύρω μας και εμείς οι ίδιοι.
Τι είναι μια χημική διαδικασία (φαινόμενο);
ΝΑ χημικά φαινόμεναΑυτές περιλαμβάνουν διεργασίες που έχουν ως αποτέλεσμα αλλαγές στη σύνθεση ή τη δομή των μορίων που σχηματίζουν μια δεδομένη ουσία*. Τα μόρια έχουν αλλάξει - η ουσία έχει αλλάξει (έχει γίνει διαφορετική), οι ιδιότητές της έχουν αλλάξει. Για παράδειγμα, το φρέσκο γάλα έγινε ξινό, τα πράσινα φύλλα έγιναν κίτρινα, το ωμό κρέας άλλαξε τη μυρωδιά του όταν τηγανίστηκε.
Όλες αυτές οι αλλαγές είναι συνέπεια πολύπλοκων και ποικίλων χημικών διεργασιών. Ωστόσο, τα σημάδια απλών χημικών αντιδράσεων, ως αποτέλεσμα των οποίων αλλάζει η σύνθεση και η δομή των μορίων, είναι τα ίδια: αλλαγή χρώματος, γεύσης ή οσμής, απελευθέρωση αερίου, φωτός ή θερμότητας, εμφάνιση ιζήματος.
Τι είναι τα μόρια, των οποίων η αλλαγή συνεπάγεται τόσο ποικίλες εκδηλώσεις;
Τα μόρια είναι τα μικρότερα σωματίδια μιας ουσίας, που αντικατοπτρίζουν την ποιοτική και ποσοτική της σύνθεση και τις χημικές της ιδιότητες.
Μελετώντας τη σύνθεση και τη δομή ενός μορίου, είναι δυνατό να προβλεφθούν πολλές ιδιότητες μιας δεδομένης ουσίας στο σύνολό της. Μια τέτοια έρευνα είναι ένα από τα κύρια καθήκοντα της χημείας.
Πώς είναι δομημένα τα μόρια; Από τι είναι φτιαγμένα;
Τα μόρια αποτελούνται από άτομα.Τα άτομα σε ένα μόριο συνδέονται με χημικούς δεσμούς. Κάθε άτομο χαρακτηρίζεται απόσύμβολο
(χημικό σύμβολο). Για παράδειγμα, το Η είναι άτομο υδρογόνου, το Ο είναι άτομο οξυγόνου. Ο αριθμός των ατόμων σε ένα μόριο υποδεικνύεται χρησιμοποιώνταςευρετήριο –
αριθμούς κάτω δεξιά μετά το σύμβολο.
Για παράδειγμα:
Παραδείγματα μορίων:
Το O 2 είναι ένα μόριο οξυγόνου που αποτελείται από δύο άτομα οξυγόνου.
Το H 2 O είναι ένα μόριο νερού που αποτελείται από δύο άτομα υδρογόνου και ένα άτομο οξυγόνου. Εάν τα άτομα δεν συνδέονται με χημικό δεσμό, τότε ο αριθμός τους υποδεικνύεται χρησιμοποιώνταςσυντελεστής -

αριθμοί πριν από το σύμβολο:
Ο αριθμός των μορίων απεικονίζεται παρόμοια:
2H 2 – δύο μόρια υδρογόνου.
3H 2 O – τρία μόρια νερού.
Γιατί τα άτομα υδρογόνου και οξυγόνου έχουν διαφορετικά ονόματα και διαφορετικά σύμβολα; Επειδή πρόκειται για άτομα διαφορετικών χημικών στοιχείων.
Ένα χημικό στοιχείο είναι ένας τύπος ατόμου με το ίδιο πυρηνικό φορτίο.
Τι είναι ο πυρήνας ενός ατόμου; Γιατί το πυρηνικό φορτίο είναι σημάδι ότι ένα άτομο ανήκει σε ένα δεδομένο χημικό στοιχείο; Για να απαντήσουμε σε αυτά τα ερωτήματα, είναι απαραίτητο να διευκρινίσουμε: αλλάζουν τα άτομα στις χημικές αντιδράσεις, από τι αποτελείται ένα άτομο;

Ένα ουδέτερο άτομο δεν έχει φορτίο, αν και αποτελείται από θετικά φορτισμένο πυρήνα και αρνητικά φορτισμένα ηλεκτρόνια:Κατά τη διάρκεια χημικών αντιδράσεων ο αριθμός των ηλεκτρονίων οποιουδήποτε ατόμου μπορεί να ποικίλλει, αλλάτο φορτίο του ατομικού πυρήνα δεν αλλάζει
. Επομένως, το φορτίο του πυρήνα ενός ατόμου είναι ένα είδος «διαβατηρίου» ενός χημικού στοιχείου. Όλα τα άτομα με πυρηνικό φορτίο +1 ανήκουν στο χημικό στοιχείο που ονομάζεται υδρογόνο.
Τα άτομα με πυρηνικό φορτίο +8 ανήκουν στο χημικό στοιχείο οξυγόνο.
Σε κάθε χημικό στοιχείο αποδίδεται ένα χημικό σύμβολο (σύμβολο), ένας σειριακός αριθμός στον πίνακα του Mendeleev (ο σειριακός αριθμός είναι ίσος με το φορτίο του ατομικού πυρήνα), ένα συγκεκριμένο όνομα και για ορισμένα χημικά στοιχεία μια ειδική ανάγνωση του συμβόλου στο. τον χημικό τύπο (Πίνακας 1).
| Πίνακας 1 | Σύμβολα (σημάδια) χημικών στοιχείων | Οχι. | Αρ. στον πίνακα του D.I Mendeleev | Σύμβολο |
| 1 | 1 | Διαβάζοντας στον τύπο | Ονομα | H |
| 2 | 6 | φλαμουριά | Υδρογόνο | ντο |
| 3 | 7 | αυτό | Ανθρακας | Ν |
| 4 | 8 | en | Αζωτο | Ο |
| 5 | 9 | Ο | Οξυγόνο | φά |
| 6 | 11 | φθόριο | Φθόριο | Να |
| 7 | 12 | νάτριο | Νάτριο | Mg |
| 8 | 13 | μαγνήσιο | Μαγνήσιο | Ο Αλ |
| 9 | 14 | αλουμίνιο | Αλουμίνιο | Σι |
| 10 | 15 | πυρίτιο | Πυρίτιο | Π |
| 11 | 16 | πε | Φώσφορος | μικρό |
| 12 | 17 | es | Θείο | Cl |
| 13 | 19 | χλώριο | Χλώριο | Κ |
| 14 | 20 | κάλιο | Κάλιο | Ασβέστιο |
| 15 | 23 | V | βανάδιο | Βανάδιο |
| 16 | 24 | Cr | χρώμιο | Χρώμιο |
| 17 | 25 | Mn | μαγγάνιο | Μαγγάνιο |
| 18 | 26 | Fe | σίδηρος | Σίδερο |
| 19 | 29 | Cu | χαλκός | Χαλκός |
| 20 | 30 | Zn | ψευδάργυρος | Ψευδάργυρος |
| 21 | 35 | Br | βρώμιο | Βρώμιο |
| 22 | 47 | Αγ | argentum | Ασήμι |
| 23 | 50 | Sn | κασσίτερος | Κασσίτερος |
| 24 | 53 | εγώ | ιώδιο | Ιώδιο |
| 25 | 56 | Ba | βάριο | Βάριο |
| 26 | 79 | Au | aurum | Χρυσός |
| 27 | 80 | Hg | υδράργυρο | Υδράργυρος |
| 28 | 82 | Pb | plumbum | Μόλυβδος |
Υπάρχουν ουσίες απλός Και συγκρότημα . Εάν ένα μόριο αποτελείται από άτομα ενός χημικού στοιχείου, είναιαπλή ουσία.
Απλές ουσίες - Ca, Cl 2, O 3, S 8, κ.λπ. Μόριασύνθετες ουσίες
αποτελούνται από άτομα διαφορετικών χημικών στοιχείων. Σύνθετες ουσίες - H 2 O, NO, H 3 PO 4, C 12 H 22 O 11, κ.λπ.Εργασία 1.1.
Αναφέρετε τον αριθμό των ατόμων στα μόρια των σύνθετων ουσιών H 2 O, NO, H 3 PO 4, C 12 H 22 O 11, ονομάστε αυτά τα άτομα.
Τίθεται το ερώτημα: γιατί ο τύπος H 2 O γράφεται πάντα για το νερό, και όχι HO ή HO 2;
Η εμπειρία αποδεικνύει ότι η σύνθεση του νερού που λαμβάνεται με οποιαδήποτε μέθοδο ή λαμβάνεται από οποιαδήποτε πηγή αντιστοιχεί πάντα στον τύπο H 2 O (μιλάμε για καθαρό νερό).Το γεγονός είναι ότι τα άτομα σε ένα μόριο νερού και σε ένα μόριο οποιασδήποτε άλλης ουσίας συνδέονται μέσω χημικών δεσμών. Ένας χημικός δεσμός συνδέει τουλάχιστον δύο άτομα. Επομένως, εάν ένα μόριο αποτελείται από δύο άτομα και το ένα από αυτά σχηματίζει τρεις χημικούς δεσμούς, τότε το άλλο σχηματίζει επίσης τρεις χημικούς δεσμούς. Αριθμός χημικών δεσμών.
που σχηματίζεται από ένα άτομο ονομάζεται
σθένος
Εάν ορίσουμε κάθε χημικό δεσμό με μια παύλα, τότε για ένα μόριο δύο ατόμων ΑΒ λαμβάνουμε ΑΒ, όπου τρεις παύλες υποδεικνύουν τους τρεις δεσμούς που σχηματίζονται από τα στοιχεία Α και Β μεταξύ τους.
Σε αυτό το μόριο, τα άτομα Α και Β είναι τρισθενή.
Είναι γνωστό ότι το άτομο οξυγόνου είναι δισθενές, το άτομο υδρογόνου είναι μονοσθενές.
Ερώτηση. Πόσα άτομα υδρογόνου μπορούν να προσκολληθούν σε ένα άτομο οξυγόνου;
ΑΠΑΝΤΗΣΗ: Δύο άτομα. Η σύνθεση του νερού περιγράφεται με τον τύπο H–O–H, ή H 2 O. ΘΥΜΑΜΑΙ! Ένα σταθερό μόριο δεν μπορεί να έχει «ελεύθερα» ή «έξτρα» σθένη. Επομένως, για ένα μόριο δύο στοιχείων, ο αριθμός των χημικών δεσμών (σθένη) των ατόμων ενός στοιχείου είναι ίσος με τον συνολικό αριθμό των χημικών δεσμών των ατόμων του άλλου στοιχείου.Σθένος ατόμων ορισμένων χημικών στοιχείων
συνεχής
(Πίνακας 2).
Πίνακας 2 Η τιμή των σταθερών σθένων ορισμένων στοιχείωνΓια άλλα άτομα, το σθένος** μπορεί να προσδιοριστεί (υπολογιστεί) από τον χημικό τύπο της ουσίας. Σε αυτή την περίπτωση, είναι απαραίτητο να ληφθεί υπόψη ο κανόνας που αναφέρεται παραπάνω σχετικά με τους χημικούς δεσμούς. Για παράδειγμα, ας ορίσουμε το σθένος
xμαγγάνιο Mn σύμφωνα με τον τύπο της ουσίας MnO 2:
Η τιμή των σταθερών σθένων ορισμένων στοιχείωνΣυνολικός αριθμός οι χημικοί δεσμοί που σχηματίζονται από το ένα και το άλλο στοιχείο (Mn και O) είναι ίδιοι:= 4, δηλ. Σε αυτόν τον χημικό τύπο, το μαγγάνιο είναι τετρασθενές.
ΠΡΑΚΤΙΚΑ ΣΥΜΠΕΡΑΣΜΑΤΑ
1. Εάν ένα από τα άτομα του μορίου είναι μονοσθενές, τότε το σθένος του δεύτερου ατόμου είναι ίσο με τον αριθμό των ατόμων του πρώτου στοιχείου (δείτε ευρετήριο!):
2. Αν ο αριθμός των ατόμων σε ένα μόριο είναι ο ίδιος, τότε το σθένος του πρώτου ατόμου είναι ίσο με το σθένος του δεύτερου ατόμου:
3. Αν ένα από τα άτομα δεν έχει δείκτη, τότε το σθένος του είναι ίσο με το γινόμενο του σθένους του δεύτερου ατόμου από τον δείκτη του:
![]()
4. Σε άλλες περιπτώσεις, βάλτε τα σθένη «σταυρωτά», δηλ. το σθένος ενός στοιχείου είναι ίσο με τον δείκτη ενός άλλου στοιχείου:
Εργασία 1.2.Προσδιορίστε τα σθένη των στοιχείων σε ενώσεις:
CO 2, CO, Mn 2 O 7, Cl 2 O, P 2 O 3, AlP, Na 2 S, NH 3, Mg 3 N 2.
Ενδειξη. Πρώτα, υποδείξτε το σθένος των ατόμων για τα οποία είναι σταθερό. Με τον ίδιο τρόπο προσδιορίζεται το σθένος των ατομικών ομάδων OH, PO 4, SO 4 κ.λπ.
Εργασία 1.3.Προσδιορίστε τα σθένη των ατομικών ομάδων (υπογραμμισμένα στους τύπους):
H 3 ταχυδρομείο 4, Ca( OH) 2 , Ca 3 ( ταχυδρομείο 4) 2, Η 2 ΕΤΣΙ 4, Cu ΕΤΣΙ 4 .
(Παρακαλώ σημειώστε! Πανομοιότυπες ομάδες ατόμων έχουν ίδια σθένησε όλες τις συνδέσεις.)
Γνωρίζοντας τα σθένη ενός ατόμου ή μιας ομάδας ατόμων, μπορείτε να δημιουργήσετε έναν τύπο για μια ένωση. Για να το κάνετε αυτό, χρησιμοποιήστε τους ακόλουθους κανόνες.
Αν τα σθένη των ατόμων είναι τα ίδια, τότε ο αριθμός των ατόμων είναι ίδιος, δηλ. Δεν βάζουμε ευρετήρια:
Εάν τα σθένη είναι πολλαπλάσια (και τα δύο διαιρούνται με τον ίδιο αριθμό), τότε ο αριθμός των ατόμων του στοιχείου με χαμηλότερο σθένος προσδιορίζεται με διαίρεση:
Σε άλλες περιπτώσεις, οι δείκτες προσδιορίζονται «διασταυρωτικά»:
Εργασία 1.4.Συνθέτω χημικούς τύπουςσυνδέσεις:

Ουσίες των οποίων η σύνθεση αντανακλάται από χημικούς τύπους μπορούν να συμμετέχουν σε χημικές διεργασίες (αντιδράσεις). Ο γραφικός συμβολισμός που αντιστοιχεί σε μια δεδομένη χημική αντίδραση ονομάζεται εξίσωση αντίδρασης. Για παράδειγμα, όταν καίγεται ο άνθρακας (αλληλεπιδρά με το οξυγόνο), εμφανίζεται μια χημική αντίδραση:
C + O 2 = CO 2.
Η καταγραφή δείχνει ότι ένα άτομο άνθρακα C, σε συνδυασμό με ένα μόριο οξυγόνου O 2, σχηματίζει ένα μόριο διοξείδιο του άνθρακα CO2. Ο αριθμός των ατόμων κάθε χημικού στοιχείου πριν και μετά την αντίδραση πρέπει να είναι ο ίδιος. Αυτός ο κανόνας είναι συνέπεια του νόμου της διατήρησης της μάζας της ύλης. Νόμος διατήρησης της μάζας: η μάζα των αρχικών ουσιών είναι ίση με τη μάζα των προϊόντων της αντίδρασης.
Ο νόμος ανακαλύφθηκε τον 18ο αιώνα. M.V Lomonosov και, ανεξάρτητα από αυτόν, A.L. Lavoisier.
Για την εκπλήρωση αυτού του νόμου, είναι απαραίτητο να διευθετηθούν οι συντελεστές στις εξισώσεις των χημικών αντιδράσεων έτσι ώστε ο αριθμός των ατόμων κάθε χημικού στοιχείου να μην μεταβάλλεται ως αποτέλεσμα της αντίδρασης.
Για παράδειγμα, η αποσύνθεση του άλατος Berthollet KClO 3 παράγει αλάτι KCl και οξυγόνο O 2:
KClO 3 KCl + O 2.

Ο αριθμός των ατόμων καλίου και χλωρίου είναι ο ίδιος, αλλά ο αριθμός των ατόμων οξυγόνου είναι διαφορετικός. Ας τα ισοφαρίσουμε:
![]()
Τώρα ο αριθμός των ατόμων καλίου και χλωρίου πριν από την αντίδραση έχει αλλάξει. Ας τα ισοφαρίσουμε:
Τέλος, μπορείτε να βάλετε ένα σύμβολο ίσου μεταξύ της δεξιάς και της αριστερής πλευράς της εξίσωσης:
2KClO 3 = 2KСl + 3О 2. Το αρχείο που προκύπτει δείχνει ότι η αποσύνθεση της σύνθετης ουσίας KClO 3 παράγει δύο νέες ουσίες - το σύνθετο KCl και το απλό - οξυγόνο O 2. Οι αριθμοί μπροστά από τους τύπους των ουσιών στις εξισώσεις των χημικών αντιδράσεων λέγονται.
συντελεστές
Κατά την επιλογή συντελεστών, δεν είναι απαραίτητο να μετράτε μεμονωμένα άτομα. Εάν η σύνθεση ορισμένων ατομικών ομάδων δεν έχει αλλάξει κατά τη διάρκεια της αντίδρασης, τότε ο αριθμός αυτών των ομάδων μπορεί να ληφθεί υπόψη, θεωρώντας ότι είναι ένα ενιαίο σύνολο. Ας δημιουργήσουμε μια εξίσωση για την αντίδραση των ουσιών CaCl 2 και Na 3 PO 4:
CaCl 2 + Na 3 PO 4 ……………….
ΑΚΟΛΟΥΘΙΑ ΕΝΕΡΓΕΙΩΝ
![]()
1) Ας προσδιορίσουμε το σθένος των αρχικών ατόμων και της ομάδας PO 4:
2) Ας γράψουμε τη δεξιά πλευρά της εξίσωσης (χωρίς δείκτες προς το παρόν, οι τύποι των ουσιών σε παρένθεση πρέπει να διευκρινιστούν):
![]()
3) Ας συνθέσουμε τους χημικούς τύπους των ουσιών που προκύπτουν με βάση τα σθένη των συστατικών τους μερών:

4) Ας δώσουμε προσοχή στη σύνθεση της πιο σύνθετης ένωσης Ca 3 (PO 4) 2 και ας εξισώσουμε τον αριθμό των ατόμων ασβεστίου (υπάρχουν τρία από αυτά) και τον αριθμό των ομάδων PO 4 (υπάρχουν δύο):
5) Ο αριθμός των ατόμων νατρίου και χλωρίου πριν από την αντίδραση είναι τώρα έξι. Ας βάλουμε τον αντίστοιχο συντελεστή στη δεξιά πλευρά του διαγράμματος πριν από τον τύπο NaCl:
3CaCl 2 + 2Na 3 PO 4 = Ca 3 (PO 4) 2 + 6NaCl.
Χρησιμοποιώντας αυτήν την ακολουθία, είναι δυνατό να εξισωθούν τα σχήματα πολλών χημικών αντιδράσεων (με εξαίρεση τις πιο περίπλοκες αντιδράσεις οξειδοαναγωγής, βλέπε Κεφάλαιο 7). Τύποι χημικών αντιδράσεων. Συμβαίνουν χημικές αντιδράσειςδιαφορετικών τύπων
1. . Οι τέσσερις κύριοι τύποι είναι η σύνδεση, η αποσύνθεση, η αντικατάσταση και η ανταλλαγή.Σύνθετες αντιδράσεις
αριθμούς κάτω δεξιά μετά το σύμβολο.
– από δύο ή περισσότερες ουσίες σχηματίζεται μία ουσία:
2. Ca + Cl 2 = CaCl 2.Αντιδράσεις αποσύνθεσης
αριθμούς κάτω δεξιά μετά το σύμβολο.
– από μία ουσία λαμβάνονται δύο ή περισσότερες ουσίες:
3. Ca(HCO 3) 2 CaCO 3 + CO 2 + H 2 O.Αντιδράσεις υποκατάστασης
– αντιδρούν απλές και σύνθετες ουσίες, σχηματίζονται επίσης απλές και σύνθετες ουσίες και η απλή ουσία αντικαθιστά μέρος των ατόμων της σύνθετης ουσίας:
αριθμούς κάτω δεξιά μετά το σύμβολο.
A + BX AX + B.
4. Fe + CuSO 4 = Cu + FeSO 4.– εδώ αντιδρούν δύο σύνθετες ουσίες και προκύπτουν δύο σύνθετες ουσίες. Κατά τη διάρκεια της αντίδρασης, οι σύνθετες ουσίες ανταλλάσσουν τα συστατικά τους μέρη:
Ασκήσεις για το Κεφάλαιο 1
1. Μάθετε τον πίνακα. 1. Δοκιμάστε τον εαυτό σας, γράψτε τα χημικά σύμβολα: θείο, ψευδάργυρος, κασσίτερος, μαγνήσιο, μαγγάνιο, κάλιο, ασβέστιο, μόλυβδος, σίδηρος και φθόριο.
2. Να γράψετε τα σύμβολα των χημικών στοιχείων που προφέρονται σε τύπους ως: «στάχτη», «ο», «κούπρουμ», «ες», «πε», «υδράργυρο», «στάννουμ», «πλούμπουμ», «εν», “ferrum” , “ce”, “argentum”.
3. Ονομάστε αυτά τα στοιχεία.
Να αναφέρετε τον αριθμό των ατόμων κάθε χημικού στοιχείου στους τύπους των ενώσεων:
4. Al 2 S 3, CaS, MnO 2, NH 3, Mg 3 P 2, SO 3.
Προσδιορίστε ποιες ουσίες είναι απλές και ποιες σύνθετες:
Na 2 O, Na, O 2, CaCl 2, Cl 2.
5. Διαβάστε τους τύπους αυτών των ουσιών.

6. Μάθετε τον πίνακα. 2. Δημιουργήστε χημικούς τύπους ουσιών με βάση το γνωστό σθένος στοιχείων και ατομικών ομάδων:
Προσδιορίστε το σθένος των χημικών στοιχείων σε ενώσεις:
7. N 2 O, Fe 2 O 3, PbO 2, N 2 O 5, HBr, SiH 4, H 2 S, MnO, Al 2 S 3.
Τακτοποιήστε τους συντελεστές και υποδείξτε τα είδη των χημικών αντιδράσεων:
α) Mg + O 2 MgO;
β) Al + CuCl 2 AlCl 3 + Cu;
γ) NaNO 3 NaNO 2 + O 2;
δ) AgNO 3 + BaCl 2 AgCl + Ba(NO 3) 2;
ε) Al + HCl AlCl 3 + H 2;
ε) KOH + H 3 PO 4 K 3 PO 4 + H 2 O;
ζ) CH 4 C 2 H 2 + H 2 .
* Υπάρχουν ουσίες που δεν κατασκευάζονται από μόρια. Αλλά αυτές οι ουσίες θα συζητηθούν αργότερα (βλ. Κεφάλαιο 4).
** Αυστηρά μιλώντας, σύμφωνα με τους παρακάτω κανόνες, δεν προσδιορίζεται το σθένος, αλλά η κατάσταση οξείδωσης (βλ. Κεφάλαιο 7).